
问题:
怎样才能让我的工作学习更有效率呢??
答案:
只需要点击图片上边蓝字
一药一世界
即可!
中国加入ICH意味着中国在药品研发和注册国际化道路上迈出了历史性一步,CFDA在国际药品研发和注册技术要求领域有了发言权和参与决策权,中国医药产业面临挑战的同时也获得巨大的发展机遇!加入ICH更是CFDA药品监管水平和能力获得国际认可的标志。可以预见,在CFDA加入ICH后,我国药品审评审批改革的步伐将加快。如何与国际接轨,我们药品研发人员,就要熟知ICH相关指导原则,并能按照指导原则有效的去执行。
在ICH分别于2002年2月及2003年2月颁布的《新原料药的杂质研究指导原则》(简称Q3A(R))与《新制剂的杂质研究指导原则》(简称Q3B(R))中,为便于控制各类杂质的限度,将药品中的有机杂质细分为特定杂质(Specified Impurities)和非特定杂质(Unspecified Impurities)。特定杂质是指在质量标准中分别规定了明确的限度,并单独进行控制的杂质。特定杂质包括结构已知的杂质和结构未知的杂质。对于结构未知的杂质,为便于在标准中进行指认,一般采用代号(如未知杂质A等)或合适的定性分析指标(如相对保留时间为0.8的杂质)加以区分。
非特定杂质是指在质量标准中未单独列出,而仅采用一个通用的限度进行控制的一系列杂质,其在药品中出现的种类与几率并不固定。由于非特定杂质的不确定性,因此,在药品的临床前与临床研究中,很难对这些杂质的安全性进行评价。为将这些杂质可能带来的安全性隐患降至最小,在ICH的以上杂质指导原则中,对其限度做了明确的规定。《新原料药的杂质研究指导原则》中要求:在原料药质量标准中任一单个非特定杂质的限度不得过鉴定限度(见表1)。
表1:原料药的杂质限度
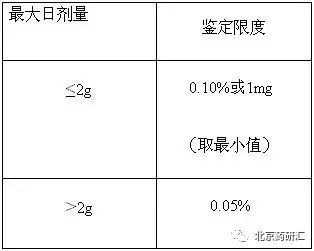
而对于制剂而言,由于原料药的质量标准已对各杂质进行了控制,在制剂的质量标准中仅控制降解产物,故在《新制剂的杂质研究指导原则》中规定:在制剂质量标准中任一单个非特定降解产物的限度不得过鉴定限度(见表2)。
表2:制剂的杂质限度 。
根据以上规定可以引申出:在仿制药或改剂型药品以及药品上市后变更等的研究中,即使出现了新的杂质,只要新杂质的含量低于表1或表2中的鉴定限度,就可以认可这些新杂质的安全性。
从以上指导原则的规定,也可以看出:现在国际上对非特定杂质的限度要求是比较严格的。而我国在这方面尚处于起步阶段,仅一些质量控制比较严格的质量标准才收载有对非特定杂质的限度要求,且具体限度远远大于鉴定限度,也不考虑临床用量,只一般性地规定为“任一单个杂质不得过0.5%甚至1.0%”。从保证药品的安全性与从严控制产品质量的角度出发,我国应加强对特定杂质的控制。希望本文能引起有关各方对非特定杂质的关注,使我国在这方面的要求逐渐与国际接轨,以利于我国的制剂成品走向欧美等国际市场。

扫码上车,让医药工作学习更高效!





