
本文系生物谷原创编译,欢迎分享,转载须授权!
化疗,放疗或手术摘除。过去几十年,人们只能用这种“大规模杀伤性武器”来对付癌症。但是如今病人,他们的亲人和医师都会想要一种更好的疗法。
除了化疗、放疗和手术摘除之外,免疫疗法是作为所谓的癌症疗法的第四支柱出现的。不同于这些较早的方法,免疫疗法的工作机制是增强人体的免疫系统检测和消除癌症的天然能力。
“增强人体的免疫系统”可能听起来较为简单,但是对像癌症等敌人而言,增强免疫力如果仅仅是靠摄入维生素C,是不会有成效的。
人们正在投入数十亿美元的研究资金(包括来自奥巴马政府癌症登月计划的)旨在发现新的分子工具来增强免疫系统抵抗所有癌症的能力。鉴于这些新的疗法开始发挥作用,一些研究人员正在关注其他的地方:降低成本。
制造更好地识别癌症的抗体
抗体是免疫系统的一个天然的部分。它们的作用是结合到特定的分子(包括在细胞表面上发现的蛋白)上。如果抗体能够结合它们的靶标,那么它们能够(在某些情形下)招募免疫系统的其他部分来消灭它。
如今可获得的最为知名的抗癌抗体药物是曲妥珠单抗(trastuzumab,商品名赫塞汀)。在某些癌症中,一种生长相关的蛋白HER2在癌细胞表面上过量存在[1]。赫塞汀结合到HER2上,这不仅会延缓肿瘤生长[2],而且允许免疫系统的其余部分发起攻击[3]。
癌细胞表现出致命弱点---HER2生物标志物(红点),图片来自Journal of
Pathology Informatics CC-NC-SA。
经证实在一些病人中,赫塞汀有效地抵抗HER2阳性乳腺癌,不过正如其他的基于抗体的癌症治疗药物那样,它并不是廉价的[4],而且有产生副作用的风险[5]。
解除对T细胞的抑制
我们如今知道一种特定的被称作杀伤性T细胞的白细胞能够摧毁癌细胞。
为了避免被免疫系统攻击,当杀伤性T细胞靠近时,健康的细胞携带着关闭它们的分子。当正常的细胞发生癌变时,一些细胞给它们自己披上所谓的“免疫检查点”分子[6],从而允许它们延缓强健的免疫系统发起的攻击。这个过程被称作免疫编辑(immunoediting)[7]。如今,它是很多最为危险的癌症的一种特征[8]。
一种这样的免疫检查点分子是蛋白PD-L1。它通过拨动杀伤性T细胞表面上的一个开关抑制这些T细胞[9]。当癌症获得表达更多的PD-L1的能力时,它变得更加有效地抑制T细胞。
在美国,破坏这个过程的定制抗体(designer
antibody)对不可动手术的转移性黑色素瘤、某些非小细胞肺癌、肾细胞癌和经典型霍奇金淋巴瘤病人是可获得的。
纳武单抗(nivolumab)就是这样的一种已被证实的药物,但是,正如很多工程抗体一样,它的价格非常昂贵。到底有多昂贵?
美国斯隆凯特林癌症纪念中心胃肠道肿瘤科主任Leonard
Saltz博士说,“大约是黄金价格的4000倍。”在2015年美国临床肿瘤学会(American
Society of Clinical Oncology)年度会议上[10],Saltz提醒道,“作为一名医师,我想要这些药物和类似它们的其他药物可供我的病人们使用。针对我们将如何使它们可用到和让它们的差异最小化,我有一个大的问题,那就是这些药物的价格太高了。”
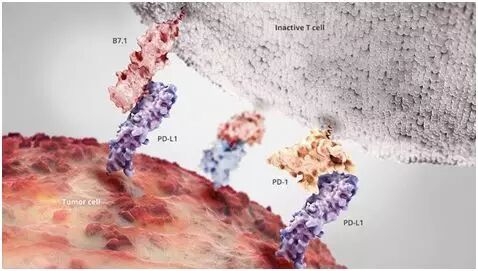
一种微妙的分子平衡允许免疫系统辨别敌我,癌症就利用这一点,图片来自Genentech。
美国华盛顿大学蛋白设计学院蛋白工程师Cassie
Bryan正在努力发现一种新的更加实惠的方法来破坏癌症在分子水平上让T细胞失去功能的能力。
通过与来自美国西雅图儿童医院和弗雷德-哈金森癌症研究中心的肿瘤学家合作,Bryan制造出一种微小的非抗体蛋白,该蛋白以一种应当会阻止PD-L1让T细胞失活的方式结合这些细胞上。这类新的计算机产生的免疫检查点抑制剂因具有较小的尺寸应当比工程抗体容易制造而且很快将针对它们的T细胞增强活性进行测试。
通过基因改造加以强化的T细胞
癌症免疫疗法的最新前沿是一种被称作过继细胞治疗的精准疗法。它涉及从单个病人的血液中分离出T细胞,在实验室中增强它们的抗癌活性,随后将这些功能增强的T细胞重新灌注回同一病人体内。直接利用药物[11]或者通过基因工程手段[12]处理这些分离出的T细胞,就能够增强它们的活性。
单次灌注功能增强的T细胞能够在一些病人体内产生令人吃惊的结果,包括难治性疾病完全缓解。
由这个领域的先驱Stanley
Riddell和同事们开展的一项正在进行的过继细胞疗法临床试验的初步结果[13]揭示出在29名招募的晚期急性淋巴细胞白血病(ALL)病人当中,90%以上的人(27人)获得缓解;在30名招募的非霍奇金淋巴瘤病人当中,63%的人(19人)获得缓解。
在接受单次持续半小时的接受基因改造的T细胞灌注后,一名病人注意到他的肿瘤“像冰块那样融化掉”。
Riddell认为这些结果是“非常令人震惊的”。
我们仍然处于过继细胞疗法的初期开发阶段。就如今而言,经证实血癌比难以穿透的实体瘤[14]更容易遭受攻击。鉴于这种疗法涉及在实验室中对单个病人的T细胞进行基因改造,它的成本和广泛的可获得性是令人关注的。
一种更一般的疗法?
几个研究团队和私营企业正在努力通过增强和储存能够灌注回多名病人体内的通用型T细胞[15]或者通过构建从实验室转移到病人中的
纳米颗粒[16],开发更一般的T细胞疗法。
为了有助实现后者,一个研究团队已开发出可注射的纳米颗粒[17],这些纳米颗粒携带着重编程T细胞以便更好抵抗癌症所需的DNA。接受这种纳米颗粒治疗的小鼠表现出与接受更加常规的实验室优化的T细胞灌注的小鼠相同的白血病消退率。
在这些实验性疗法中,没有一种是没有风险的。解除对T细胞的抑制允许免疫系统攻击癌症,但是如果T细胞失去控制,那么其他的健康细胞可能会遭受伤害。通过预计这一点,研究人员已开始将“自杀基因[18]”导入到工程T细胞中。
免疫疗法代表着肿瘤学和生物技术的发展前沿。我们对基础生物学的理解和我们操纵它的工具存在关联,而且正在产生历史上的一些最有前景的癌症治疗突破。
参考资料:
[1]The HER-2/neu Oncogene in Breast Cancer: Prognostic Factor,
Predictive Factor, and Target for Therapy
Stem Cells, November 1998,
doi:10.1002/stem.160413
[2]Nonclinical
studies addressing the mechanism of action of trastuzumab
(Herceptin)
Seminars in Oncology, 01 Aug 1999, PMID:10482195
[3]Inhibitory Fc receptors modulate in vivo cytoxicity against tumor
targets
Nature Medicine, 2000, doi:10.1038/74704
[4]Cost-Effectiveness Analysis of Trastuzumab (Herceptin) in
HER2-Overexpressed Metastatic Breast Cancer
American Journal of Clinical
Oncology, October 2009, doi:10.1097/COC.0b013e3181931277
[5]Efficacy and safety of trastuzumab in early breast
cancer
[6]Overexpression of PD-L1 Significantly Associates with Tumor
Aggressiveness and Postoperative Recurrence in Human Hepatocellular
Carcinoma
Clinical Cancer Research,
doi:10.1158/1078-0432.CCR-08-1608
[7]New insights into cancer
immunoediting and its three component phases — elimination, equilibrium and
escape
Current Opinion in Immunology,
doi:10.1016/j.coi.2014.01.004
[8]Hallmarks of Cancer: The Next
Generation
Cell, doi:10.1016/j.cell.2011.02.013
[9]Involvement of
PD-L1 on tumor cells in the escape from host immune system and tumor
immunotherapy by PD-L1 blockade
PNAS,
doi:10.1073/pnas.192461099
[10]Treating with Checkpoint Inhibitors—Figure $1 Million per
Patient
[11]Abstract 2293: Vector-free engineering of immune cells
for adoptive cell therapy
Cancer Research,
doi:10.1158/1538-7445.AM2016-2293
[12]Adoptive cell therapy for the
treatment of patients with metastatic melanoma
Current Opinion in Immunology,
doi:10.1016/j.coi.2009.03.002
[13]Dramatic remissions seen in immunotherapy trial of blood cancer
patients
[14]CAR T Cell Therapy for Solid Tumors
Annual Review of
Medicine, doi:10.1146/annurev-med-062315-120245
[15]Multiplex
Genome-Edited T-cell Manufacturing Platform for “Off-the-Shelf” Adoptive T-cell
Immunotherapies
Cancer Research,
doi:10.1158/0008-5472.CAN-14-3321
[16]Nanoparticles Create Effective CAR T Cells in Living
Mice
[17]In situ programming of leukaemia-specific T cells using
synthetic DNA nanocarriers
Nature Nanotechnology,
doi:10.1038/nnano.2017.57
[18]Inducible Apoptosis as a Safety Switch for
Adoptive Cell Therapy
NEJM, doi:10.1056/NEJMoa1106152
[19]As scientists train the immune system to fight cancer, others look
to combat costs

会议时间:2017.6.23——24日
会议地点:海南海口鲁能希尔顿酒店
会议官网:http://meeting.bioon.com/2017cell-therapies
联系我们:
参会和媒体合作:
梅欢欢
E-mail: [email protected]
M t :152 2183 6640
赞助和大会咨询:
陈琼
E-mail: [email protected]
M t :180 1700 5955
点击【阅读原文】了解详情及报名















