BioArt按:从今日起,BioArt将推出“国科大论坛”系列专题文章,旨在鼓励中国科学院大学(UCAS)生命学院的优秀本科生接触学术最前沿,激发他们对生命科学某些领域深层次的理解,同时也将会锻炼他们对科学报道的写作能力。该论坛的推出,得益于中科院生物物理所苗龙研究员的大力支持。苗老师本学期在中国科学院大学给本科生(2014级,国科大第一届本科生)讲授《发育生物学》课程的同时,给学生布置了相关“作业”并鼓励他们积极投稿BioArt发表。本着鼓励学生积极进取、勤于思考的想法,BioArt开辟了这个专栏,给他们提供一个展示自我学习能力的舞台。同时,也希望他们“不忘初心”,有志于将来成为能够一流的科学家。今日BioArt推出第一篇文章,这篇文章解读的是近日加州大学Ronald D. Vale教授(HHMI研究员,美国科学院院士,拉斯克基础医学奖得主)实验室在Nature杂志上以长文形式(Article)发表的题为“RNA phase transitions in repeat expansion disorders”的论文,该研究主要表明了RNA相变对神经疾病的影响及其分子机理。

撰文丨刘烨(中国科学院大学2014级本科生)
摘要:细胞中重复序列RNA异常聚集是许多神经疾病的特点。并且只有当序列重复数目足够多,达到一定数量阈值的时候,才会出现RNA聚集与疾病特征。但其中的分子机理还不明确。Nature杂志5月31日在线发表了题为“RNA phase transitions in repeat expansion disorders”的研究成果,这项研究6月8日正式刊登。来自美国霍华德休斯医学研究所的两位科学家Ankur Jain与Ronald D. Vale的研究表明,重复序列的扩张导致RNA分子内多碱基互补配对,造成RNA进行溶胶-凝胶相转换。而这种相变可能导致神经疾病。
背景介绍:
短核苷酸重复-扩张(short nucleotide repeat expansion)指一段有核苷酸重复序列的DNA扩张为原来的几倍。很多常见的遗传性神经疾病与短核苷酸重复-扩张有关,比如亨廷顿症中的CAG重复,肌张力障碍中的CTG重复,以及家族性肌萎缩侧索硬化中的GGGGCC重复。
当这种重复扩张发生在非编码区的时候,被剪切下来不翻译的重复RNA序列会异常积累,称为RNA团簇(RNA foci)【1】 。异常聚集的RNA发生相变,具有类似固体的行为,成为RNA凝胶。只有当核苷酸重复数目达到一定阈值,才会发生RNA团簇。但这种RNA聚集的分子机制还不明朗。
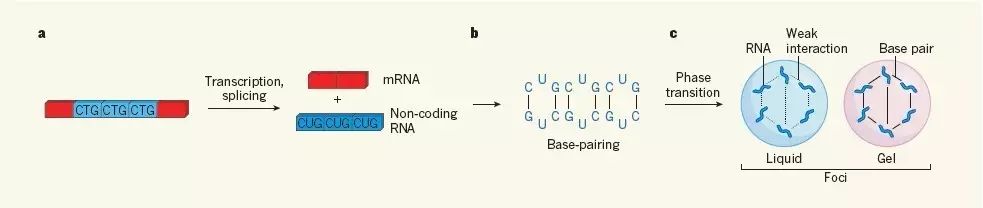
图1 RNA团簇过程。非编码RNA碱基互补作用,聚集成为凝溶胶。引自:Sanders, D. W., & Brangwynne, C. P. (2017). Neurodegenerative disease: RNA repeats put a freeze on cells. Nature, 546(7657), 215-216.
为了解释重复序列与神经疾病相关的机制,人们提出了几种假设,其中之一认为,重复序列RNA形成异常团簇积累在核中,隔离RNA结合蛋白,影响其正常作用,破坏细胞自稳态。来自美国霍华德休斯医学研究所的两位科学家Ankur Jain与Ronald D. Vale的研究表明,短序列重复RNA特殊的物化性质导致RNA相变,形成团簇,可能通过隔离细胞内相关蛋白,导致神经疾病【2】 。
文章解读:
首先,为了探究RNA形成团簇的行为,他们用重复序列RNA进行体外实验,观察到几种与已知疾病相关的RNA在微摩尔量级下都形成了团簇,当重复数目达到阈值后,团簇大小随重复数目增加而增加。光漂白实验(fluorescence recovery after photobleaching,FRAP)显示团簇中的RNA行为类似固体,他们将这种状态的RNA称作“RNA凝胶”。
随后他们证实这些RNA最初发生相分离,先变成球状液滴,但由于分子间的相互作用增加,很快变成凝胶,这也解释了为什么只有重复数目达阈值的RNA序列才与疾病相关。为了研究凝胶形成的机制,他们在体外加入干扰RNA碱基互补相互作用的分子,发现可以消除RNA团簇,从而证实了碱基相互作用对RNA聚集的重要性。
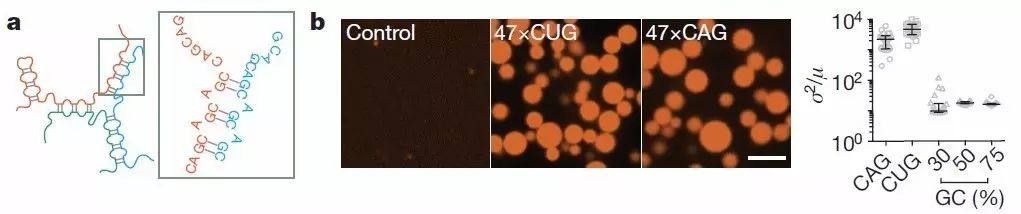
图2 a,CAG重复RNA(与亨廷顿舞蹈症相关)碱基相互作用示例;b,荧光显微图,显示Control组没有出现聚集,47倍重复的CUG序列与CAG序列出现聚集。
接下来作者开始探究细胞中重复序列RNA的聚集行为是否与体外一致。他们观察到细胞内的RNA团簇主要存在于核小斑中,但并不清楚其中的原因。核小斑是一种无膜的细胞器,在信使RNA剪接中有重要作用。他们还发现团簇会募集MBNL1蛋白,这种蛋白与神经疾病有关,是细胞发育分化必需蛋白【3】 。结合荧光原位杂交结果,作者得出结论,短序列重复的RNA留在细胞核内,隔离剪接因子。并且当碱基配对被阻碍时,RNA团簇会被消除,这与体外实验一致。
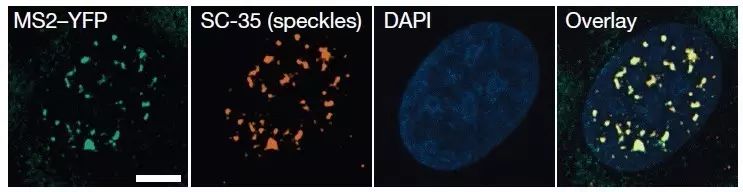
图3 RNA,核小斑与细胞核免疫荧光染色照片。绿色为CAG重复序列,红色为核小斑。将红色荧光与绿色荧光重叠(黄色),可以发现重复序列与核小斑在同一位置。
另外,荧光漂白恢复实验表明体内GGGGCC重复序列聚集的状态更像固体。相对于CAG重复序列,他们认为两种RNA聚集状态不同是因为GGGGCC序列中的碱基会形成稀有的Hoogsteen配对,进而组成四重螺旋,分子间相互作用更强。Hoogsteen配对与Watson-Crick碱基配对的区别在于配对时形成氢键的原子不同,这使得经典双螺旋结构被扭曲,在碱基G数量合适时,容易形成四重螺旋。再一次强调了RNA分子内碱基相互作用是RNA相变的原因。
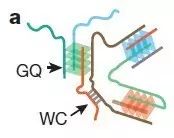
图4 GGGGCC重复RNA多聚化图示。GQ:四重螺旋;WC:Watson-Crick双螺旋。
这篇文章揭示了RNA可以自身发生凝胶化,RNA分子内碱基配对促使其在核内形成聚集团簇,可能通过在核小斑中招募并隔离相关蛋白因子影响细胞功能,导致神经疾病。因此,阻断RNA自身碱基配对可能是治疗神经疾病的新靶点。
细胞内生物分子的相变,是一种新的细胞器组织形式,会使得我们对许多生命过程提出全新的看法。文章发展了之前发现的“相分离”概念,即RNA和蛋白质可以浓缩成动态的无膜细胞器【4】 ,并证明RNA可以在没有蛋白质的情况下发生相变,但并没有建立它与疾病的直接联系。重复序列RNA与核小斑募集相关蛋白之间的因果关系也并不明确。那么,重复序列RNA是否是疾病起因?这种作用的下游反应机制如何?文章留给了我们许多待解决的问题。

值得一提的是,Nature同日在线发表来自普林斯顿大学的David W. Sanders与Clifford P. Brangwynne的文章评论【5】(上图) 。评论中提到,由于实验并没有观察到RNA团簇细胞的功能异常,并且实验条件下重复序列RNA的浓度比普通患者神经细胞中的浓度高,本文所揭示的原理对于神经退行性疾病的适用性还有待商榷。另外,对模式生物的研究表明,编码区的RNA重复序列翻译会产生一种被称为“二肽重复”的蛋白质,很可能这种重复序列蛋白而非RNA是导致疾病的主要因素。
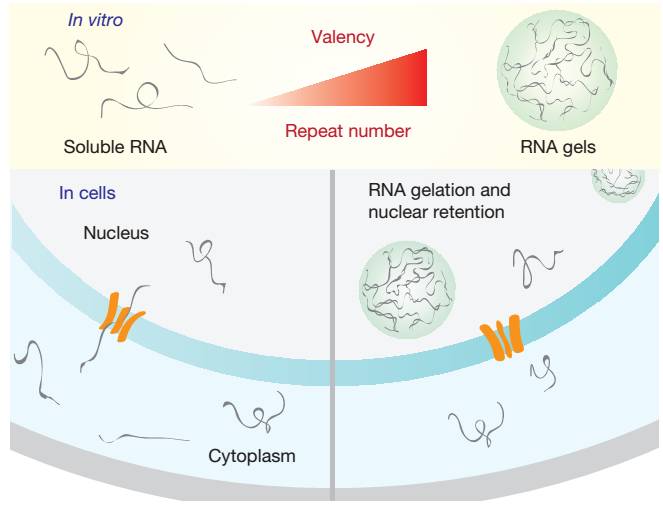
RNA重复序列凝集导致神经疾病的工作模型示意图
参考文献:
1、Wojciechowska M, Krzyzosiak WJ.(2011).” Cellular toxicity of expanded RNA repeats: focus on RNA foci.” Hum Mol Genet. 20(19):3811-21.
2、Ankur Jain, Ronald D. Vale.(2017).” RNA phase transitions in repeat expansion disorders.” Nature. 546, 243–247
3、Li, L.-B., Yu, Z., Teng, X. & Bonini, N. M. (2008).” RNA toxicity is a component of ataxin-3 degeneration in Drosophila.” Nature 453, 1107–1111
4、Salman F. Banani,Hyun O. Lee,Anthony A. Hyman,Michael K. Rosen. (2017).” Biomolecular condensates: organizers of cellular biochemistry” Nature Reviews Molecular Cell Biology 18, 285–298
5、David W. Sanders ,Clifford P. Brangwynne.(2017).” Neurodegenerative disease: RNA repeats put a freeze on cells”Nature 546, 215–216


BioArt,一心关注生命科学,只为分享更多有种、有趣、有料的信息。关注请长按上方二维码。投稿、合作、转载授权事宜请联系微信ID:fullbellies或邮箱:[email protected]。














