编码黑色素瘤分化基因的抗原和肿瘤相关抗原的表达在
T细胞浸润和非浸润的肿瘤中
没有显著差别
该研究将转移性黑色素瘤病人按CD8
+
T细胞浸润的基因标志物的表达,分为T细胞浸润型(106例)和非浸润型两组(91例)。根据RNA-seq数据,发现编码黑色素瘤分化基因的抗原表达和肿瘤相关抗原的表达在两组中没有显著差别(如下图)。其中,SAGE基因在浸润组病人中表达相对较低,这可能跟T细胞对SAGE+细胞的选择压力有关。
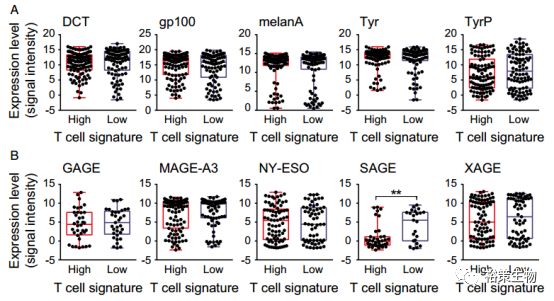
图1:T细胞浸润型和非浸润型两组病人中黑色素瘤分化基因的抗原和肿瘤相关抗原的表达
图A:编码黑色素瘤分化基因的抗原的表达(P值分别为: 0.53, 0.43, 0.25, 0.28, 和0.29)
图B:肿瘤相关抗原的表达(P值分别为: 0.75, 0.2, 0.92, 0.0011, 和0.59)
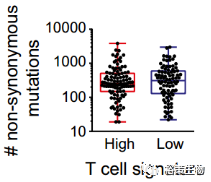
图2:两组中每个样本非同义突变数(453.9 ±55.9 vs. 481.5 ± 58.3, P = 0.73)
预测的新生抗原对HLA的亲和力,
在T细胞浸润和非浸润的肿瘤中
没有显著差异
为了预测HLA对新生抗原的亲和力,研究者特意挑选了HLA-A*0201阳性病人,原因是HLA的亲和力最依赖于这种亚型,而且这种亚型是黑色素瘤人群中最常见的。下图B展示了每个突变肽段的绝对亲和得分vs. 突变肽段相对野生肽段的差异亲和得分,可见,总的来说,T细胞浸润型和非浸润型两组没有差异。下图C展示的是结合HLA-A*0201的肽段在两组中的亲和力;下图D展示的是结合HLA-A*0201的肽段中筛选出高亲和力的肽段(HLA亲和得分≥25)在两组中的亲和力。两组亲和力都没有差异。
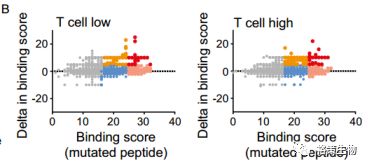
图3.预测的新抗原对HLA的亲和力
颜色代表不同的亲和力:灰色,亲和力得分≤ 17;蓝色,亲和力得分17-25,差异亲和力得分≤5;橘色,亲和力得分17-25,差异亲和力得分>5;桃色,亲和力得分≥25,差异亲和力得分≤5;红色,亲和力得分≥25,差异亲和力得分>5。
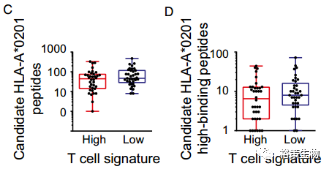
图4.
图C:结合HLA-A*0201的肽段在两组中的亲和力
图D:结合HLA-A*0201的肽段中筛选出高亲和力的肽段(HLA亲和得分≥25)在两组中的亲和力
体外合成的肽段对HLA的亲和力,
在T细胞浸润和非浸润的肿瘤中
没有显著差别
预测的肽段对HLA亲和力毕竟不能反映真实情况,为此,研究者体外合成了707个候选的肽段,其中,313个肽段来自浸润组,394个来自非浸润组。下图A显示大多数候选肽段对HLA有亲和力,浸润组和非浸润组两组分别为60.1%和63.7%。为了检测新生抗原的免疫原性,从两组中挑选了20个肽段,评估对诱导T细胞应答的能力,结果表明,两组对HLA的亲和力差不多(图B),其中25%的肽段都可检测到CD8
+
T细胞,浸润组5个,非浸润组6个,两组在T细胞应答程度上没有显著差别(图C)。
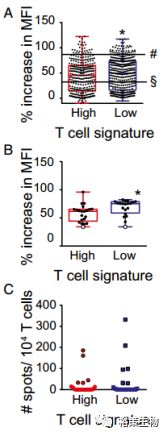
图5.
图A:合成的707个肽段对HLA的亲和力检测
图B:20个肽段对HLA的亲和力检测
图C:20个肽段诱导T细胞应答的检测
文章的最后,研究者用TCGA的30种实体瘤的数据研究了T细胞浸润情况,及其同突变负荷的相关性。同样,根据T细胞浸润的基因标志物的表达情况将每组癌分成高浸润、中等浸润和低浸润三组(图A)。结果发现,肾癌和肺腺癌的T细胞浸润程度最高。嗜络细胞瘤和神经胶质瘤的T细胞浸润程度最低。而外显子数据表明,T细胞浸润程度和非同义突变没有相关性。
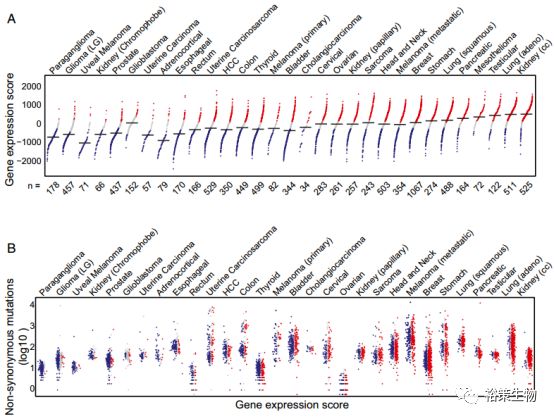
图6.
图A:浸润型(红色)、中等浸润型(灰色)和非浸润型(蓝色)在不同肿瘤中的分布。每个点代表一个样本,黑色的水平线是加权的基因表达得分的中位值。水平轴是每个癌种的样本数。
图B:图A对应的每种癌症的体细胞突变。垂直轴是非同义突变数取以10为底的对数。
临床研究发现,对于转移性黑色素瘤,如果肿瘤微环境为非浸润的状态,则新生抗原不能被T细胞识别,导致不能从免疫治疗中获益。
该研究揭示了新
生
抗原在丰度,对HLA的亲和力,及免疫原性等方面在浸润型肿瘤微环境和非浸润型两组中没有差别,表明没有免疫细胞的浸润
可能
不是因为缺少新生抗原,提示在非浸润型肿瘤微环境中引入T细胞的浸润有可能改善免疫治疗的临床获益情况。















