作者:Yasvanth Ashokraj*, Atul Daroi, Raja Gupta, Aruna Khanolkar, Amol Kulkarni, Swati Laud, Milind Pokale, Sanjeet Shedge, and Praveen Date
印度,孟买,CIPLA公司
摘要
在QbD时,在质量控制或产品质量评估时使用区分力的溶出方法对于旨在上市的产品是强制的。本文系统的开发了依托考昔片具有区分力的溶出方法。依托考昔具有高度的pH依赖性,BCS 2类。同时,优化了pH介质、速度和方法,并验证了方法的变异、重现性和耐用性,适当证明了所开发方法的区分力。
关键词:依托考昔;溶出;区分力;BCS 2
引言
固体制剂口服后在肠道的吸收包括以下几个步骤:(1)药物释放(2)溶出、溶解或者同时(3)药物在吸收部位渗透。因为前2个步骤对药物的生物利用度非常关键,开发合适的体外溶出方法在预测体内行为时非常重要
【1】
。
通常,溶出在以下几个方面很有用:(1)评价API的理化性质,如粒径、晶型(2)指导新处方的开发(3)辅助筛选处方(筛选辅料)和优化工艺(4)评价批间一致性(5)不同产地批次的比较(6)比较仿制药与原研或已上市品种(7)评价制剂稳定性,确定货架期(8)评价放大和上市后变更,比如生产变更、扩大或降低批量和辅料用量变更(9)提供一个基本的IVIVC(预测体内制剂行为)(10)生物等效性豁免
【2】
。
特别地,溶出实验可预测不溶性或难溶性药物的体内行为,即BCS2类。此外,在药物体内行为受到影响之前,具有适当区分力的溶解方法可以表示产品质量的任何可能的改变。溶解方法的区分力是检测药品质量变化的能力,通常通过确定制剂或方法中刻意改变对溶出特性的影响来证明。
系统开发具有区分力的溶出方法要比完全成熟的产品开发早得多。这使得配方设计师采用正确的方法来确定处方和工艺,并进一步放大。此外,世界各地的主要监管机构都期望在商业批次的常规质量控制中使用具有区分力溶出方法
【3,4】。
依托考昔是口服的、选择性的环氧合酶-2抑制剂
【5】
。广泛用于抗炎,规格
质(低pH)溶解度高,溶解度随着pH增加而降低。胆汁盐和卵磷脂在生物相关介质中的存在似乎不影响其溶解度
【6】
。没有文献报道依托昔布片的质量控制用或区分力的溶出方法。因此,本文的目的是开发和验证依托考昔片具有区分力的溶出方法。
材料和方法
所有用于HPLC的溶剂均为HPLC级,其它试剂均为分析级,并按收到的原样使用。以下试剂用于制备缓冲液和HPLC流动相:高氯酸钠一水合物(Merck,India),乙腈(Fisher Scientific,India),甲醇(Fisher Scientific,India),乙酸钠三水合物(Qualigens,India / Merck,India),冰醋酸(Fisher Scientific,India),邻苯二甲酸钾(Merck,India),盐酸(sd Fine chemicals,India),磷酸二氢钾(sd Fine chemicals,India),氢氧化钠丸粒(Merck,India)和氯化钾(Merck,India)。
制剂制备
通过两部制备依托考昔的膜包衣片,使用以下辅料:无水磷酸氢钙,交联羧甲基纤维素钠,硬脂酸镁,微晶纤维素和Opadry。
pH平衡溶解度实验
通过摇瓶法测定在各种pH下的平衡溶解度。将依托考昔加入到25mL相应的USP缓冲溶液(pH 1.2,3.0,4.5,5.5和6.8)中,直到获得非均相系统(固体和液体)。将样品超声处理10分钟,确保样品中溶解过量固体,之后置于37℃的振荡器中。搅拌24小时以达到平衡,取2mL过0.45μmPVDF过滤器过滤,并采用已验证的HPLC方法测定依托考昔的浓度。
溶出度研究
除非另有说明,所有溶出度实验采用USP第二法,37℃、900mL介质,六片。在5、10、15、20、30、45和60分钟取样。此外,在一些曲线中也在90分钟和无穷大(200rpm,10分钟)的时间点取样。样品通过0.45-μmPVDF过滤器过滤,采用已验证的HPLC方法测定依托考昔的含量。
样品检测
使用配备2487UV-vis检测器(Waters Corp.,Milford,MA,USA)的Waters
2695分离模块进行样品分析。经验证的反相HPLC方法使用保持在25℃的
Hypersil BDS C-18色谱柱柱(10cm×4.6mm,3μm),流动相为10mM高氯酸钠一水合物/乙腈(55:45),流速为1.5mL / min,235nm检测。
结果与讨论
主要监管机构
【3,4,7】
期望将具有区分力的溶出方法用于药品,特别是口服固体剂型的质量控制。Fish等人的报告
【8】
概述了一种全面的溶出方法开发策略,开发了达沙替尼薄膜包衣片具有区分力的溶出方法。任何具有区分力溶出方法的开发需要以下步骤:(1)设定目标溶出曲线(例如,在15分钟内<50%,在30分钟内> 85%);(2)设计开发策略的实验流程图,具有预期结果和前进方向;(3)系统地优化和最终确定溶解介质、速度、装置和体积;(4)证明溶出方法的区分力;(5)证明溶出方法的可重复性和耐用性,满足变异要求(即,在第一取样点<20%RSD和在其他取样点<10%RSD)。此外,期望满足漏槽条件,其中当可溶解在溶解介质中的量是待溶解药物的量的三倍时,满足漏槽条件。然而,如果证明溶解方法的区分力令人满意,则偏离漏槽条件是可接受的
【7】
。
API的物化性质是任何溶出方法开发的关键起点。特别是关于均衡溶解度为快速选择合适的溶出介质提供了方向。依托考昔平衡溶解度研究的结果表明,其溶解度是高度pH依赖性的,这与早期报道
【6】
一致。在1.2-3.0的pH溶解度有显着差异(即在pH 1.2下为22.52mg / mL,pH 3.0下为1.44mg / mL)。溶解度在pH3.0以上恒定(0.12mg / mL)。
根据USP
【7】
,溶出曲线应当有足够多的时间点以充分表征上升期和平台期。这是选择依托考昔片溶出条件的首要标准。我们的目标是:10分钟药物释放<50%;30分钟药物释放> 80%,每个采样点符合RSD要求。从平衡溶解度数据可知,依托考昔的溶解主要由介质的pH值决定。采用方法2、50转,测定pH值对依托考昔片溶出的影响,如图1所示。这说明在pH值为1.2,4.5和6.8,覆盖了高、中、低溶解度的地区。从饱和溶解度的研究结果预期,在低pH条件下观察到快速崩解,而在较高的pH值是缓慢的、不完全的溶解。然而,在pH为4.5时,溶出曲线清晰的显示了上升期和平台期。
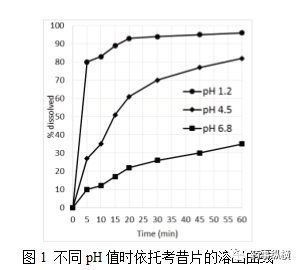
表面活性剂通常用于提高溶解速率和程度。在pH 6.8的观察到不完全溶解,看来增溶剂(即表面活性剂)可实现在pH 6.8中的完全溶解。然而,Okumu等人
【6】
证明,通过测定空白的FaSSIF)、(FeSSIF)和FeSSIF/FaSSIF的溶解度,添加表面活性剂并不能提高依托考昔的溶解度。因此,选择pH值4.5没有表面活性剂,并进一步评估其重现性和区分力。令人惊讶的是,每次检测的pH 4.5介质溶出曲线发现有着显著差异,这是不可接受的(数据未显示)。因此,接下来的工作是探索在pH值和转速的变化,如表1中,以达到二者的平衡,将得到一个合适的溶出方法。
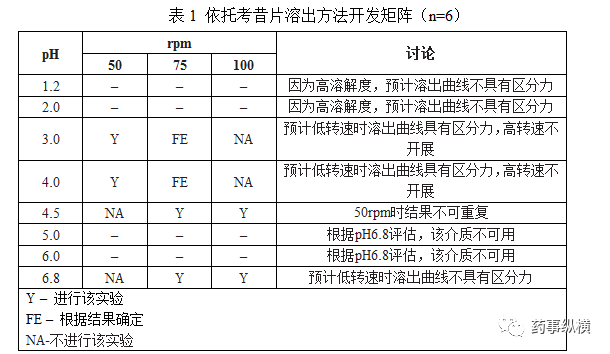
如图2所示,结合不同pH值和转速,评估了依托考昔片溶出曲线。pH值为3.0,4.0,和6.8,转速50,或100 rpm,在10或30分钟,药物溶解不符合
预先设定的标准。此处不完全溶解是由于缓慢的溶解速率,pH6.8不满足漏槽条件,或在pH值为3.0和4.0中的低转速无发打破扩散层以快速混合溶解的药物
【9】
。在pH4.5、100rpm的溶解曲线在达到设定的目标,而在75rpm时仍然缓慢(30分钟内,< 80%)。为了确定溶出装置的影响,在给定的pH值,速度,和体积,在pH 4.5在方法1检测了溶出曲线。结果(图3)显示方法1不合适。这是由于物质粘在篮子里面导致不均匀的崩解,并使颗粒沉降在溶出杯底部。因此,最终确定的溶出条件(图4)是pH值4.5醋酸缓冲液,900mL,方法2。但是介质体积对溶出的影响没有评估。
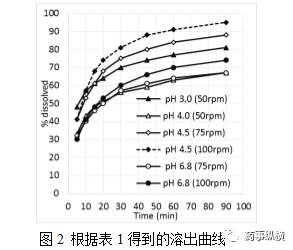
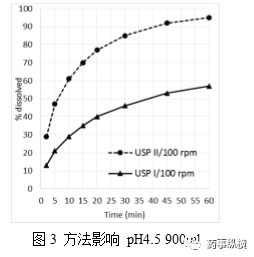
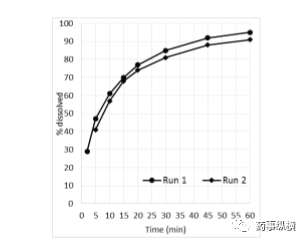
图4 同一批依托考昔片溶出曲线重现性pH4.5、900ml、100rpm、方法2
能够区分在处方和制造过程中的显著变化的溶出曲线认为有区分力。用于溶出方法开发的依托考昔片采用工艺1生产,使用上述辅料。因此,两种制剂是显著不同,一个增加了磷酸氢钙无水的用量,另一个采用工艺2制造。选择二者来证明溶出方法的区分力。结果如图5所示。正如预期,与标准制相比,增加无水磷酸氢钙导致溶出率明显下降(f2为35.23)。归因于无水磷酸氢钙的不溶性
【10】
。另一方面,在制造过程中的变化未显著影响溶出率(f2为61.61),仅观察到稍慢的溶出曲线。这证明了溶出方法的区分力。

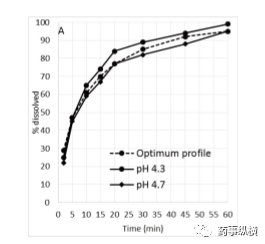
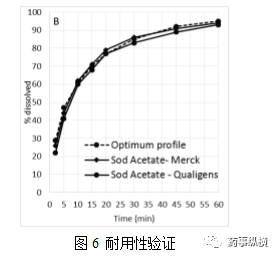
验证了该方法的耐用性。相应的改变了介质的pH和试剂的级别。pH介质调整了±0.2,醋酸钠来源改变来研究对溶出曲线的影响,结果见图6A、B,几乎与标准重合。因此,所选择的溶出方法强大到足以承受轻微的变化,在实验室条件下,可以提供可重复的溶出曲线。
结论
本文展示了在开发具有pH依赖性、BCS 2类药物的具有区分力的溶出方法的系统的、连续的实验设计。具有耐用性和区分力的依托考昔片的溶出方法是pH4.5的醋酸盐缓冲液、900ml、方法2、100 rpm,可以方便地用于产品的质量控制。类似的研究工作有利于行业和政府组织评价制药产品。
参考文献
1. Dressman, J. B.; Amidon, G. L.; Reppas, C.; Shah, V. P. Dissolution Testing as a Prognostic Tool for Oral Drug Absorption: Immediate Release Dosage Forms. Pharm. Res. 1998, 15 (1), 11–22. DOI: 10.1023/A:1011984216775.
2. Raju, V.; Murthy, K. V. R. Development and validation of new discriminative dissolution method for carvedilol tablets. Indian J. Pharm. Sci. 2011, 73 (5), 527–536. DOI: 10.4103/0250-474X.99000.
3. Anand, O.; Yu, L. X.; Conner, D. P.; Davit, B. M. Dissolution Testing for Generic Drugs: An FDA Perspective. AAPS J. 2011, 13 (3), 328–335. DOI:
10.1208/s12248-011-9272-y.
4. Darling, D. Regulatory Expectations of Presentation of Dissolution Data. Presented at the 3rd APS International PharmSci Conference, Nottingham, UK, Sept 12–14, 2012. http://www.ukpharmsci. org/2012resourcepack/PDFPresentations/TA_1035_David_Darling.pdf (accessed Feb 1, 2016).
5. Arcoxia film-coated tablets. electronic Medicines Compendium (eMC) Web site. http://www. medicines.org.uk/emc/medicine/29136 (accessed Feb 1, 2016).
6. Okumu, A.; DiMaso, M.; Löbenberg, R. Computer simulations using GastroPlus™ to justify a biowaiver for etoricoxib solid oral drug products. Eur. J. Pharm. Biopharm. 2009, 72 (1), 91–98. DOI: 10.1016/j. ejpb.2008.10.019.
7. <1092> The Dissolution Procedure: Development and Validation. In The United States Pharmacopeia and National Formulary USP 36–NF 31; The United States Pharmacopeial Convention, Inc.: Rockville, MD, 2013.
8. Fish, W. P.; Young, J.; Shah, P.; Gao, Z. The Use of Experimental Design Principles in Dissolution Method Development: Development of a Discriminating Dissolution Method for Sprycel Film-Coated Tablets. J. Pharm. Innovation 2009, 4 (4), 165–173. DOI: 10.1007/s12247-009-9071-5.
9. Wu, Y.; Kildsig, D. O.; Ghaly, E. S. Effect of Hydrodynamic Environment on Tablets Dissolution Rate. Pharm. Dev. Technol. 2004, 9 (1), 25–37. DOI: 10.1081/PDT- 120027415.
10. Calcium Phosphate, Dibasic Anhydrous. In Handbook of Pharmaceutical Excipients, 6th ed.; Rowe, R. C, Sheskey, P. J., Quinn, M. E., Eds.; Pharmaceutical Press: London, 2009; pp 94–96.
本文来自药事纵横,仅为学习与交流,如有版权问题请联系小编删除。






