▎药明
康德/报道
1.有望今年上市,Kite首款CAR-T疗法获FDA优先审评资格
Kite Pharma宣布,美国FDA为其首款CAR-T疗法axicabtagene ciloleucel的生物制剂许可申请颁发了优先审评资格(Priority Review)
,并计划于今年11月29日做出批复。这项优先审评资格,也标志着有望治疗难治性侵袭性非霍奇金淋巴瘤的首款CAR-T疗法离患者又近了一步。

▲
CAR-T细胞疗法axicabtagene ciloleucel的2期临床试验ZUMA-1(图片来源:Kite Pharma官网)
2. 划时代!FDA加速批准首款不区分肿瘤来源的抗癌疗法
近期,美国FDA传来一条重量级消息——由默沙东(MSD)带来的Keytruda(pembrolizumab)获批治疗带有微卫星不稳定性高(microsatellite instability-high,MSI-H)或错配修复缺陷(mismatch repair deficient,dMMR)的实体瘤患
者
,他们的病情在先前的治疗后都出现了进展。
值得一提的是,这是美国FDA批准的首款不依照肿瘤来源,而是依照生物标志物进行区分的抗肿瘤疗法,具有里程碑式的意义。
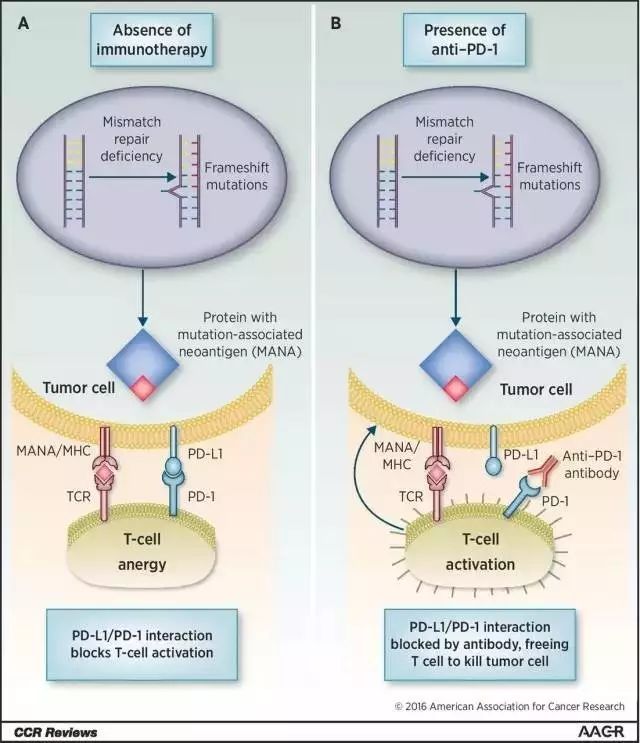
▲
肿瘤免疫疗法对带有特定遗传变异的肿瘤有着很好的疗效(图片来源:《Clinical Cancer Research》)
3. 治疗胃癌,重磅免疫疗法药物获优先审评资格
默沙东(MSD)公司宣布,美国FDA已经接受审查其补充生物制剂许可申请(sBLA),使用抗PD-1疗法
Keytruda
(pembrolizumab)治疗已经接受两种或更多种化疗方案的复发或晚期胃癌(gastric cancer)或胃食管连接腺癌(gastroesophageal junction adenocarcinoma)患者。
FDA通过PDUFA机制授予默沙东优先审评资格(Priority Review),目标行动日期为2017年9月22日。

▲
此项
申请所基于的2期临床试验KEYNOTE-059的设计方案(图片来源:Medscape)
4. 早期肺癌免疫治疗新靶点
美国西奈山医学院(Mount Sinai School of Medicine)的研究人员对早期肺癌肿瘤的免疫微环境进行了详细研究。
他们发现让肿瘤免疫疗法得以成功的免疫因素在早期肺癌的微环境中已经存在,这意味着免疫疗法很有希望在早期肺癌患者身上同样取得成功。这项研究发表在《细胞》杂志上。西奈山医学院的研究人员从早期肺癌患者身上获取了切除的肿瘤组织、正常肺部组织和血样。他们设计出一种条形码系统可以对这三种不同样本中的所有细胞用金属同位素贴上标签。然后运用飞行时间质谱技术(mass cytometery by time-of-flight)与单个细胞转录组学(single cell transcriptomics)和对肺部肿瘤的多重成像技术相结合,对肺部肿瘤的免疫状况在单个细胞的水平上进行详细分析。
5. 中澳科学家联手,检测肿瘤早期血管异常增生
近期,澳大利亚联邦科学与工业研究组织(Commonwealth Scientific and Industrial Research Organization,CSIRO)的Data61机构开发出一款全新算法,能够对血管生成进行早期检测,而异常血管生成是肿瘤发生的早期标志。与中科院上海应用物理研究所(Shanghai Institute of Applied Physics, Chinese Academy of Sciences)的研究人员合作,该机构的研究人员对处于癌症不同时期的小鼠脑部和肝脏组织的高清3D微焦点CT成像进行分析后,得出能够对异常生长的血管的分支形态和末梢的长度有精确评估的算法。这款全新的软件能够对血管微小的异常变化进行识别,不仅可用于肿瘤早期阶段的检测,同时,也可以评估患者对于抗血管异常生成的疗法的相应情况。
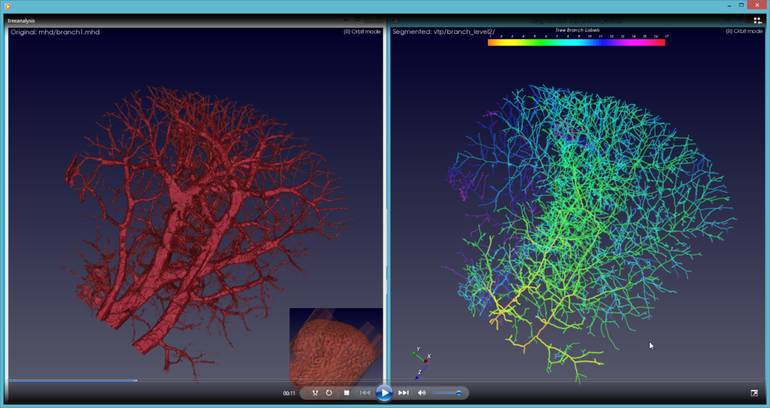
▲
此项技术观察到血管精度大有提高(图片来源:CSIRO官网)
6. 液体活检是监测肺癌的利器
近期,《自然》杂志发表的一项癌症研究显示,通过分析血液中的特定遗传标记,可以对肺癌的演变进行监测
。研究表明,在血液样本中发现的循环肿瘤DNA(ctDNA)与组织亚型和病情复发等相关。这意味着,液体活检可提供一种非侵入式方法来分析肺癌患者,这有助于改进治疗方法,限制肿瘤复发。此项名为“TRACERx肺癌临床试验(Tracking Non-Small-Cell Lung Cancer Evolution Through Therapy,TRACERx)”的研究监测了100位转移性非小细胞肺癌患者从确诊到复发和死亡的疾病演变过程。
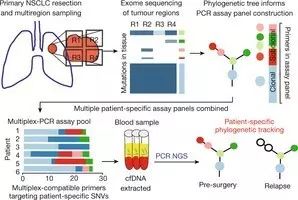
▲
此项目设计的实验步骤(图片来源:《自然》)
7. 诺华Zykadia获批一线治疗ALK阳性非小细胞肺癌
诺华(Novartis)公司宣布,美国FDA批准扩大使用Zykadia(ceritinib)一线治疗转移性非小细胞肺癌(NSCLC)患者,这些病人通过FDA批准的检测方法确认为间变性淋巴瘤激酶(ALK)阳性。
Zykadia于2014年首次获得加速批准,用于治疗ALK阳性转移性NSCLC,他们疾病进展或对crizotinib不耐受。2017年1月,FDA为Zykadia颁发了突破性疗法认定(Breakthrough Therapy Designation),用于一线治疗ALK阳性的脑部转移性NSCLC患者,并同时向ALK阳性转移性NSCLC一线治疗颁发了优先审评(Priority Review)资格。大约3-7%的NSCLC患者具有
ALK
基因重排,在诊断时FDA批准的检测手段可能有助于确定这种突变的存在,从而有助于确定最适合的治疗方案。

8. 合作:湾区GRAIL公司与香港Cirina合作,助力癌症诊断技术开
发
近期,位于湾区的癌症早期诊断公司GRAIL携手分子诊断学公司Cirina,共同致力于开发能够对癌症进行早期诊断的分子学工具。
Cirina是由分子生物学临床应用专家卢煜明教授与其数名同事联合创办的,该公司在香港和南旧金山多地设有研发基地。卢教授成功证明孕妇外周血中存在游离的胎儿DNA,发展出了一套可以准确分析和度量母亲血浆内胎儿DNA的新技术。
同时,他和同事将该理论也成功证明了肿瘤DNA也可在血液中存在。
在此项合作中,卢教授除了是联合创始人外,还将担任科研顾问。此项合作框架下,GRAIL将在亚洲等开发和商业化其肿瘤相关的分子诊断学产品,而Cirina将与香港中文大学进行科学研究合作。
9. 合作:Array BioPharma与Ono Pharmaceutical合作,预期造福结直肠癌患者
近期,致力于抗癌小分子药物开发公司Array BioPharma宣布与日本药企Ono Pharmaceutical就Array处于中后期开发的抗癌化合物binimetinib和encorafenib,进行授权、开发和市场推广等合作
。Binimetinib是一款分裂原活化(MEK)抑制剂,而encorafenib是丝氨酸/苏氨酸蛋白激酶B-raf(BRAF)抑制剂。目前,上述两款抗癌小分子药物正处于3期临床试验中,用于BRAF突变引起的肿瘤治疗。在该项协议下,Array将保留上述化合物在美、加和以色列多地的商业化权利。而Ono将有权在日本、韩国等地对上述化合物进行临床试验。Ono的首席执行官Gyo Sagara先生表示,很高兴与Array展开合作,由于上述两种化合物在此前临床试验中已显示出有效性,预计该两款化合物的联合用药将为BRAF突变型结直肠癌患者带去福音。

▲B
inimetinib与encorafenib联合用药的3期临床试验(图片来源:Array官网)
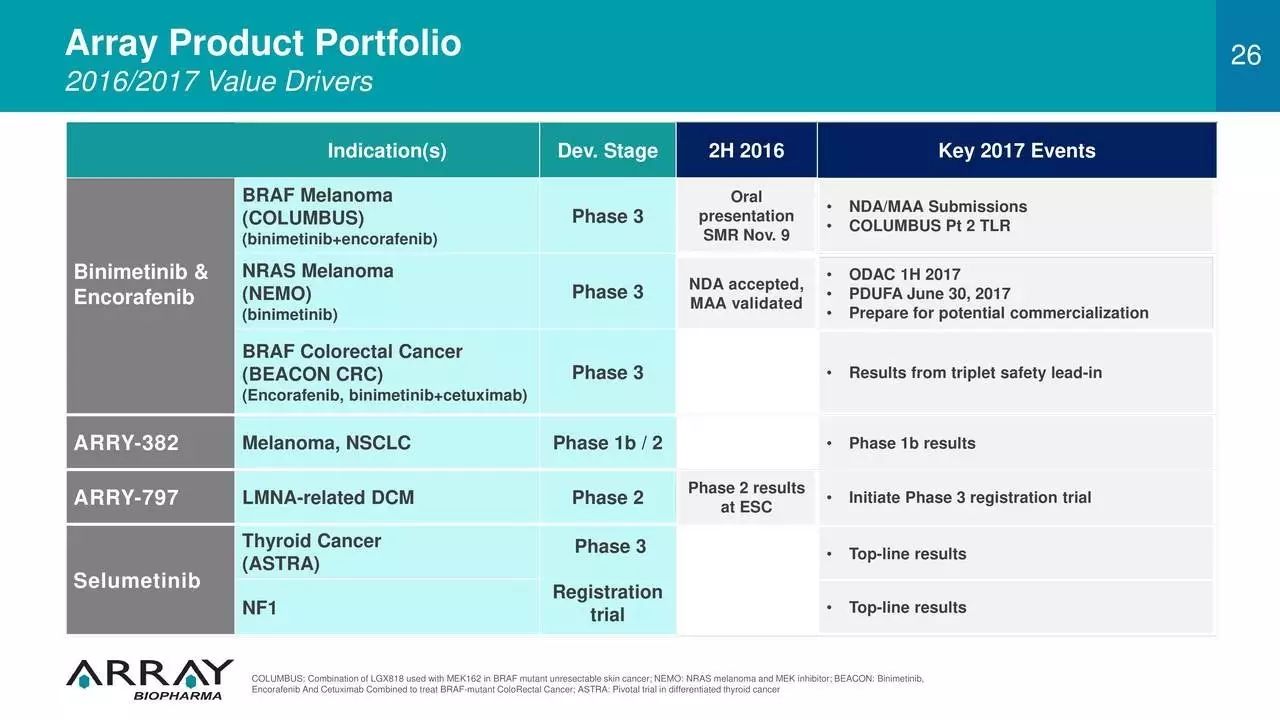
▲
Array旗下多款产品(图片来源:Array官网)
10. 膀胱癌:礼来抗癌药Cyramza在3期临床试验中达到主要临床终点
近期,礼来
(Eli Lilly)
宣布其旗下Cyramza(ramucirumab)在名为RANGE的3期临床试验表现良好,其无进展生存期相比安慰剂组显示出统计学意义上的差异。
此项全球进行、随机、双盲、安慰剂对照的3期临床试验评估ramucirumab与多西他赛(docetaxel)联合用药,对于晚期、不可切除或恶变尿路上皮癌(urothelial carcinoma)患者的治疗效果。并且上述治疗人群在铂基化疗后仍有疾病进展。Ramucirumab是一款血管上皮细胞生长因子(vascular endothelial growth factor,VEGF)受体拮抗剂,也是首款在针对尿路上皮癌的3期临床试验中显示出延长患者无进展
生存期的抗肿瘤血管生成分子
。虽然,该项联合用药在临床试验中达到主要临床终点,但有关总生存期(overall survival,OS)方面的数据预计于2018年中旬获得。
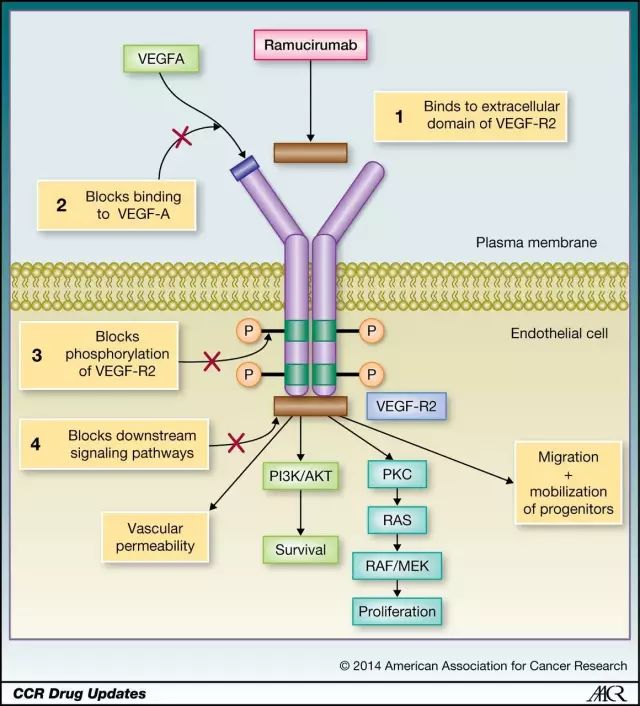
▲R
amucirumab的作用机理(图片来
源:American Association for Cancer Research)
11. 慢性淋巴细胞白血病:诺华CAR-T细胞疗法与ibrutinib联合用药,显示出较高响应率
近期,诺华宣布其抗CD19嵌合抗原受体修饰的T细胞疗法(CAR-T cell therapies)CTL119与靶向制剂ibrutinib的联合用药,在针对复发性或难治性慢性淋巴细胞白血病(chronic lymphocytic leukemia,CLL)的小型临床试验中,表现出良好治疗效果;并且上述患者在连续使用ibrutinib 6个月,仍未达到完全症状缓解。
在经治疗的3个月后,80%的入组患者显示出症状缓解,并未在其骨髓和其他造血组织中发现恶性细胞增殖现象。此次涉及的细胞疗法CTL119是诺华与宾夕法尼亚大学(University of Pennsylvania)共同合作开发而成。
参考资料:
[1] Kite Receives U.S. Food and Drug Administration Priority Review for Axicabtagene Ciloleucel
[3] FDA approves first cancer treatment for any solid tumor with a specific genetic feature
[4] FDA Grants Priority Review To Merck & Co. (MRK)’s Supplemental Biologics License Application (sBLA) For KEYTRUDA (Pembrolizumab) For Treatment Of Recurrent Or Advanced Gastric Or Gastroesophageal Junction Adenocarcinoma
[5] Cancer-catching algorithm being developed
[6] Phylogenetic ctDNA analysis depicts early-stage lung cancer evolution.
[7] Novartis AG (NVS) Receives FDA Approval For Expanded Use Of Zykadia In First-Line ALK-Positive Metastatic Non-Small Cell Lung Cancer (NSCLC)
[8] BayArea's GRAIL Goes Global, Merges With Hong Kong's Cirina to Focus on CancerDetection
[9] Array BioPharma
(
ARRY
) And
Ono Pharma
(
OPHLY
)Announce A License, Development And Commercialization Partnership For Two NovelOncology Compounds, Binimetinib And Encorafenib
[10] Eli Lilly
(
LLY
)'s Cyramza Hits Goals in Phase III BladderCancer Study But Will Need to Wait for Overall Survival Data Due Mid-2018
[11] Novartis next generation CAR-T cell therapy CTL119 combined withibrutinib shows high rate of responses in CLL patients







