来源:CFDA
2017年05月11日,总局发布关于11批次药品不合格的通告(2017年第74号),经大连市药品检验所等
6家药品检验机构检验
,标示为赤峰维康生化制药有限公司等
7家企业生产的11批次药品不合格
。现将相关情况通告如下:
一、不合格产品的标示生产企业、药品品名和生产批号为
:
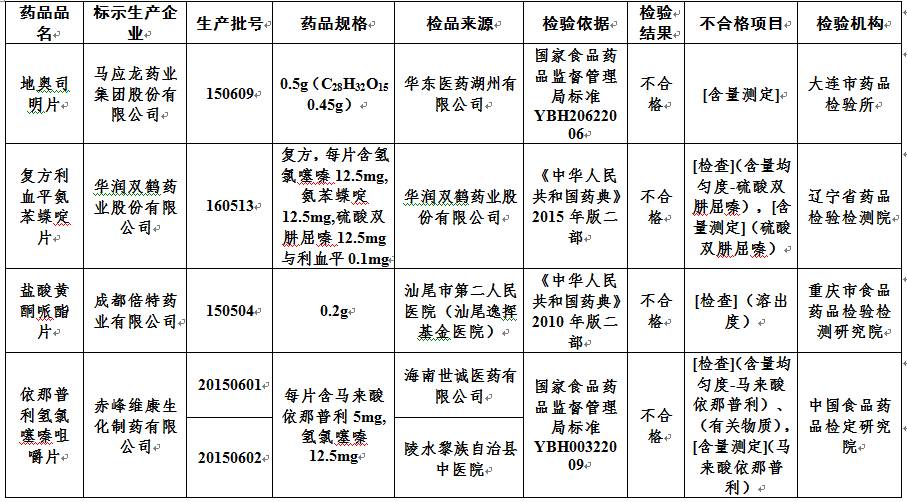
马应龙药业集团股份有限公司生产的批号为150609的地奥司明片;
华润双鹤药业股份有限公司生产的批号为160513的复方利血平氨苯蝶啶片;
成都倍特药业有限公司生产的批号为150504的盐酸黄酮哌酯片;
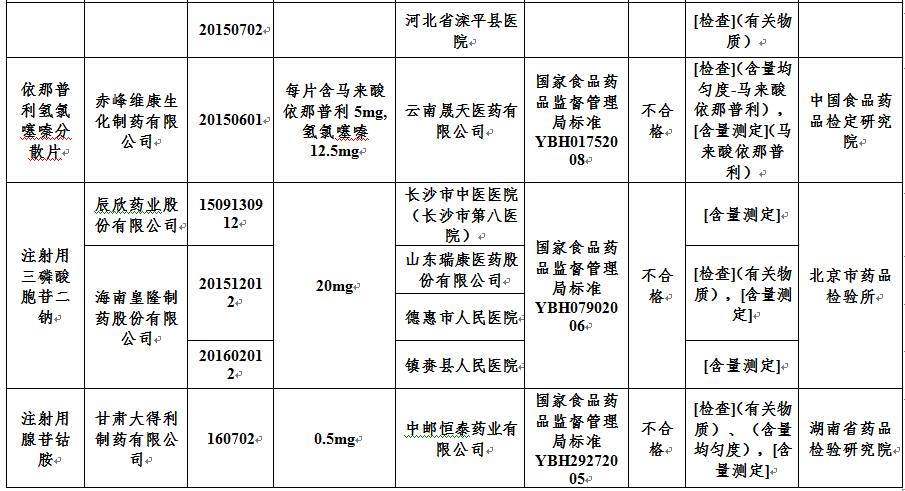
赤峰维康生化制药有限公司生产的批号为20150601、20150602、20150702的依那普利氢氯噻嗪咀嚼片和批号为20150601的依那普利氢氯噻嗪分散片;
辰欣药业股份有限公司生产的批号为1509130912的注射用三磷酸胞苷二钠;
海南皇隆制药股份有限公司生产的批号为201512012和201602012的注射用三磷酸胞苷二钠;
甘肃大得利制药有限公司生产的批号为160702的注射用腺苷钴胺。
不合格项目包括
含量测定、溶出度、含量均匀度、有关物质等
(详见附件)。
二、对上述不合格药品,相关省(区、市)食品药品监督管理局已采取查封扣押等控制措施,要求
企业暂停销售使用、召回产品,并进行整改。
三、国家食品药品监督管理总局要求生产企业所在地省(区、市)食品药品监督管理局对上述企业依据《中华人民共和国药品管理法》第七十三、七十四、七十五条等规定,对生产销售不合格药品的违法行为进行立案调查,
三个月内公开对生产销售不合格药品相关企业或单位的处理结果,相关情况及时报告总局。
11批次不合格药品名单
|
药品
品名
|
标示生
产企业
|
生产
批号
|
药品
规格
|
不合格
项目
|
|
|
地奥司明片
|
马应龙药业集团股份有限公司
|
150609
|
0.5g
(
C
28
H
32
O
15
0.45g
)
|
[
含量测定
]
|
|
|
复方利血平氨苯蝶啶片
|
华润双鹤药业股份有限公司
|
160513
|
复方,每片含氢氯噻嗪
12.5mg,
氨苯蝶啶
12.5mg,
硫酸双肼屈嗪
12.5mg
与利血平
0.1mg
|
[
检查
]
(含量均匀度
-
硫酸双肼屈嗪),
[
含量测定
]
(硫酸双肼屈嗪)
|
|
|
盐酸黄酮哌酯片
|
成都倍特药业有限公司
|
150504
|
0.2g
|
[
检查
]
(溶出度)
|
|
|
依那普利氢氯噻嗪咀嚼片
|
赤峰维康生化制药有限公司
|
20150601
|
每片含马来酸依那普利
5mg,
氢氯噻嗪
12.5mg
|
[
检查
]
(含量均匀度
-
马来酸依那普利)、(有关物质),
[
含量测定
]
(马来酸依那普利)
|
|
|
20150602
|
|
|
20150702
|
[
检查
]
(有关物质)
|
|
|
依那普利氢氯噻嗪分散片
|
赤峰维康生化制药有限公司
|
20150601
|
每片含马来酸依那普利
5mg,
氢氯噻嗪
12.5mg
|
[
检查
]
(含量均匀度
-
马来酸依那普利),
[
含量测定
]
(马来酸依那普利)
|
|
|
注射用三磷酸胞苷二钠
|
辰欣药业股份有限公司
|
1509130912
|
20mg
|
[
含量测定
]
|
|
|
海南皇隆制药股份有限公司
|
201512012
|
[
检查
]
(有关物质),
[
含量测定
]
|
|
|
|
201602012
|
[
含量测定
]
|
|
|
注射用腺苷钴胺
|
甘肃大得利制药有限公司
|
160702
|
0.5mg
|
[
检查
]
(有关物质)、(含量均匀度),
[
含量测定
]
|
|
11批次不合格药品名单详情