名词解释:
PIV:Pragraph IV;声明IV,与申请的仿制药相关的专利是无效的或者仿制药不侵权;
IPR:Inter Partes Review; 多方复审程序
MS:Multiple Sclerosis;多发性硬化症
发迹于以色列,经过百余年的发展成为全世界最大仿制药公司的TEVA, 活跃于各种产品PIV专利挑战中欢快地当着被告,2015年FDA记录的PIV挑战共有58个,其中TEVA占据了25个。当其品牌拳头产品Copaxone面临专利悬崖(Patent Cliff)时,TEVA依托其强大的诉讼和研发能力,一方面应对PIV声明进行专利侵权诉讼,尽量延缓仿制药进入市场的时间,另一方面推出了长效版的Copaxone,成功的将大部分服用Copaxone的患者留住,减缓了仿制药的冲击。
然而竞争对手Mylan利用美国专利的“暗影杀手”IPR,无效了TEVA关于长效版Copaxone在Orange Book所列未届满的4个专利,拉开了仿制药上市逐鹿的大幕。
IPR (Inter Partes Review,多方复审程序)背景
2011年9月,美国总统奥巴马签署了1952年以来美国最重大的专利法改革方案(Leahy-Smith America Invents Act,AIA)。在AIA之前,要在USPTO无效一个美国专利,有两个方式:单方再审(Ex Parte Reexamination)和多方再审(Inter Partes Reexamination)程序。而在AIA之后,新增了授权后复审(Post-Grant Review,PGR)和多方复审(IPR)程序。两者从2012年9月起生效,而原来的多方再审程序被取消,单方再审还依然保留。PGR程序应该在授权后或者再授权(re-issue)之后9个月内提出,而IPR需要在无法提出PGR之后提出。
PGR和IPR程序都由PTAB (Patent Trial and Appeal Board,专利审判及上诉委员会)的行政法官(administrative judges)来审查。IPR仅能基于美国专利法第102和103条(新颖性和创新性)为理由提出。对IPR书面结果不服的,可以向美国联邦巡回上诉法院(CAFC)提出上诉。
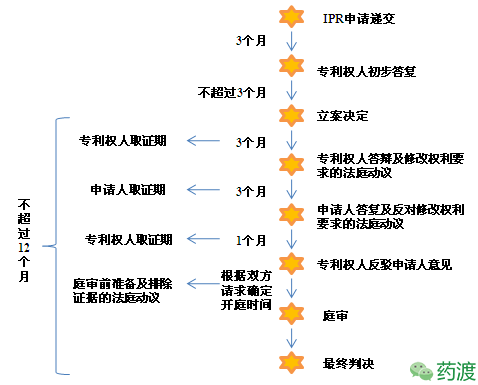
IPR流程图
英文名称:Glatiramer Acetate;COP-1;Copolymer-1;Copaxone
中文名称:醋酸格拉替雷;柯柏松;克帕松
Protein化学式:C254H422N70O72
平均分子量:7000.0 Da (range 5000-9000)
适应症: 多发性硬化症(multiple sclerosis,MS)
以色列Rehovot(雷霍沃特)威兹曼科学院(Weizmann Institute of Science)三位科学家Michaeal、Ruth和Dvora最先发现了醋酸格拉替雷(Copaxone)。Copaxone是一种人工合成的肽类制剂,由L-丙氨酸、L-赖氨酸、L-谷氨酸、L-酪氨酸四种氨基酸按一定比例(4.2:3.4:1.4:1)聚合而成的多肽混合物。这四种氨基酸在髓鞘碱性蛋白中常见,柯柏松在体内可以作为免疫系统的诱饵,从而减缓了自身免疫作用。通常多发性硬化病的临床诊断需要发现两个阶段的症状和征兆,但是FDA批准在第一阶段症状出现后就可以服用柯柏松了,成为唯一一种可在疾病早期服用的药物。
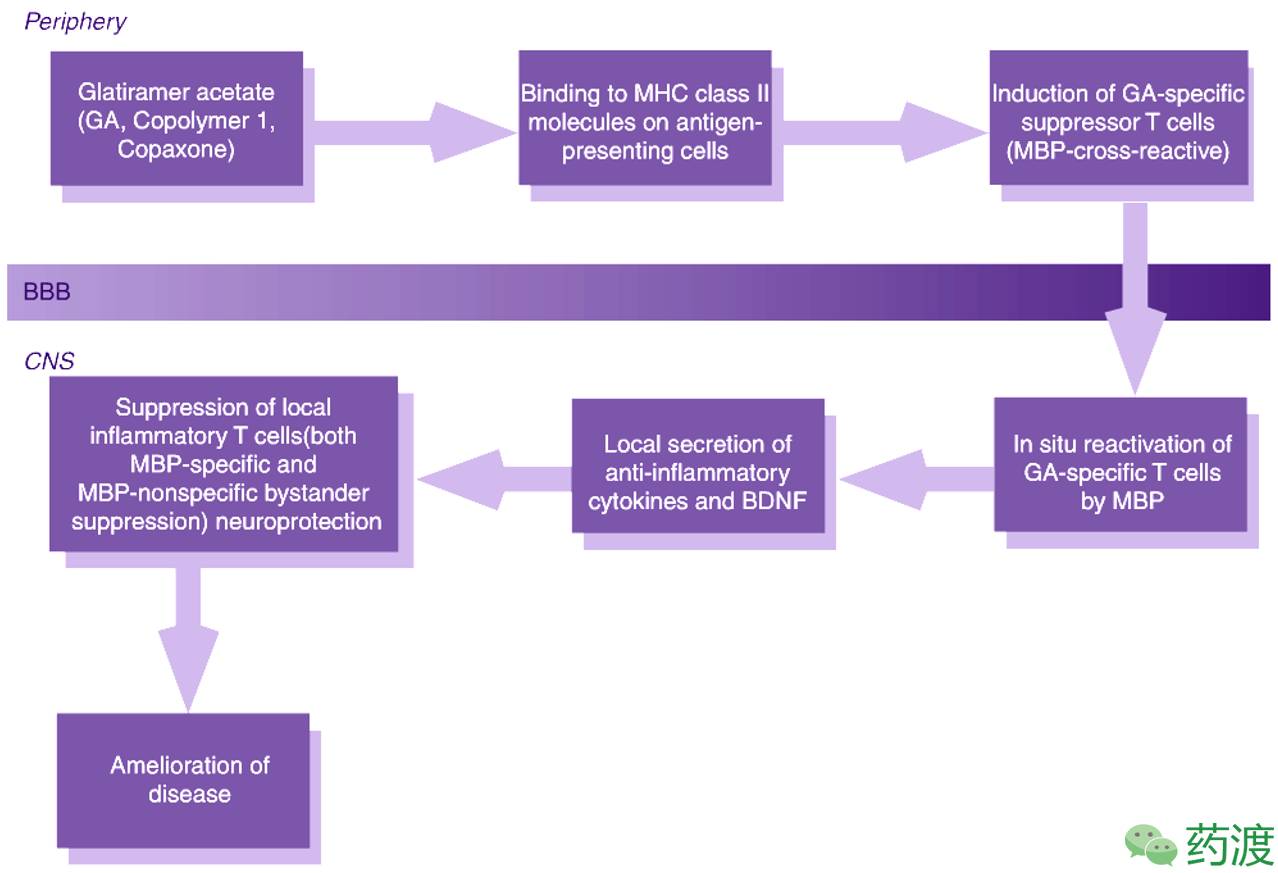
Mechanism of action of Copaxonein EAE and MS
(Ref. Comprehensive Medicinal ChemistryII )
多发性硬化症(MS)是一种慢性炎症性、脱髓鞘的中枢神经系统疾病,患者会出现各种不同的症状,包括视觉障碍、肌肉无力、忧郁、讲话困难、严重疲劳、认知障碍等表现,严重的患者可以导致活动性障碍和残疾。大多数患者症状首次发作的年龄在20~40岁之间。
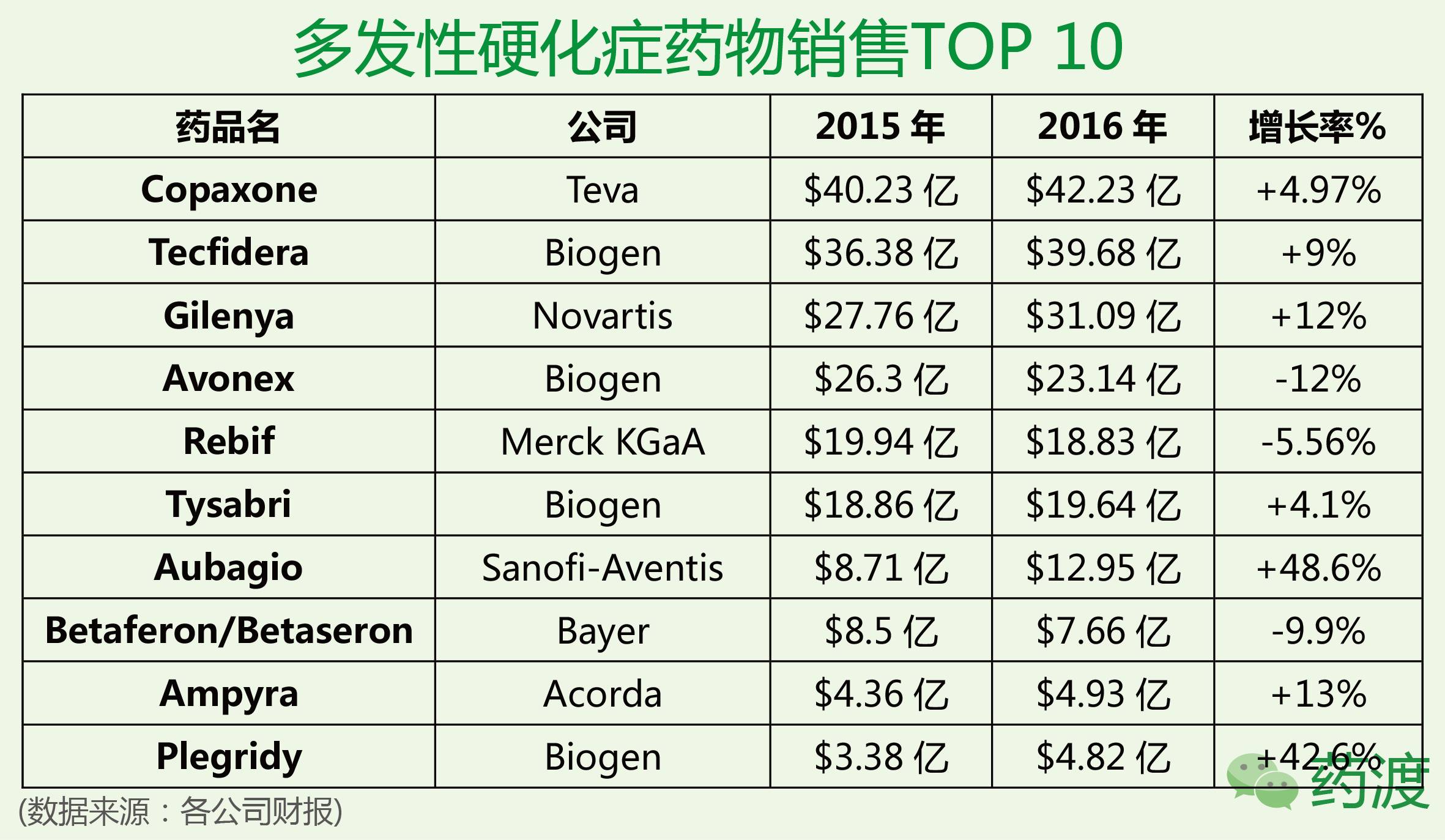
据前瞻产业研究院发布的全球TOP100数据和跨国药业财报数据显示,2016年全球七大医药市场畅销品种多发性硬化症类的销售额已达到226.80亿美元,同比上一年增长了2.68%。分析表明2006年全球多发性硬化症治疗市场仅为73.77亿美元,10年间增长了2.08倍。目前,全球用于治疗多发性硬化症的品牌药物有15个,分为化学小分子类药物、单抗隆抗体类和干扰素类3个系列。
1996.12.20,FDA批准TEVA剂量为20mg/Vial (NDA:020622)的Copaxone在美上市,该剂型已停止上市。
2002.2.12,FDA批准TEVA剂量为20mg/ml (NDA:020622)的Copaxone在美上市,每日注射一次。
2014.1.28,FDA批准TEVA的长效版Copaxone (NDA:020622;40mg/ml,每周注射3次),TEVA立即推向市场,并以惊人的速度成功将患者从Copaxone (20mg/ml)转向了长效版Copaxone,令业界惊叹不已。该产品因NP (new product)市场独占至2017.1.28。
2015.4.16,FDA批准首个Copaxone仿制药Glatopa (ANDA:090218),该药由诺华旗下Sandoz与Momenta合作开发并完全在美国生产。
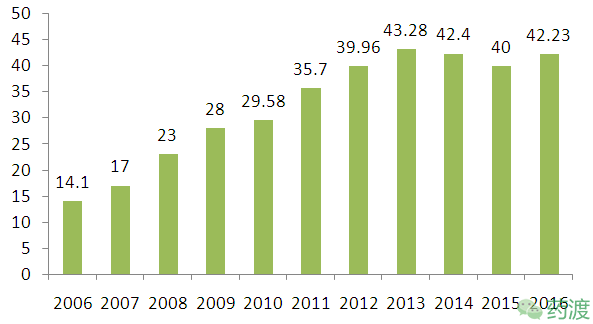
Copaxone一上市,就展示出了重磅药的潜力,销售一路领先,2014年药物专利期满,仿制药上市,TEVA硬是凭借着专利诉讼和长效药的上市,在2015年和2016年仍然占据MS药物全球销售No.1的交椅。
Copaxone近十年全球销售(亿美元)
(数据来源:公司财报)
诺华旗下Sandoz公司开发的通用型格拉替美仿制药已通过美国FDA批准,并以Glatopa的商标名上市销售。辉瑞和Synthon公司开发的格拉替美在美国也获得销售权。此外,中国翰宇药业也获得了美国FDA颁发的醋酸格拉替美DMF注册号,醋酸格拉替美原料药获准进入美国市场,翰宇药业已与美国NASDAQ上市公司爱克龙药业达成战略合作,共同完成醋酸格拉替美FDA仿制药的申报审批工作,并由爱克龙药业负责醋酸格拉替美注射液在美国范围内推广和销售。
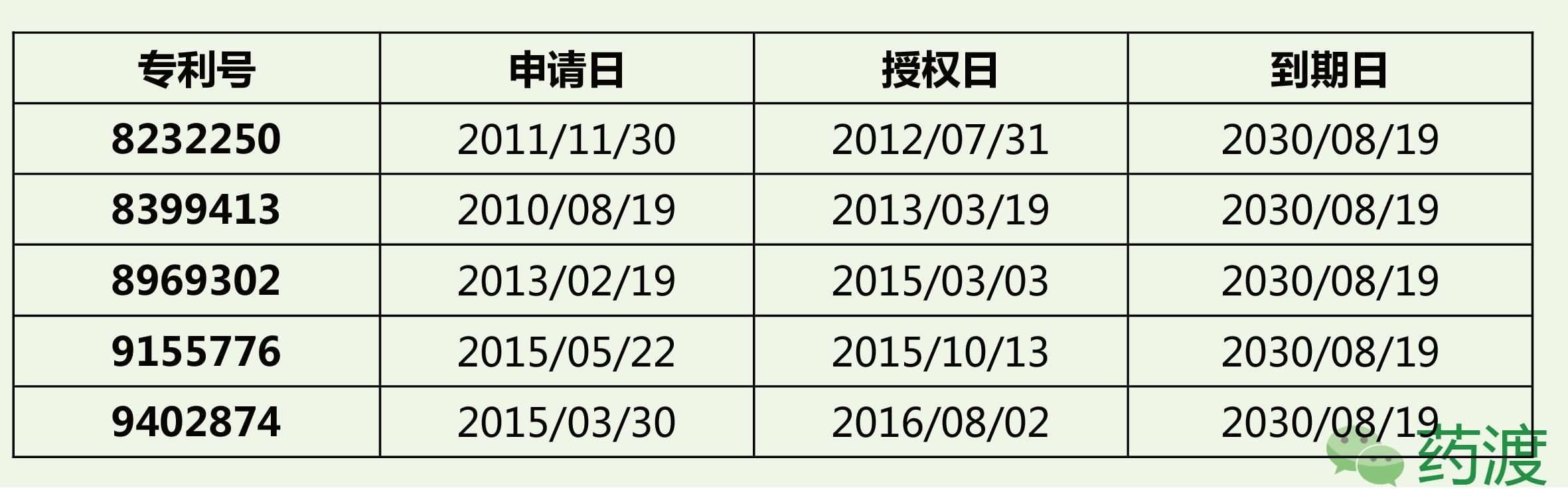
据Orange Book记载,与Copaxone (20mg/ml)产品相关的专利如下:

与长效版Copaxone (40mg/ml)产品相关的专利如下:
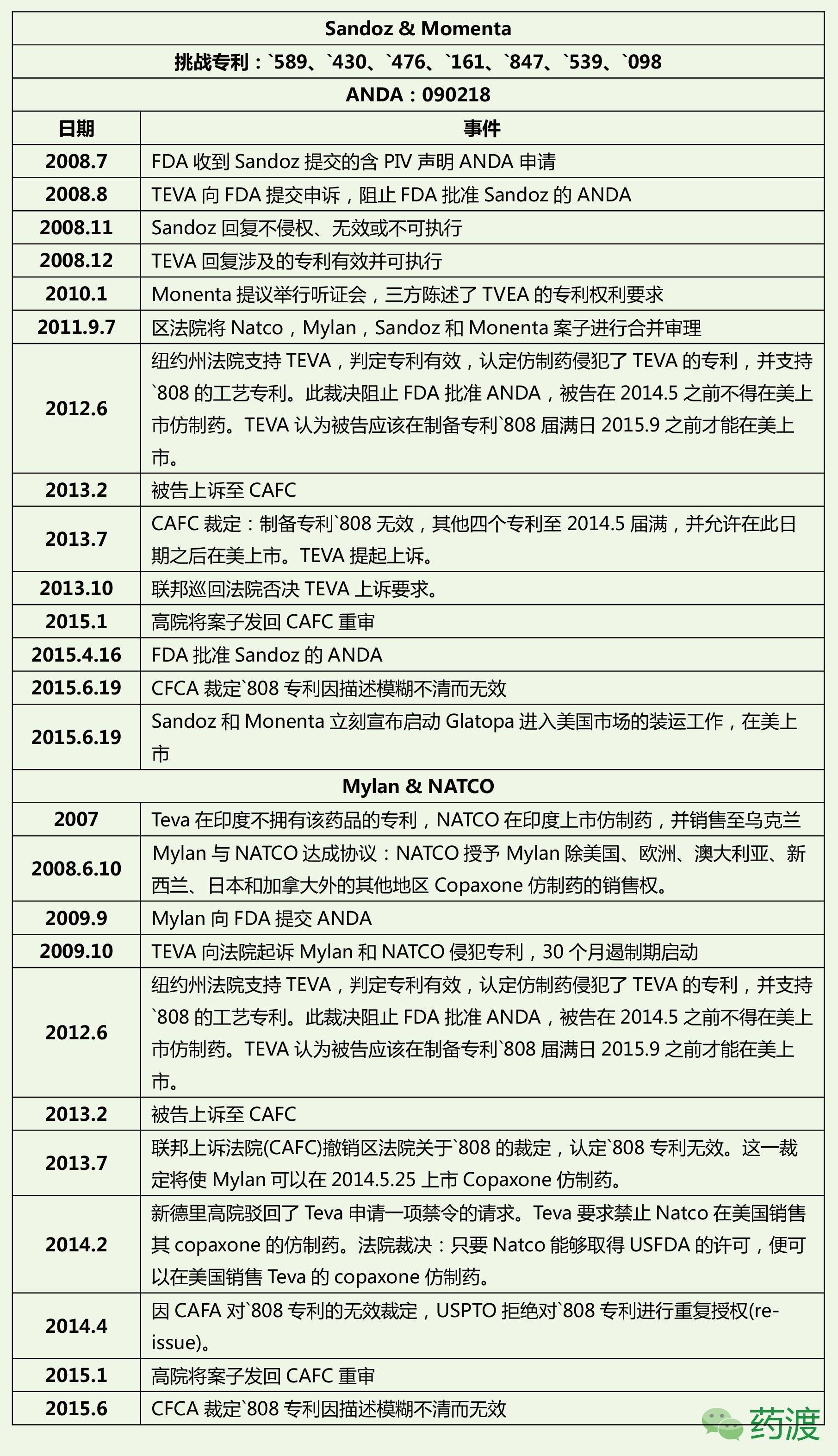
①PIV途径挑战Copaxone 20mg/ml专利
US5800808没有记录在Orang Book中,该专利公开了一种制备工艺,能够很好地控制copolymer-1的分子量,保证药物质量。TEVA在描述这一发明时,设定一个分子量范围,然后描述有样品中有多少分子落在这个范围,“copolymer-1 having an average molecular weight of about 4 to about 8.9 kDa (copolymer-1的平均分子量在4-8.9KDa之间)”。但由于平均分子量表述不清,计算方法太多,算法不同得出的结果不一样。
②IPR程序无效Copaxone 40mg/ml专利

③两种无效专利的方式对比
从Copaxone两种剂型的专利无效途径看,IPR比PIV途径更快更有效,但同时也承担更大的风险。

原研与仿制之间横隔着最大壁垒就是专利, 2012年9月之前在美国仿制药要抢先上市,就要以PIV途径挑战专利,2012年9月之后横空出世的IPR正是对付专利权人一个新鲜的高杀伤力武器,将“快、好、省”的大将之风发挥的淋漓尽致,是所有美国专利的“暗影杀手”,成为各大企业应对专利诉讼的必要法宝,甚至大大威慑了“patent troll”(专利流氓),同时在一定程度上迫使申请人和USPTO去追求更高质量的授权专利。且IPR的绝妙还不仅限于此,机智的美帝同行们还利用IPR的高杀力,在甲乙方进行专利诉讼时以神秘的不相关第三方提IPR无效专利进行搅局。
中国药企的国际化进程日渐加速,可以预见,未来将有更多国内药企向原研以PIV或IPR进行专利挑战。
声明:
本文由药渡头条投稿作者撰写,观点仅代表作者本人,不代表药渡头条立场,欢迎交流补充。联系方式:010-82826195 转8048
如需转载,请务必注明文章作者和来源
投稿详情请点击“4月-5月 | 王牌写手获奖名单”