2020年一场突如其来的疫情使得市场大幅波动,投资者普遍对全球产业链和市场动荡担忧的大环境下,什么样的公司是未来、是核心资产、是中国产业的希望?这既是一个产业问题,也是资本投注中国的核心问题。目前,市场对具备产业规模优势的龙头企业给予很高的估值,对这些龙头公司寄予超越当前盈利的更高期望。但是对科技前沿领域,市场仍在寻找和呼唤。我们认为:
细胞治疗、基因疗法、医疗AI、肿瘤早筛
,这四大领域是少数国内外处于同步探索前进的医药生物科技前沿领域,代表了医疗研究的未来。
基因测序领域在过去几年曾经引发一级市场的投资热潮,随着大量资本涌入,各式各样的基因测序服务公司层出不穷,市场竞争加剧,行业乱象丛生,使得市场对于基因测序行业及其产业应用前景保持将信将疑的态度。事实上,我们认为这都是新行业在发展初期伴生的问题,符合事物发展的一般规律,随着早期的初创企业在摸索中成长,注册监管制度、遗传资源管理办法等政策也逐渐跟随出台,行业将会愈加规范,进入高速发展的轨道。
从海外发展趋势来看,基因测序、肿瘤早筛和伴随诊断等领域的初创企业可以在未盈利状态下登陆纳斯达克,从而获取研究所需的大量资金、推进临床试验。近年来体外诊断领域的海外融资交易有相当大部分由基因检测相关企业完成,并出现了多笔大额交易,体现出海外市场对该领域的持续关注。FoundationMedicine、Exact Sciences、Guardant Health等美股上市公司的股价走势一路上涨也反映了海外投资者对于该领域技术创新的看好。基因测序及其应用作为前沿技术领域,中国和海外并没有太大差距,我们认为本土的优秀企业并不落后于发达国家,甚至有着同步或领先全球的技术、产业化经验和大数据的优势,为未来精准医疗在国内大发展奠定良好基础。
我们认为测序仪作为硬件设备固然重要,测序下游应用则像是软件,基因测序起初主要用于药企和科研机构的测序服务,至今在临床方面的主要成熟应用仍是无创产前检测(NIPT),海内外的企业都在纷纷拓展新的临床应用市场,例如肿瘤检测和早筛领域,市场潜力大,同时研发难度也大,尤其是肿瘤早筛要从看似健康人的几毫升外周血中检测到肿瘤基因变异,更是技术难度极高。随着海内外研发领域的突破,新的产品也在逐步推出,我们相信,未来基因测序的临床应用场景将极为广泛、市场规模也将远超目前的想象。
我们认为优秀的生物科技创新公司应该具备以下重要特点:一是技术创新,具有核心技术和专利;二是具有科学转化为产品的能力,可以成功地从技术走向市场。在这两点上,贝瑞基因均符合标准,公司是最早涉足基因测序领域的企业,也是全球第一家将基因测序技术开发为临床应用(无创产前检测)并且成功商业化的企业,至今也在该细分市场具有龙头地位,寡头垄断格局稳定,后来者难以超越。公司目前的成熟业务持续增长,提供稳定的现金流;聚焦的肿瘤早筛和伴随诊断领域属于高精尖的技术领域,研发难度大,临床壁垒高,资金壁垒高,可以参与竞争的玩家相对较少。在肝癌早筛领域,全球最大的前瞻队列研究即由贝瑞基因发起并即将完成,预计2020下半年-2021年初产品化落地,该细分市场可及人群包括肝硬化和肝炎人群,潜在市场空间或达500亿元左右,将对公司估值和业绩均提供巨大弹性。公司在肿瘤伴随诊断领域布局也较早,目前在中国以及海外已经产生部分收入,基于二代基因测序技术(NGS)的肿瘤伴随诊断市场潜在空间约400-800亿元,目前荧光定量PCR等产品是肿瘤药物伴随诊断的主流,但是二代测序反映的信息更为全面,未来行业趋势将是基因测序应用在该领域的崛起,基因测序将从小Panel到大Panel逐步变化。贝瑞基因在外显子测序、遗传学检测等应用领域拥有丰富的在研产品管线并已经产生部分收入,未来5-10年也有望成长为比无创产前检测大品种拥有更广阔市场空间的细分领域。
我们认为贝瑞基因以创新为本,管理团队技术出身并在海外龙头企业中有技术开发和管理经验,公司有成功的临床转化开发和产品商业化经验,从成立之初就受到资本市场支持,专注主业、稳扎稳打,其发展历史、业务模式等均与美国纳斯达克上市的生物科技股高度相似。目前市场给予的估值仅包含已有业务规模和利润对应的估值,其在肿瘤早筛和肿瘤伴随诊断领域的产品管线均没有反应在市值中。我们认为,公司现有成熟业务提供稳定收入和现金流,保证了安全边际,而肿瘤检测业务则是一个即将兑现的期权,提供向上的巨大弹性。尤其是从公司上市后至今约三年,基因测序行业在二级市场由于多种原因被忽视,目前处于估值底部,存在巨大的市场预期差,是布局的极佳时机。布局贝瑞基因,也符合布局未来医药科技资产的大逻辑。
国信医药团队一直追踪全球生物科技前沿技术的发展趋势,我们认为评价一家生物科技公司是否有潜力成长为科技型企业核心资产,首先看发展战略是否是勇于解决临床上关键的需求——肿瘤早筛无疑意义巨大;其次看公司管理层、研发核心人员的过往成功经历——贝瑞率先探索并产业化NIPT,是少数能领先海外同业的卓越成就。
科技型企业也许并不是短期业绩上最确定的,但是他们可能是中国未来在全球市场的新希望,可能是中国在复杂的国际局势中坚定前行的底气。
估值与投资建议
我们将公司业务按照生育健康、肿瘤业务、外显子测序等重点管线未来十年的收入、盈利进行预测,并采取绝对估值和相对估值两种方式进行估值。生育健康领域随着渗透率提升、新产品推出,整体维持稳定增长,峰值销售约30亿元;肿瘤检测业务由肿瘤早筛和肿瘤伴随诊断两部分组成,峰值销售合计约65亿元;外显子测序领域目前公司已经有一定收入,未来还有广泛的临床应用场景,预计峰值销售在34亿元。1)绝对估值:采取FCFF折现方法,WACC=10.73%,永续增长率2%,得到公司的合理价值区间为51.27-65.20元。2)相对估值:贝瑞基因公司从发展历史、业务领域、技术路径等方面与美国生物科技公司高度相似,不同之处在于公司已经拥有一些带来利润和现金流的业务,而海外生物科技公司往往净利润为负。我们认为公司的相对估值应该从分为两个部分来进行分析,一部分是已经有利润的现有业务部分,我们对这部分估值采取和国内可比公司相对估值,得到对应市值90-101亿元,另一部分是拥有巨大潜力空间的肿瘤检测业务部分,这部分我们和海外可比公司对标
进行相对估值(估值63-138亿元),然后再进行两部分加总,得到相对估值合理范围在153-239亿元,对应股价为43.15-67.40元。综合上述绝对估值和相对估值,我们认为公司合理价值在47.21-66.30元之间。
2019-2022年预计已有产前检测业务以10%-15%的增速增长,随着后续肝癌早筛产品的推出和生育检测、外显子测序领域新产品的升级和推出,公司收入增速逐渐加快。毛利率随着产品升级而提升。销售费用率随着市场推广而增加、研发费用率也增加,管理费用基本稳定。预计2019-2022年归母净利润4.1/3.6/4.2/5.2亿,增速53%/-12%/17%/24%(由于2019年有非经常性损益9586万,导致高基数,剔除后2020年增速约在15%),当前股价对应PE 31/36/31/25x。公司作为基因测序领域的龙头企业,技术优势显著,肿瘤早筛独家产品预计2020-2021年落地,潜在空间巨大。我们综合绝对和相对估值,合理估值47.21-66.30元,距当前股价36.31元具有30%-83%溢价空间,维持“买入”投资评级。
核心假设与逻辑
第一,公司的无创产前检测业务已经市占率前二,龙头地位稳固,随着市场洗牌、
行业集中度将继续提升。产前渗透率继续提升,检测量持续增加。价格方面,老产品价格下降,但随着产品升级和新产品推出,可以抵御价格下滑风险,整体增长稳定。
第二,肿瘤早筛领域的液体活检技术壁垒高,公司肝癌早筛项目是全球规模最大、进度最快的,灵敏度和特异性指标优秀,优于传统筛查方法,也优于可比公司,项目2020年底-2021年初落地,将独享百亿级别市场。
第三,泛癌种的肿瘤伴随诊断临床需求广泛、市场空间巨大,公司是肿瘤测序领域的头部企业,随着行业注册监管的进一步明晰,市场将更加规模和成熟,公司在该领域的收入也会随之迅速增长。
与市场的差异之处
第一,市场认为基因测序行业的话语权掌握在上游仪器厂商手中,因此认为下游应用开发企业的生存空间不大,我们认为基因测序在临床应用转化方面的难度和市场空间均被严重低估,无创产前检测只是基因测序在临床应用领域的冰山一角;测序仪与下游应用的关系如同计算机的硬件CPU与软件应用的关系,未来测序技术应用会延伸到广泛的临床场景,市场空间巨大,而公司拥有成功的从技术向产品转化的经验,并且在学术和临床领域均积累口碑,具有明显的优势。
第二,市场认为基因检测市场乱象横生,以高销售费用率为驱动因素,企业之间同质化严重,我们认为基因检测的应用开发具有难度,尤其是在肿瘤早筛领域,研发存在技术壁垒、临床壁垒、资金壁垒,我们认为公司的技术积累深厚、临床试验进度超前、医疗渠道资源丰富,三者共同筑造护城河,将具有巨大的先发优势。
第三,市场对于生物科技创新类的公司的估值缺乏正确的认知,我们认为从海外市场来看,美股上的肿瘤早筛和伴随诊断类公司如Exact Sciences、Guardant Health市值一路攀升,估值在60-120亿美元,这些企业有一定收入但均未实现盈利,但市场基本按照PS给予估值。A股市场随着科创版推出、越来越多的未盈利的创新企业上市,估值体系有望和全球接轨,向纳斯达克看齐;对于研发投入巨大、未来潜力更大的生物科技类公司,我们认为应该关注企业未来的收入而非利润,对于未来的产品管线应该从PS或者DCF角度考虑估值。本文中,我们考虑到公司业务的创新属性,对于公司采用了相对估值和绝对估值两种方法进行估值:1)相对估值我们将已有业务产生的利润采用国内可比公司估值,对于肿瘤业务,由于还处于研发投入巨大的未盈利阶段,我们采用海外可比公司PS估值并折现到2020年,再将两部分估值相加;2)绝对估值法:我们对公司业务未来十年收入利润进行详细预测,并采用DCF估值折现。
股价变化的催化因素
第一,公司肝癌早筛项目作为“十三五”重大科技专项,2020年内将结题,预计2020-2021年产品落地,相关学术会议和文章中临床数据的公布将进一步增强产品落地的确定性,带来估值弹性。
第二,肿瘤伴随诊断领域相关监管政策有望明朗,将推动行业的规范发展,市场规模随之迅速扩大。
核心假设或逻辑的主要风险
第一,政策进展低于预期;
第二,研发和产品注册进度低于预期;
第三,市场推广和商业化进展低于预期。
贝瑞基因——中国基因测序行业龙头,专注临床应用与服务

贝瑞基因(全名“北京贝瑞和康生物技术有限公司”)成立于2010年5月,是致力于应用高通量基因测序技术,为临床医学疾病筛查和诊断提供“无创式”整体解决方案的研发型生物科技公司。公司的主营业务包括产前检测、孕前检测、遗传病检测以及肿瘤检测。贝瑞基因在这些领域累积的数据,已构建为具有中国人群特色的基因组大数据库。通过与贝勒医学院、阿里云等国际领先的医学
科技机构合作,贝瑞和康未来将借助云平台,实现基因组数据最简化的终端应用和实时共享。2015年3月,公司生产的基因测序仪(NextSeq CN500),以及胎儿染色体非整倍体(T13/T18/T21)检测试剂盒(可逆末端终止测序法)医疗器械产品成功注册,标志着贝瑞和康成功布局基因检测上游产业。

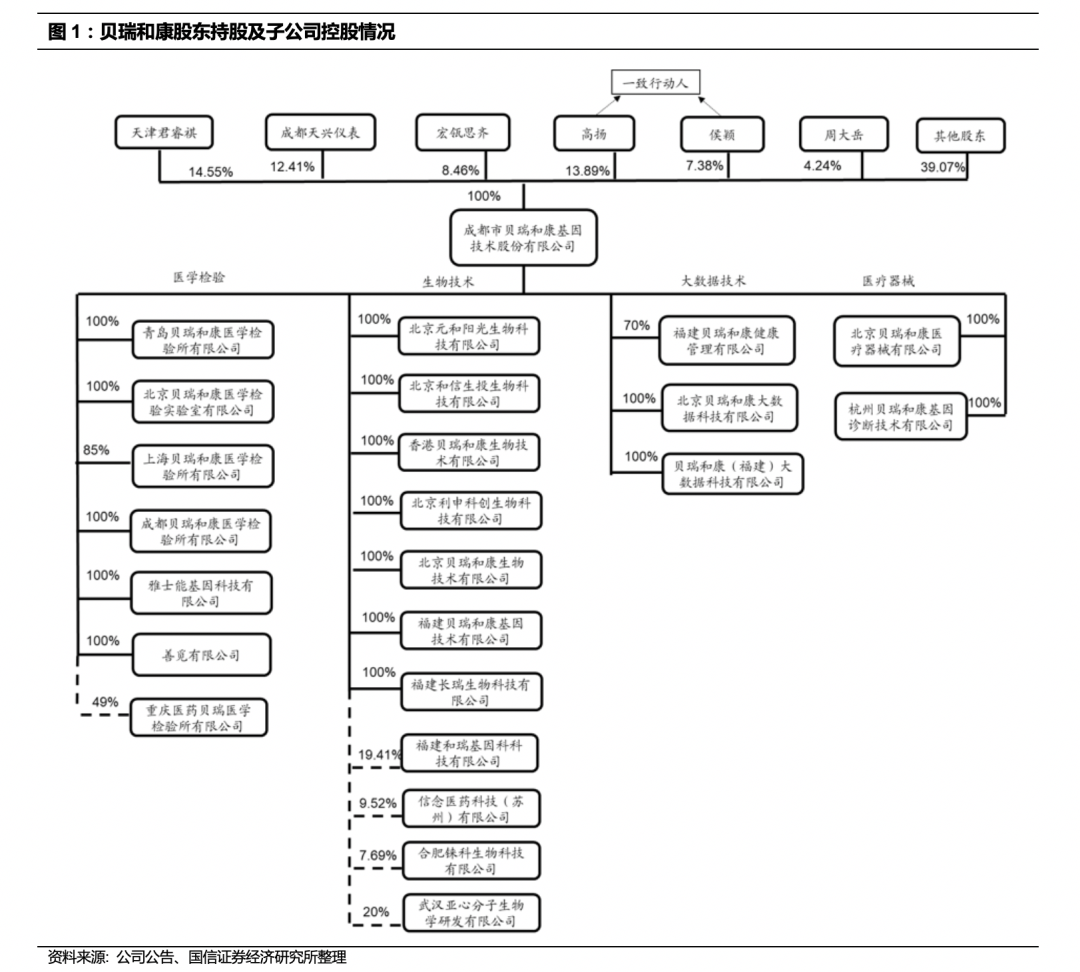
贝瑞基因拥有医学检验、测序仪生产等子公司,涵盖基因测序产业链各阶段。
贝瑞共有16家子公司。在北京、上海、成都、重庆、长沙、青岛、福州、香港多地设立医学检验实验室,并在香港设有三家子公司(香港贝瑞、雅士能公司和善觅公
司)。贝瑞基因通过杭州贝瑞进行测序仪及试剂生产、北京贝瑞进行测序仪及试剂销售,与多家医院合作共建实验室,建立覆盖全国区域的渠道网络,形成具有运营效率的业务体系。
股权结构清晰。
作为科技创新类公司,公司与美股纳斯达克类上市公司高度相似,从成立之初起就获得一级市场资金支持,先后获得君联资本、启明创投、博裕资本、天士力控股旗下天津康士金等机构多轮融资。2011年9月及2012年12月,贝瑞和康获得君联资本A轮融资5800万元人民币,在2013年中获得了启明创投领投的2亿元人民币B轮融资,资金帮助公司业务线上不断扩张。2017年公司借壳天兴仪表成功上市,成为基因测序领域A股第一股。目前贝瑞基因前十大股东中,个人股东3名,其中董事长兼副总经理高扬持股13.89%,董事侯颖持股7.38%,为高扬的一致行动人,因此高扬以21.27%的控制权比例成为公司的实际控制人。周大岳持股4.24%,为公司董事兼总经理周代星之兄,未在公司担任任何职务。
管理层技术出身,行业积累深厚。
贝瑞和康是国内最早进入基因测序领域的公司之一。其创始人在基因测序领域有很深的技术和商业积累。对于高科技企业来说,人才是决定性的因素,贝瑞基因已经形成了一支有竞争力的团队,截至2018年底,博士、研究生及大学学历的员工占总人数的69%以上,相对年轻而高素质的队伍,为公司的崛起和快速成长奠定基础。
-
创始人&CEO周代星博士是国际上新一代测序技术和无创产前DNA检测技术的先驱者之一,荣获《第一财经周刊》主办的“2013中国商业创新50人”技术创新奖。他是世界上最早提出用短序列进行ChIP SEQ、表达谱、de novo测序等技术的人员之一,为后来Solexa技术的推广奠定了基础。周博士在马里兰大学巴尔的摩分校获博士学位,于杜克大学进行博士后研究。先后担任美国Lynx/Solexa公司生物信息部经理,美国Illumina公司亚太日本区测序销售总监,美国Life Technologies公司全球测序部市场发展总监。周博士是最早开发无创产前检测技术并在中国产业化的第一人。
-
创始人&董事长高扬博士毕业于中国科学院北京基因组研究所基因组学专业,曾担任HapMap组副组长、中国团队生物信息负责人,负责人类基因组国际HapMap计划“中国卷”所有的探针设计、数据分析和递交工作。并独创的血浆DNA高通量测序文库构建技术(业内称“高氏定律)”,奠定了无创DNA产前检测项目的创业基础。并且是原华大医学负责人,在NIPT产品研发和市场早期推广有充分的经验。
-
其他核心管理层稳定,从股权情况来看,核心骨干也持有公司股份,如销售总监,财务总监,生产总监,事业发展部总监等均有0.4%~0.5%的股份。2019年11月27日公告将以集中竞价交易方式回购股份方案的议案,拟使用自有资金或自筹资金以不超过50元/股(含)的价格回购300万股-600万股,资金总额最高为3亿万元,回购股份70%将用于员工股权激励。

主业以医学检测产品和应用为主,科研服务、仪器销售为辅
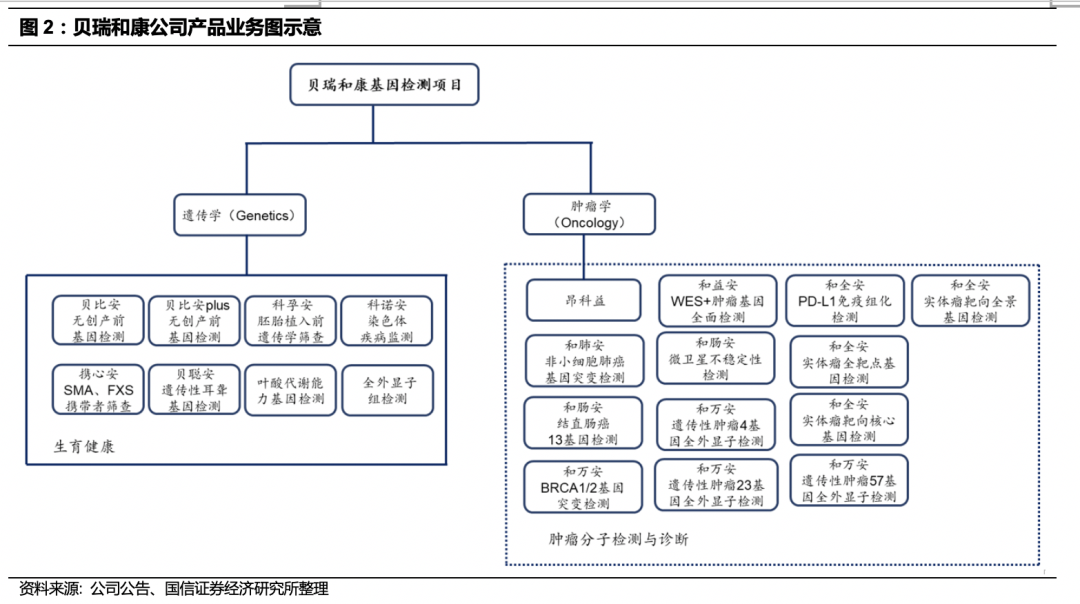
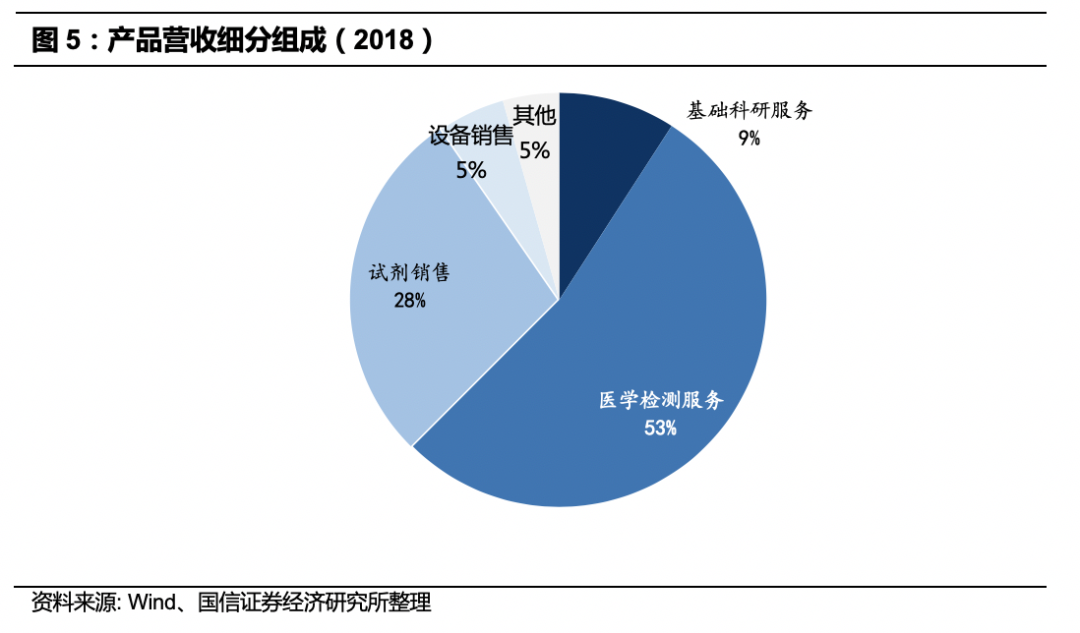
贝瑞和康主营业务为以测序为基础的基因检测服务与设备和试剂销售,依托高通量测序分子诊断平台和自主研发的核心技术,产品和服务覆盖生育健康、遗传病检测、肿瘤分子检测与诊断的多层次。通过服务模式和产品模式为各级医院、第三方医学实验室等医疗机构提供医学产品及服务;为科研院校、研究所等科研机构提供基于高通量测序的基础科研服务。
医学检验产品和服务:医学检测主要有遗传学和肿瘤学两个应用方向。
涉及产前检测、孕前检测、遗传病检测以及肿瘤检测领域。形成了从染色体数目和结构水平、染色体微缺失微重复水平、基因水平的技术维度层层深入;从婚前、孕前、产前、新生儿、癌症的产品维度渐次覆盖;从单个个体基因组数据解读到群体基因组数据分析,再到指导性个体基因组数据解读的数字化维度逐级递进的三维立体发展结构。
1)遗传学检测业务:
遗传学应用主要包括“贝比安”无创产前基因检测及在“贝比安”基础上提供更全面检测的“贝比安Plus” 项目、“科诺安”染色体疾病检测、“科孕安”胚胎植入前遗传学筛查;2015年通过服务模式和产品模式完成NIPT合计约23.76 万例。2016 年贝瑞和康以服务模式检测样本数量在59.5万例。我们估计2019年全国NIPT检测量超过400万例,公司和华大基因分别占全国市场30-40%,形成寡头垄断格局。具体分析参见后文章节。

2)肿瘤检测业务
:目前公司的肿瘤学应用主要包括非小细胞肺癌基因突变检测、结直肠癌基因检测、妇科肿瘤基因检测、遗传性肿瘤全外显子检测、实体瘤靶向核心基因检测、实体瘤全靶点基因检测等产品。公司成员企业福建和瑞完整继承公司原有肿瘤业务后,在全球创新的专利基因突变检测技术—cSMART技术基础上,衍生出了完整的肿瘤基因检测技术体系,开发出了包括cSMART2.0、capSMART-RNA、SnapShot、HomeSeq、MeCap等在内的一系列专有技术。不断丰富肿瘤液态活检产品,涉及靶向用药检测、疗效监测、预后判断、肿瘤易感性检测、肿瘤个体化医疗等全方位检测。同时,全力投入肿瘤早诊研发项目,把实现肿瘤学检测业务由晚期检测诊断向早期、极早期筛查领域延伸作为战略发展方向。公司肿瘤分子检测采用液态活检技术。公司自主研发的、具有万级技术分辨率的cSMART液态活检技术已获得国内外专利。液态活检技术利用高通量测序技术检测血液中小DNA碎片,通过简单的血液检测可对遗传侵入进行定位、研究和监控,在肿瘤分子检测中具有简便、快捷、无创的优势。同时,液态活检技术的高灵敏度要求推动着仪器监测灵敏度的技术革新,也为公司实现肿瘤学检测业务由晚期检测诊断向早期、极早期筛查领域延伸提供领先的技术支持。公司在肿瘤早筛以及中晚期的肿瘤监测,研发投入巨大,产品落地在即。具体分析参见后文章节。
基础科研服务:
贝瑞和康面向科研院校、研究所等科研机构提供基于高通量测序技术,以Illumina测序平台为主的基础科研服务。
基础科研服务以重测序、转录组测序为主,同时提供外显子组测序、染色体免疫沉淀测序等测序服务。
2016年第2、第3季度,引入PacBio Sequel三代测序平台及BioNano Irys光学图谱平台。
2019年第3季度,引入PacBio Sequel II三代测序平台,并将独家为该平台申请国家药品监督管理局的注册证,致力于整合二代、三代测序技术优势,提供更加完整、高效的基因组学测序服务。
具体分析参见后文章节。
仪器设备销售:
基因测序行业非常依赖上游仪器和试剂,公司通过与Illumina合作开拓上游测序仪器市场,2015年3月20日,合作设计的新型高通量基因测序仪(NextSeq CN500),获CFDA批准。合作模式为Illumina向贝瑞和康提供测序仪主要零部件,贝瑞和康在完成其他零部件的采购后,按照相关说明和标准制造IVD测序仪,Illumina所提供部件的供货价由全球总部确定。贝瑞和康负责1)获取NIPT及其他产品临床批件;2)从市场营销、招标到回款、售后各个环节;3)向医院提供测序服务,部分情况下需投放服务人员;4)决定销售策略(投放或销售)。NextSeq CN500专门为医院而开发,具有操作简便、通量大、数据质量高、检测成本低等特点。上市至今,已经进入100多家有资质的医疗机构,并获得市场认可。2019年7月适用范围为“用于人脱氧核糖核酸(DNA)测序,以检测基因序列,这些基因序列变化可能导致存在疾病或易感性。该仪器在临床上可用于与国家药品监督管理部门批准的体外诊断试剂以及仪器配套的随机软件配合检测,且不用于人类全基因组的测序或从头测序”。适用范围扩展,意味着可以在遗传病、肿瘤等领域应用,加快公司研究成果的临床推广。
检测试剂盒销售:
胎儿染色体非整倍体(T13/T18/T21)检测试剂盒(可逆末端终止测序法)医疗器械产品于2015年获CFDA批准。试剂主要有高通量测序试剂盒、DNA血浆游离DNA提取试剂盒、高通量测序文库构建DNA纯化试剂盒等。
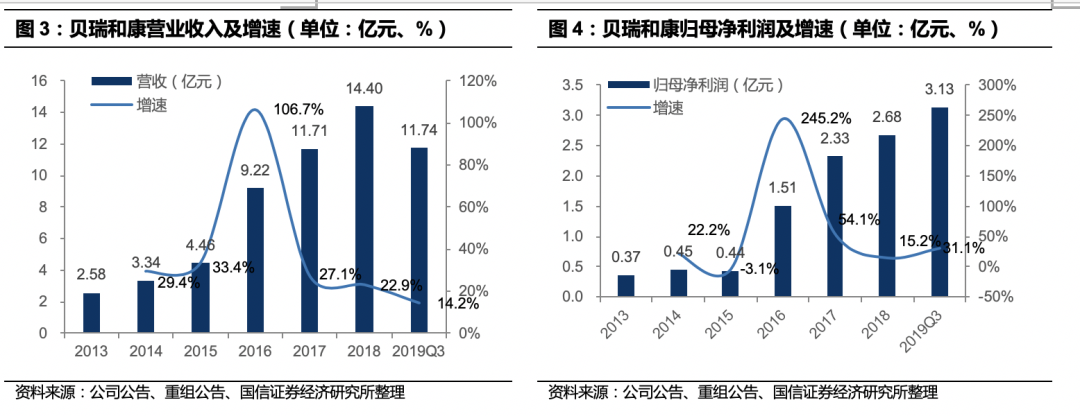
业绩稳健增长
业绩稳健增长
。2013-2018年,贝瑞和康营收增长CAGR41.01%,归母净利润增长CAGR48.65%。2019年前三季度实现营业收入11.7亿元(+14.2%);归母净利润3.1亿元(+31.1%);扣非后归母净利润2.2亿元(-6%);预告2019年归母净利润4.1~4.4亿元(+52.9%~64.1%)。
公司优势
技术优势
贝瑞和康自主研发的核心技术主要是在测序前DNA建库及后续的信息分析,主要包括EZ-PALO快速建库方法、EZ-GALO快速建库方法、SUGA快速建库方法、RUPA极速信息分析方法和cSMART技术。目前也有多项专利通过PCT途径递交国际专利申请。依托高通量测序分子诊断平台,推出NIPT等多个产品,构建覆盖生育健康、肿瘤分子检测与诊断的多层次产品及服务体系。我们认为其中最为核心的是cSMART技术,可以在液体活检中发挥巨大作用,灵敏度高,应用广泛,并且拥有国内外专利。
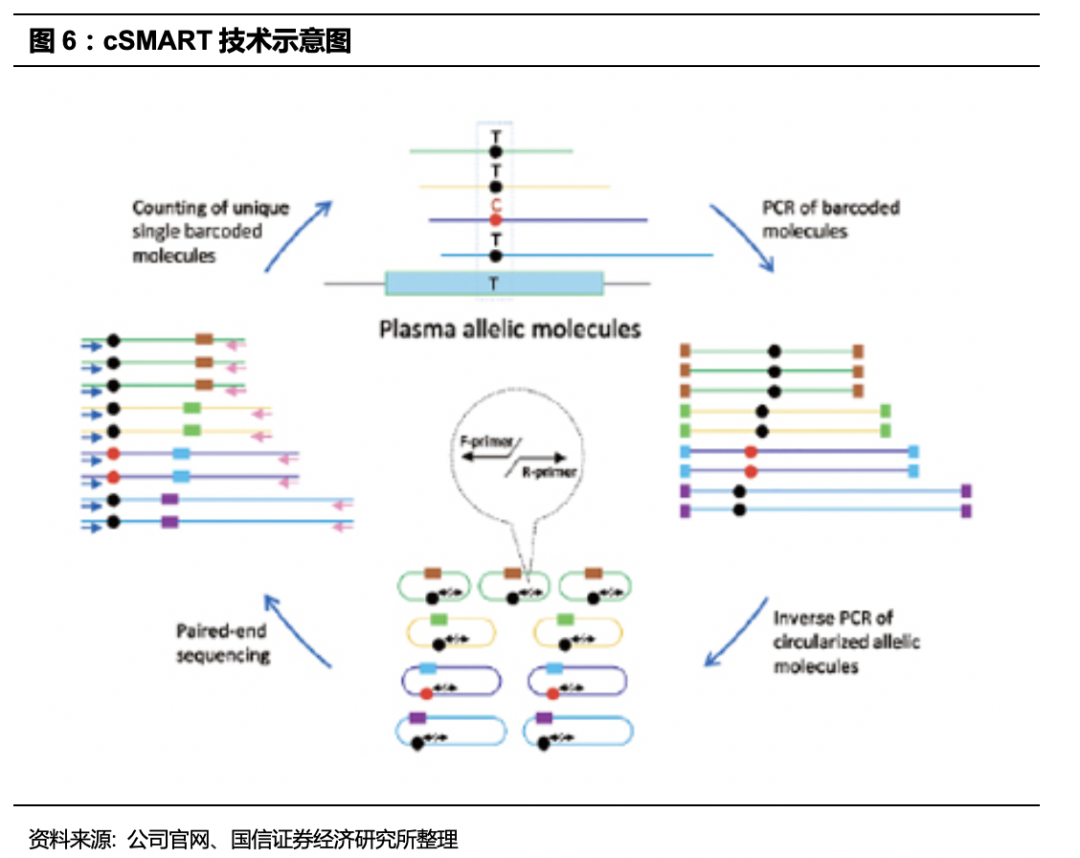
-
cSMART2.0
:cSMART 2.0 技术是cSMART技术的升级版,继承了cSMART技术高灵敏度、可绝对定量的优势,并且可适用于大Panel全外显子区域的检测。
-
EZ-PALO快速建库方法
:贝瑞和康自主开发一套无创DNA产前检测文库构建技术,经历不断的优化与完善,截止2013年12月已有150,000例贝比安实践样本的验证,建库成功率始终高于99.5%,并保持极低的重抽血率和极低的实验失败率。该技术可在单个反应管内,经过2次加样,1个小时完成酶促反应,1次纯化便得到测序文库,流程时间约是通常方法的1/3,是目前世界上更简单、更快速的无创DNA产前文库构建方法。
-
PCR-free建库核心技术
:贝瑞基因自主研发的快速PCR-free文库构建技术,克服了传统检测染色体拷贝数变异的方法在分辨率、全基因组覆盖程度、通量和成本等方面的不足,同时克服NGS建库过程中PCR扩增偏好性带来的问题,提供了一种不依赖PCR扩增的检测染色体拷贝数变异的测序文库构建方法。该方法基于高通量测序平台,gDNA经过双链DNA片段化酶打断后,再经过修复和连接头后即可得到可以上机测序的文库。整个过程只包含gDNA片段化、修复和连接头三步反应,并且三步反应完全可以在一个体系中完成,中间无需转管或者纯化的步骤。整个文库构建过程操作简便,结果准确可靠,无扩增偏好性,数据重复性极佳。成本较低,更适合大规模实验操作。

研发方面,贝瑞和康通过研发优势不断优化和革新核心技术,丰富产品及服务体系,促使贝瑞和康保持持续盈利能力,从而驱动贝瑞和康进一步提升整体核心竞争力。研发投入迅速增加,2010-2018年累计投入1.99亿元,占营收的4.13%,占净利润的40.20%,2019年截止到第三季度投入8226万元,占营收的7.00%,占净利润的26.49%。考虑到公司投入最大的肿瘤业务在子公司和瑞基因层面,这部分投入几乎没有体现在报表的研发费用中。另外由于是高科技企业,还收到一定的政府补贴(约在1000万规模),尤其是产前检测项目和肿瘤项目。
下游渠道优势
加强医院合作,渠道能力强。
与多家临床应用机构建立战略合作关系,目前已有2000多家合作伙伴。贝瑞和康与下游医院的渠道建设,得益于已存在多年的产前筛查、产前诊断中心全国网络。公司的铺陈相当于在原有的机制上引入新的技术,不需要再进行基础设施的重复建设。关于与医院的合作模式主要有服务模式和产品模式两种。服务模式(LDT模式)由医生推荐孕妇到合作公司进行检测,或者医院抽血之后,将样本送至检测机构,双方在利润上的分成因医院而异。产品模式是注册获批的试剂盒进院销售。
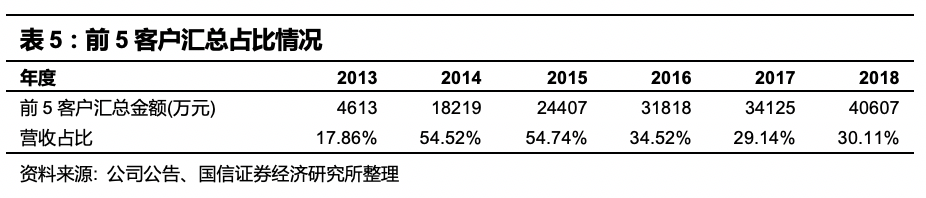
从前5客户汇总占比来看,客户集中度逐渐降低
,前五名客户合计销售金额占比2018年降低至30%。2017年最大客户占年度销售额的20.26%,2018年下降到了12.49%,客户分布于各大科研院所、高校和医院。
客户覆盖全面,以直销为主。
目前,贝瑞基因的业务网络覆盖国内30多个省市自治区,超过4000余家医疗机构、科研机构和高等院校,辐射台湾、香港、东南亚、中东等国家和地区,在中国大陆8个城市建立了医学检验实验室。公司推出适合医院自主开展检测项目的测序平台(包括测序仪及配套试剂、分析软件)。自2015年3月获得NMPA医疗器械许可证以来,该测序平台已经进入百余家医院,形成了广泛的、极具客户粘性的商业运营网络。贝瑞基因立足为客户提供覆盖设计、施工、仪器供货、技术培训等环节的实验室定制咨询服务,让服务模式和产品模式贴合客户需求,并通过与优质客户的合作,以点带面,搭建完整的渠道网络。
先发与规模优势
公司已经在国内NIPT市场占有率前二,公司结构相对简单,专注细分领域,业务范围和战略模式都是在基因测序产业链内布局。基因测序的临床应用领域先发优势明显,临床试验有较高壁垒,后来者很难追赶。
管理团队优势
已在公司管理中分析过,创始人及核心管理层均有研发和技术背景,在行业中有多年积累,有国际企业的管理经验,核心管理层稳定。
总结:公司
以技术创新为本,管理团队技术出身并在海外龙头企业中有管理经验,拥有成功的临床应用产品开发和商业化的经验,公司从成立之初开始就受到资本市场支持,专注主业,稳扎稳打,其发展历史、业务模式等均与美国纳斯达克上市的生物科技股高度相似。
公司成员企业福建和瑞完整继承公司原有肿瘤业务后,在全球创新的专利基因突变检测技术—cSMART技术基础上,衍生出了完整的肿瘤基因检测技术,开发出了包括cSMART2.0、capSMART-RNA、SnapShot、HomeSeq、MeCap等等在内的一系列专有技术。不断丰富肿瘤液态活检产品,涉及靶向用药检测、疗效监测、预后判断、肿瘤易感性检测、肿瘤个体化医疗等全方位检测。同时,全力投入肿瘤早诊研发项目,把实现肿瘤学检测业务由晚期检测诊断向早期、极早期筛查领域延伸作为战略发展方向。目前公司已经拥有非小细胞肺癌基因突变检测、结直肠癌基因检测、妇科肿瘤基因检测、遗传性肿瘤全外显子检测、实体瘤靶向核心基因检测、实体瘤全靶点基因检测等产品。
科普:肿瘤是一种基因病,早期诊断意义重大
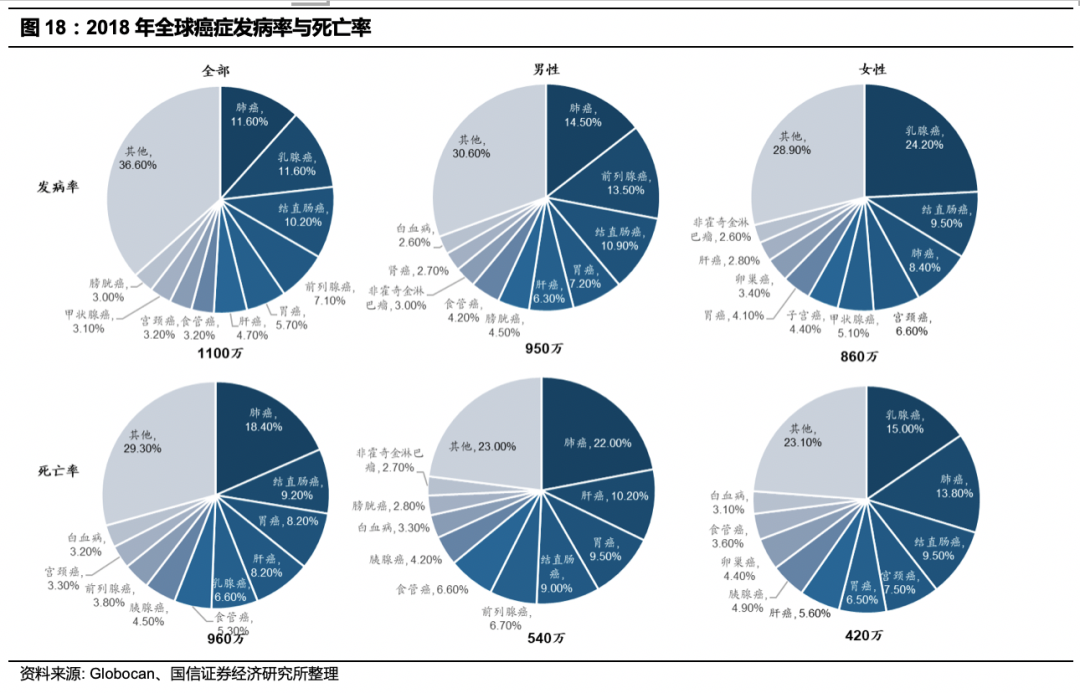
癌症是中国死亡的首要原因,中国癌症死亡率高于发达国家,早期诊断率低是原因之一。
根据国家癌症中心2019年1月发布的《2015年中国恶性肿瘤流行情况分析》显示,中国2015年有新发恶性肿瘤病例392.9万,死亡233.8万,平均每8秒新增一名癌症患者,每13.5秒有一名癌症患者死亡。癌症(恶性肿瘤)已成为威胁中国人健康的第一大杀手,恶性肿瘤死因占居民全部死因的23.91%。近10多年来,恶性肿瘤的发病死亡率均呈持续上升态势,每年因恶性肿瘤所致的医疗花费超过2200亿,防控形势较为严峻。根据《2018年全球癌症统计》,2018年全球估计有1819万癌症新发病例以及960万癌症死亡病例。中国估计有430万新发癌症病例和290万癌症死亡病例。中国癌症发病率(201.7/十万人)略高于全球平均水平(197.7/十万人),并且中国癌症的谱图正在从发展中国家向发达国家变化,与2000年相比,生活方式相关的西方化癌症(如大肠癌,前列腺癌,膀胱癌)的发病率有所上升,消化道领域癌症发病率有所下降。与美国和英国相比,中国的癌症发病率较低,但死亡率高(130.1/十万人),较英国(103.6/十万人)和全球水平(101.1/十万人)高30%,较美国(91/十万人)高40%。中国36.4%癌症相关死亡来自消化道癌症(胃癌,肝癌和食道癌),并且预后相对较差,美英这一比例为5%。中国癌症死亡率较高的原因可能有早期癌症的诊断率较低,以及临床癌症治疗策略与海外的差异。
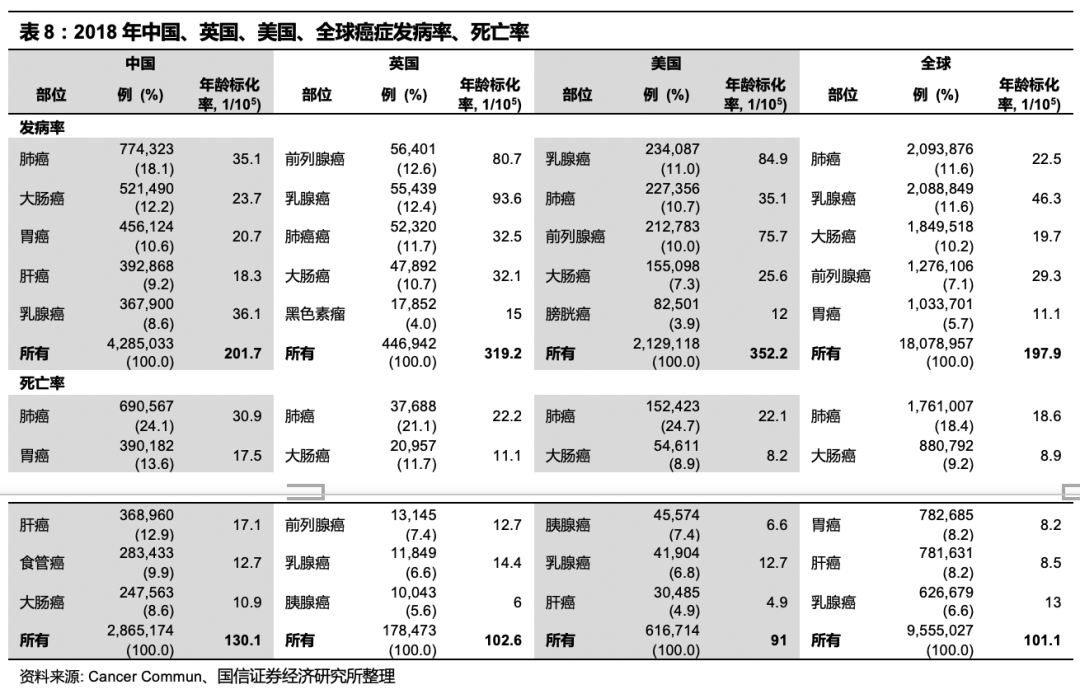
肿瘤是一种基因病,肿瘤的发生和发展是一个长期、分阶段的、多种基因突变积累的过程
。最初的阶段是分子层面变化,由于遗传因素或者环境因素的相互作用,导致了DNA 、RNA 发生突变,然后是蛋白分子层面变化。经过数年积累,通过多次细胞分裂的过程,会有少数细胞获得无限增殖的能力,成为肿瘤细胞,如果成功逃脱免疫系统的清除,继续增殖就会发展成为肿瘤组织,进入早癌阶段,在这个阶段,部分恶性度较高的肿瘤已具有侵袭性和转移性。早癌组织经过1-3年的生长,逐渐变大,产生占位,对周围组织和神经产生压迫,让患者出现不适症状,这时已进入癌症的中晚期,肿瘤细胞侵袭血管组织,并多发转移。诊断延迟及无法获得治疗是导致全球肿瘤发病及死亡的两个重要原因。早期诊断可以改善癌症预后,极大提升治疗成功率、降低成本、避免病情复杂化。
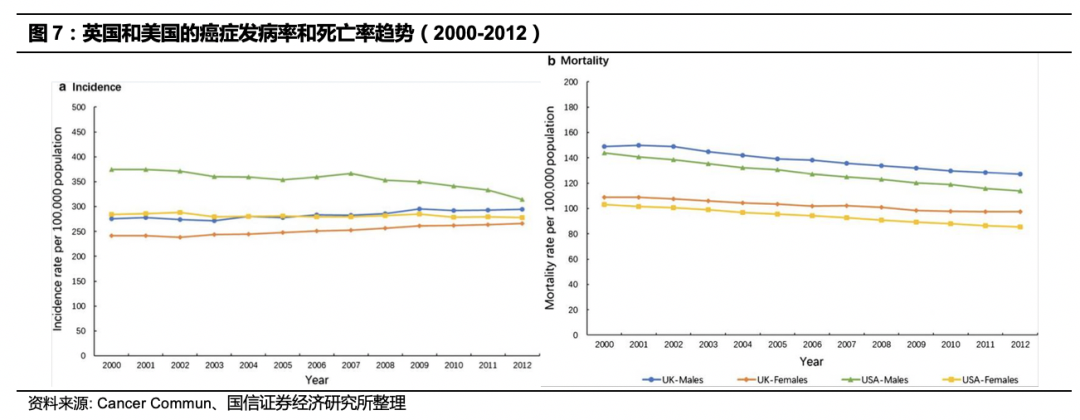
根据WHO数据,2000-2012年,美国所有癌症类型的总体癌症发生率和死亡率均显示出明显的下降趋势。英国癌症发病率略有增加,但总体癌症死亡率在女性和男性中分别下降了约11%和15%。
美国癌症死亡率显著降低,除了其医疗科研水平提升的因素外,肿瘤筛查的大力推广也起到了至关重要的作用。
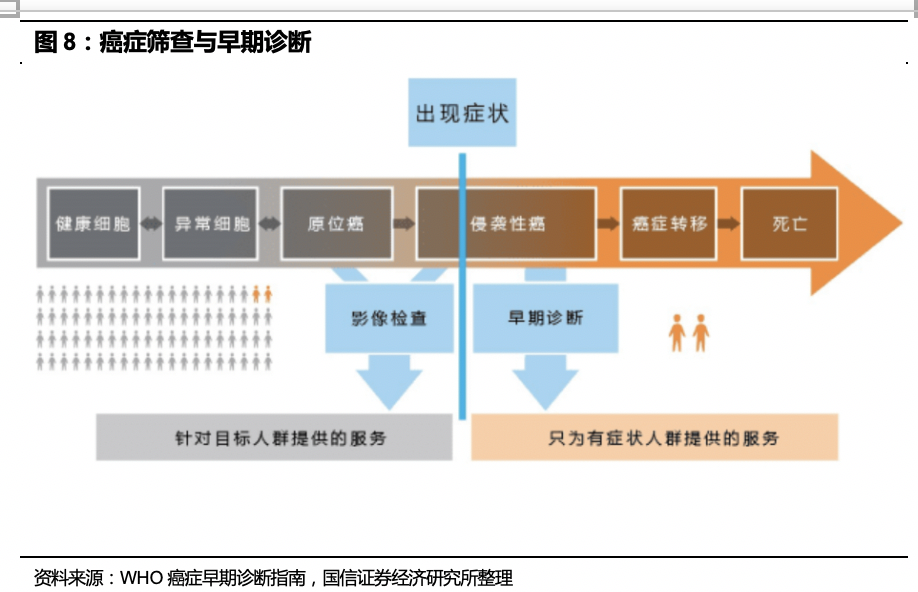
癌症早期诊断意义重大,对肿瘤进行早筛和早诊,可以更大概率地发现早期癌症,从而提高其五年生存率,降低死亡率。
根据WHO的定义,肿瘤早期筛查是指用快速、简便的测试、检查方法,从看起来健康、尚未出现症状的目标人群中筛选出极少数肿瘤高危群体。需要注意的是,筛选出的阳性者还需要其它技术手段进一步诊断。肿瘤防治的关键在于“三早”,即早期预防、早期诊断和早期治疗环节。很多肿瘤在出现症状前,已具有转移能力,等出现症状时,往往难以治疗,如果能早期筛查出高危个体,经确诊后早期治疗,具有较高的五年生存率。世界卫生组织曾指出,40%以上的癌症是可以预防的,“三早”是降低癌症死亡率的关键。以结直肠癌为例,1期肿瘤的五年生存率为95%,2期肿瘤的五年生存率为75%,3期肿瘤的五年生存率降为40%,4期肿瘤的五年生存率只有8%。所以,肿瘤的早筛早诊早治疗对提高五年生存率具有非常大的意义。但是目前早期癌症检出率极低,肿瘤的早筛和早诊还有待普及。《“健康中国2030”规划纲要》指出,要强化慢性病筛查和早期发现,针对高发地区重点癌症开展早诊早治工作,推动癌症、脑卒中、冠心病等慢性病的机会性筛查。并提出到2030年,要实现全人群、全生命周期的慢性病健康管理,总体癌症5年生存率提高15%。
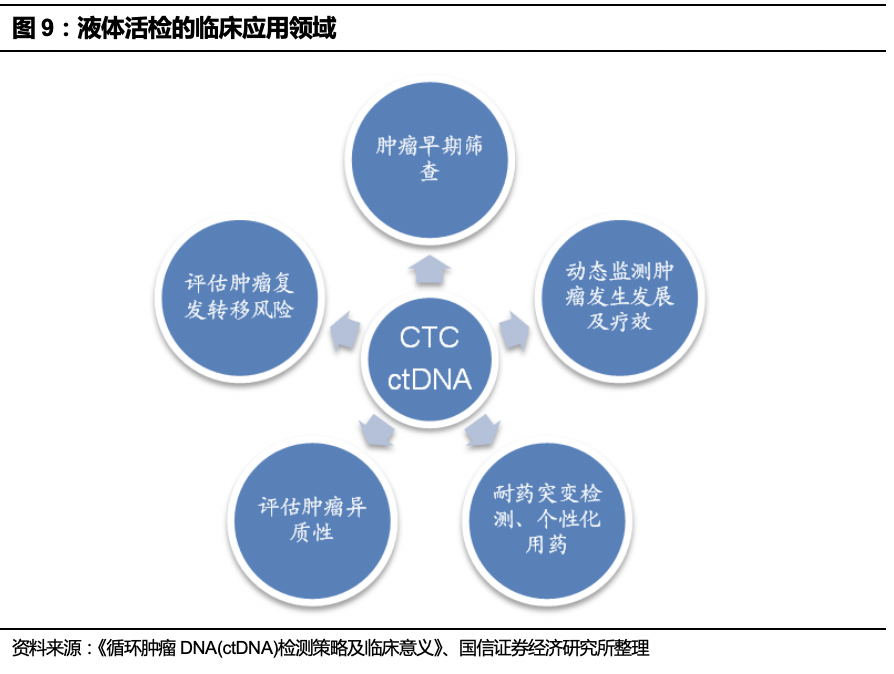
目前肿瘤检测方法主要分为传统检测和基因检测两种,涵盖血清肿瘤标记物、医学影像学检查、组织活检、液体活检等方式。
液体活检是通过检测血液中的循环肿瘤细胞或循环肿瘤细胞DNA对患者肿瘤进行诊断与监测,相较组织活检有诸多优点。
肿瘤患者血液中存在少量循环肿瘤细胞(CTC)以及由坏死癌细胞释放的少量循环肿瘤DNA(ctDNA)。通过检测血液中的CTC和ctDNA对患者肿瘤进行诊断与监测的方法被称为液体活检。在临床实践中,获得肿瘤患者组织样本只有手术活检和穿刺活检两种。相比于传统的活检方法,液体活检具有副作用小、操作简单、能重复取样等优点。【液体活检详细介绍请参考:
【国信医药】基因检测的蓝海,液体活检迅速崛起——基因测序行业专题
】
肝癌早筛——独家产品,潜在百亿级市场
肝癌发病率和致死率高,亚洲发病率高于全球。
2018年WHO数据显示全球肝癌发病人数排在第六,为第四大癌症死因,每年约有84.1万新病例和78.2万例死亡。在大多数地区,男性的发病率和死亡率均高出2到3倍(图13)。因此,肝癌在全球病例中排名第五,在男性死亡方面排名第二(图4A)。蒙古的肝癌发病率远远超过其他任何国家,如中国和韩国男性发病率是世界平均水平4倍。
肝癌和病毒感染等因素高度相关。原发性肝癌主要有肝细胞癌(HCC)(占病例的75%-85%)和肝内胆管癌(占病例的10%-15%)。
肝癌的主要危险因素是慢性感染乙型肝炎病毒(HBV)或丙型肝炎病毒(HCV),受黄曲霉毒素污染的食品,大量饮酒,肥胖,吸烟和2型糖尿病。各地区的主要危险因素因不同,在大多数高风险肝癌地区(中国,东非),关键因素是慢性HBV感染和黄曲霉毒素暴露,而在其他国家(日本,埃及)HCV感染或是主要原因。在蒙古人中,HBV和HCV病毒以及HBV携带者与HCV或δ肝炎病毒的合并感染以及酗酒,都是造成高负担的原因。肥胖患病率上升被认为是导致HCC发病率上升的原因。
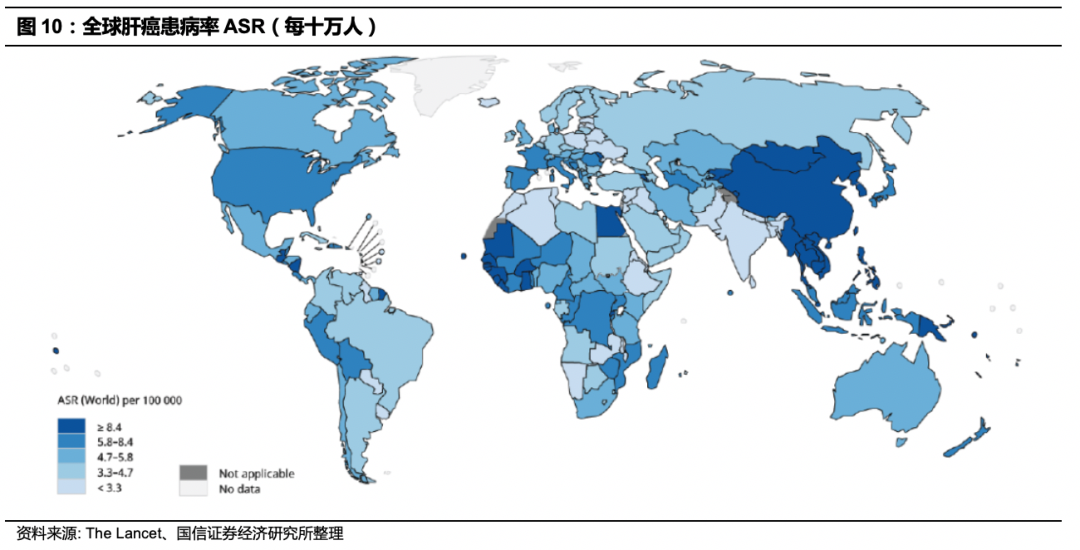
随着HBV和HCV感染患者生存时间的延长,肝癌发生风险逐年增加。肝癌导致的死亡亦逐年增加。
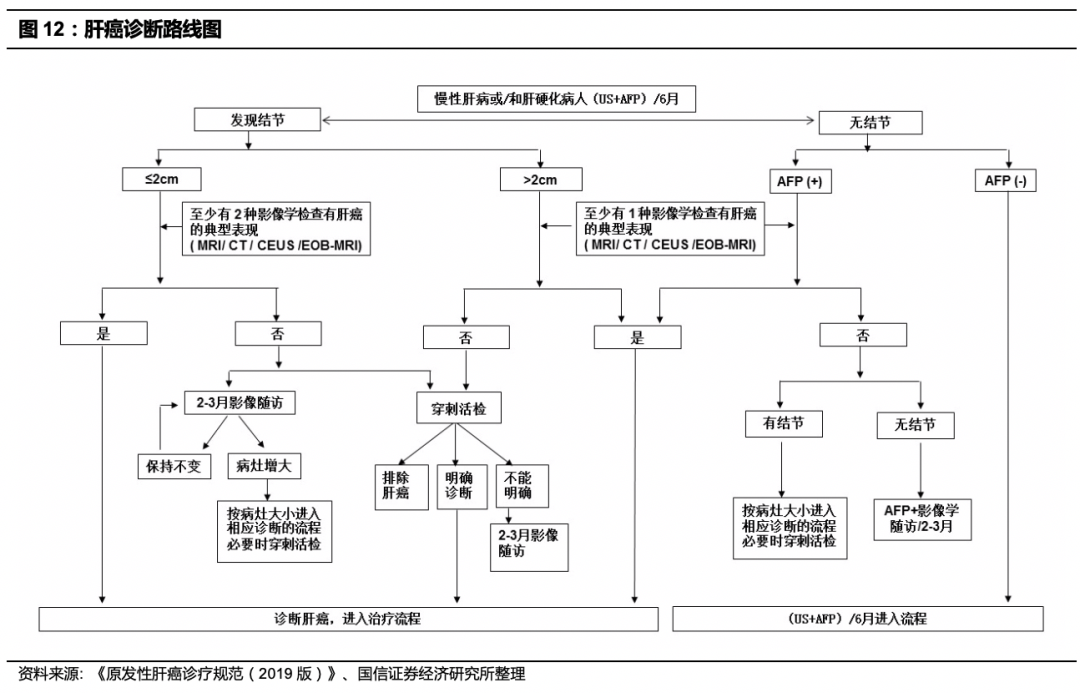
肝癌诊断往往在晚期,诊断路径复杂,目前缺乏有效的早筛手段。
据统计,中国的肝癌患者,以巴塞罗那分期B和C期为主,占到所有肝癌患者的80%以上,早期肝癌的发现率不足30%,C期就到了我们通常说的晚期,而C期患者在我国肝癌患者占到50%以上,因此我国大多数肝癌患者发现时即为晚期。2020年1月6日卫健委印发了《原发性肝癌诊疗规范(2019版)》指出对肝癌高危人群的监测筛查有助于肝癌的早期发现、早期诊断、早期治疗,是提高肝癌疗效的关键。在中国,肝癌高危人群主要包括:具有乙型肝炎病毒(Hepatitis B virus,HBV)和(或)丙型肝炎病毒(Hepatitis C virus,HCV)感染、过度饮酒、非酒精性脂肪性肝炎、长期食用被黄曲霉毒素污染的食物、各种其他原因引起的肝硬化、以及有肝癌家族史等人群,尤其是年龄>40岁的男性风险更大。在肝癌的监测和筛查方面,美国和亚太比中国指南多增加了两类高危人群,AASLD指南将亚裔>50岁的女性HBV携带者也列为高危人群,APASL则认为HBVDNA载量高(>104拷贝/ml)HCC发生率更高,对于高危人群一般是每隔6个月进行一次检查。借助于肝脏超声检查和血清甲胎蛋白(AFP)进行肝癌早期筛查,建议高危人群至少每隔6个月进行1次检查。结合肝癌发生的高危因素、影像学特征以及血清学分子标志物,依据路线图的步骤对肝癌做出临床诊断。
从下图可以看到,肝癌的确诊路径复杂,穿刺活检是肝癌诊断的金标准,影像学检查在某些情况下也是有效的确诊方式。
目前肝癌筛查使用的血清甲胎蛋白AFP或影像学的灵敏度有限。
目前最广泛用于HCC筛查的方法是血清甲胎蛋白(AFP)和超声,但是AFP的敏感度为25%-65%,超声敏感度为60%。血清AFP并不是HCC的敏感或特异性的诊断标志物,比如在非HCC疾病中(如慢性肝病、肝硬化和肝炎)以及肝内胆管癌和转移性结肠癌,AFP水平会升高。此外,有40%的肝癌患者AFP并没有升高。尽管血清AFP水平在预测AFP产生的HCC患者的疾病结局和监测肿瘤进展方面有效,但2018版美国肝病研究协会(AASLD)指南不再建议将AFP检测作为诊断评估的一部分。在这些指南中,建议评估肝结节直径,计算机断层扫描(CT),磁共振成像(MRI)或组织活检来诊断HCC。
ctDNA在肝癌早筛中优于传统的AFP指标。
ctDNA是由肿瘤释放至外周血的特异性突变DNA片段,能够反应肿瘤的基因组信息,可用于早期诊断、监测肿瘤进展及对治疗反应等。有文献表明ctDNA用于肝癌早期诊断的灵敏度和特异度均优于血清AFP,还可反应肝癌术后动态变化。利用特定基因表观遗传修饰特征,如甲基化、5-hmc等也可用于肝癌早期诊断。循环游离miRNA组合对于辅助肝癌早期诊断也具有较高价值。如利用7种血浆miRNA的表达水平建立的肝癌诊断模型不但可以准确地诊断早期肝癌(敏感度可达86.1%,特异度可达76.8%),而且其灵敏度较传统肝癌标志物AFP提高约30%。在AFP无法做出判断的病人中,仍能做出准确的诊断(敏感度可达77.7%,特异度可达84.5%)。
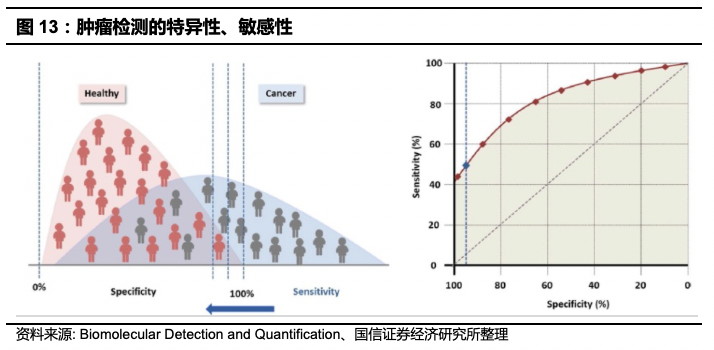
对于无症状个体进行筛查时,cfDNA检测的特异性和敏感性至关重要。
灵敏度表示正确识别的阳性结果在患者组中的比例,而特异性表示正确识别的阴性结果的比例。以特异性和敏感性分别作为横轴、纵轴,可以做出ROC曲线,曲线
下面积(AUC)可以作为衡量检测精准度的指标,理想情况下,AUC值应接近1.0,数值越大,检测越精准。
游离DNA低深度全基因组测序(WGS)能提取到更多广泛存在的分类特征,例如ctDNA片段化模式等。
据S. Cristiano等在2019年Nature发表的文章指出,即使在WGS测序深度0.5X的覆盖率下,也能识别出癌症患者改变的碎片图谱。以1-2倍的覆盖率进行WGS,并且利用机器学习改进算法,可以成功地区分健康人和肿瘤患者,并且判别肿瘤来源,AUC在不同癌种中可以达到0.88-0.99,意味着片段分析可用于检测肿瘤来源的cfDNA并在治疗过程中监测患者。
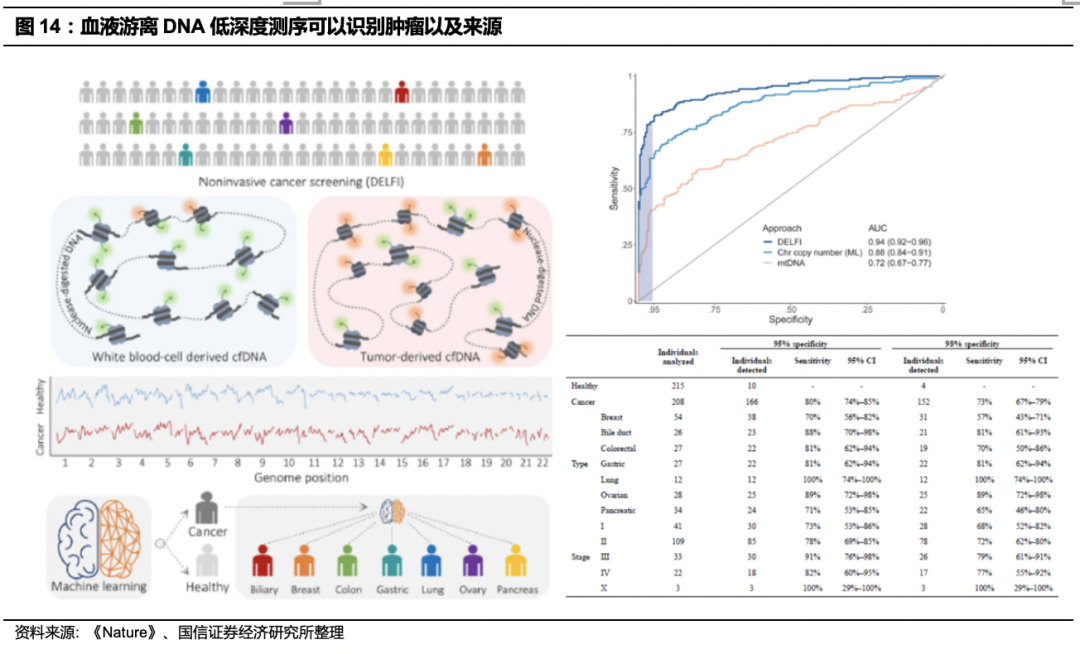
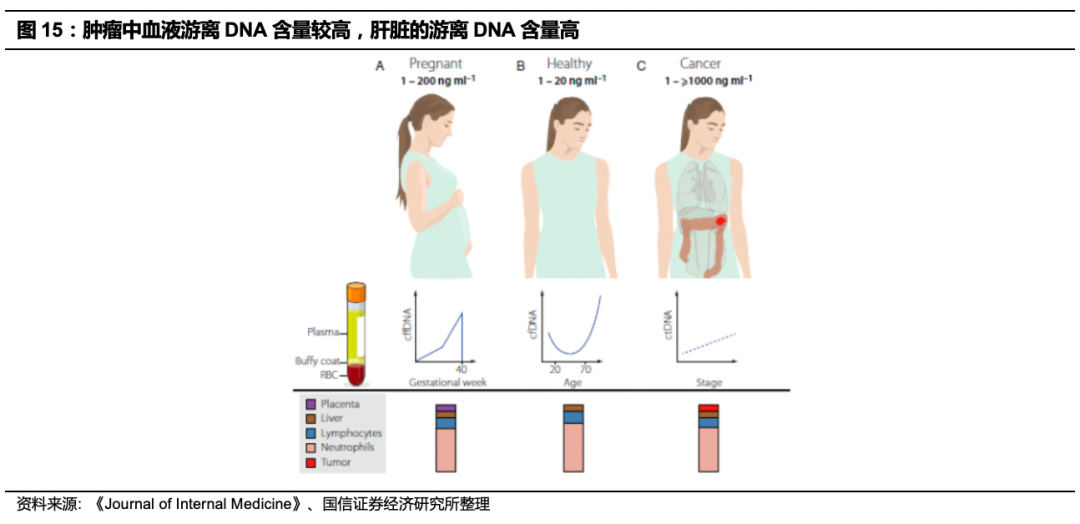
癌症患者与健康人相比,游离DNA含量高、片段短,各组织中肝脏的游离DNA含量较高。
在健康个体中,血浆中cfDNA的60%–90%来自造血细胞,肝脏贡献2%–18%,其余为各种来源。cfDNA在循环中的半衰期约在16分钟至2.5小时,cfDNA通过核酸酶活性,肝脏和脾脏的摄取、随后被巨噬细胞降解清除,通过肾脏排泄。健康个体血液中cfDNA的浓度通常在1~10ng/mL,平均为6 ng每mL血浆,相当于2000个单倍体基因组当量。孕妇可以达到200ng/ml。cfDNA含量水平随着年龄的变化而变化,在年轻人(<20岁)和老年人(> 70岁)中均略高,在男性中比女性平均值略高,并且含量与死亡率正相关。癌症患者的总cfDNA血液水平通常较高,血浆中最高> 1000 ng/mL,平均为180ng/mL,肿瘤来源的cfDNA片段的长度比生理背景的cfDNA要短。
贝瑞基因子公司和瑞基因承接国家“十三五”重大专项子项目PreCar,是全球最大、也是进展最快的肝癌前瞻性队列研究。
Prospective suRveillance for very Early hepatoCellular cARcinoma(PreCar)是由国家肝癌科学中心/上海东方肝胆外科医院王红阳院士、广州南方医院侯金林教授与和瑞基因共同主导、国内近二十家临床中心参与的肝癌早筛前瞻性临床项目,于2018年4月正式启动。该项目基于自主开发的肝癌患者分类模型,公布的阶段性成果在国内外同类研究中均处于领先水平,该项目是中国乃至全球肝癌早筛早诊研究的一个重要事件。
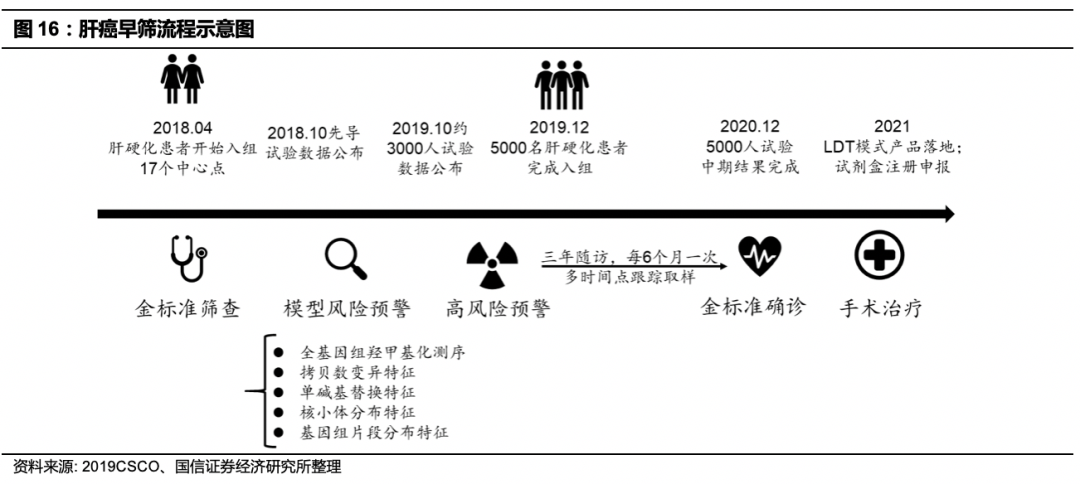
项目计划入组患者1万人,截止2019年底已完成前瞻队列入组约5000例肝硬化患者,部分早期入组的患者已经达到第3个访视点(期间每6个月一次随访)。通过测序,建立整合多种组学、多维度指标构建的分类器,指标包括基因组拷贝数变异特征(CNA)、基因组片段分布特征、核小体分布特征、全基因组羟甲基化测序、单碱基替换特征以及外源基因组整合特征等。分类器性能能优良,回归分析验证其
性能达到AUC=0.992(明显高于传统AFP指标的0.764),敏感性和特异性则分别达到93.10%和96.04%,相比与传统血清标志物和单组学指标优势明显。

在2019年中国临床肿瘤学年会(CSCO)上,PreCar肝癌早筛项目披露结果显示,在前瞻队列经预测为高风险的肝硬化患者群体中,半年内发现癌变的比例是指南推荐筛查方案人群转癌比例的10-14倍,即模型有效地预测了高转癌风险,相较现有诊断金标准提前6~12个月筛查出极早期肝癌患者,经过PreCar模型筛查出的第一批55例肝癌极高危人群,在随后6个月内的随访中,已有8例被确诊为新发早期肿瘤,较完成随访患者的转癌率富集了13倍以上。这部分患者的肿瘤大小都在0.8~2.5cm之间,全部处于肝癌早期(0期+A期),其中约75%处于肝癌极早期(0期),早期筛查可以实现在黄金窗口期的早期治疗干预,因此这些患者的5年生存率有望提升5倍以上。
PreCar模型区分肿瘤/高危患者的能力达到同类研究领先水平,实现了真正意义上的前瞻性早筛,是全球同类项目中的首次突破。
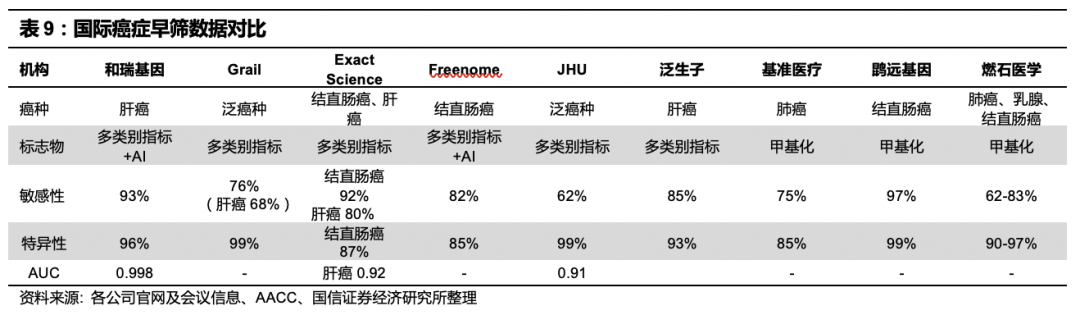
与国际的各类早筛产品数据相比,公司Precar项目规模最大,进度最快,灵敏度、特异性指标领先。
表观修饰与基因表达调控相关,因此具有较强的组织特异性,研究表明表观修饰改变通常发生于肿瘤发展早期阶段,与序列变异相比,表观修饰变化特征性更强,因此国际主流的ctDNA测序技术均关注甲基化(5mC)与羟甲基化修饰(5hmC)两种修饰类型,大部分公司是结合甲基化和多个指标。目前肝癌领域全球有和瑞基因、Exact Science、Grail、泛生子公布部分结果。Exact Science入组443人,敏感性80%;Grail是泛癌种,其中在肝癌中敏感性为68%;泛生子公布的结果中回顾性结果为85%灵敏度、93%特异性。
和瑞基因作为公司肿瘤检测业务的承载,迅速发展。
公司在2017年11月17日公告引入投资,融资8亿,对应70.588%福建和瑞股权,增资款项主要用于肿瘤早诊的研发投入以及其他肿瘤业务的经营性投入。上市公司对和瑞的持股降为19.41%,在保留了第二大股东地位的同时拥有优先回购权,可在第49-51个月或交割日后第61-63个月的期间内进行回购,价格为30%年化收益率或25xPE中较高者。我们认为,肿瘤早筛以及伴随诊断的研发需要巨量资金,融资减轻上市公司研发投入,使和瑞可以在体外孵化,并且在相对成熟时以较低的价格回购入上市公司体内,从时间来看,回购的窗口期可能发生在2022年初或2023年初。截至目前上市公司持股和瑞基因股权为20.956%。
肝癌早筛的空间预测
:百亿级别。据估计,中国有多达700万人(或0.5%)患有肝硬化,肝硬化占内科总住院人数的4.3%-14.2%。每年中国有46万肝癌新发病例。病毒性肝炎包括慢性乙型肝炎(CHB)和慢性丙型肝炎(CHC),影响分别有9000万人和1000万人,肝炎相关仍是肝癌发生的70%,为主要病因。
我们认为公司的肝癌早筛产品将在2020年底-2021年初落地和申报注册。考虑到注册需要时间,我们估计在产品正式获批之前将采用LDT模式以服务形式进入医院。届时,公司已有的临床渠道优势将发挥重要作用。
关于产品定价我们假设初始3000-5000元一次,每年高危人群两次检测,则市场空间在420-700亿。如果考虑后续产品可能涉及肝炎患者的检测,则可及人群迅速扩大。考虑到测序成本在逐年下降,我们认为肝癌早筛产品成熟后,在5年内有望降价至千元以内。拉长来看10年左右时间,价格也许会进一步下降至500元,但同时使用人群扩大到涉及乙肝的9000万人群,则长期市场潜在空间在450亿,如果渗透率达到30%,那么则有135亿左右空间。
公司在肝癌早筛领域领先优势明显,技术壁垒、临床壁垒,和公司商业化产品的能力均将有利于市场份额的绝对领先,因此市场空间测算主要考虑渗透率,市场份额我们认为会在50%以上。具体测算请参考产品管线部分表格。
除此以外,公司在肺癌的早筛领域也启动了先导试验,并将在2020年内启动大规模临床试验。
根据和瑞基因在2019年CSCO会议上披露的信息,当年4月和瑞基因已经与北京大学王俊院士团队联合启动了肺癌早筛的先导实验,计划同样通过基于多组学的技术路线和前瞻验证的模式进行肺癌早期诊断研究。整体研究初步在2~3年内完成。目前先导试验已经完成,预计年内开始大规模临床入组。2019年9月6日,和瑞基因与上海市胸科医院宣布联合成立“上海胸科-和瑞基因精准医学研究中心”,这也是中国首个大规模胸部肿瘤精准医学研究中心,该中心将通过临床信息和基因信息的有效融合,进行胸部肿瘤精准治疗临床研究和前沿科学研究,并以科研带动临床转化和技术产出,最终让更多胸部肿瘤患者获得“度身定制”的精准诊疗服务,2019年底该中心已投入正式运营。上海市胸科医院是中国最早开展胸部肿瘤诊疗的医疗单位之一,年胸部肿瘤手术超过14000例。精准研究中心初步将投入2万例的临床检测资源,重点进行药物临床试验研究的伴随诊断、肿瘤诊断即个体化用药的研究、肿瘤标记物预后的研究、肿瘤易患性评估,以及肿瘤及重大疾病早期预防筛查等五大领域的研究。
肿瘤伴随诊断业务——应用广泛,在研管线丰富
全球每年新增超过1800万癌症病例。
根据Globcan测算,2018年全球有1810万例新癌症病例(不包括非黑素瘤皮肤癌则为1700万例)和960万例癌症死亡(不包括非黑素瘤皮肤癌则为950万例)。在男女两性中,肺癌是最常被诊断
的癌症(占总病例的11.6%)和癌症死亡的主要原因(占癌症总死亡的18.4%)。女性中发病率紧随肺癌之后的还有乳腺癌(11.6%)、前列腺癌(7.1%)和结直肠癌(6.1%)死亡率排第2-4位的是大肠癌(9.2%)、胃癌(8.2%)和肝癌(8.2%)。男性中发病率第2-3位的是前列腺癌和结肠直肠癌,死亡率排第2-3位的是肝癌和胃癌。
基因测序有助于生物标志物的研究,在癌症的诊断和治疗的不同阶段都发挥重要作用。
NGS对肿瘤基因组学、转录组学和表观基因组学的研究正在推动生物标志物的发现,以用于癌症诊断和肿瘤分层。根据FDA,临床生物标志物可用于癌症和其他疾病的诊断、预后、预测和药效学。诊断生物标志物是疾病的特征,可用于确定个人是否患有癌症。预后生物标记物可预测未经治疗的癌症自然发展(即肿瘤分层,侵袭性高或是侵袭性较低的表型),而预测性生物标记物则可预测患者对治疗的反应。药效学生物标志物可指示治疗效果,评估临床试验成功率。
药物伴随诊断市场随着靶向药物发展和癌症发病率增加而迅速增长。
根据Markets and Markets预测,全球伴随诊断市场预计将从2019年的35亿美元增长到到2024年的73亿美元,复合年增长率为15.7%。靶向治疗增加、全球癌症发病率不断提高以及伴随诊断的应用领域不断增加,共同推动全球伴随诊断行业的发展。亚太地区和拉美地区增速极快,主要是这些地区临床试验数量增加。PCR目前占到伴随诊断的主要部分,但是NGS测序既可以检测已知突变,也可以检测未知突变,较传统方法在准确性,灵敏性和速度方面也具有优势,在疾病诊断、监测的领域将发挥巨大作用,是未来的发展趋势。
NGS在临床肿瘤学的市场也随着个性化用药的需求和技术发展而迅速增长
。NGS的发展开启了精确医学时代,在癌症治疗领域,可将肿瘤的分子特征与靶向药物相匹配。根据Grandview Research预测2018年全球临床肿瘤学下一代测序市场规模为6.27亿美元,到2025年预计将达到15亿美元,复合年增长率为13.2%。用于癌症治疗的以基因组为中心的药物使用显著增加、个性化医疗需求的增长以及NGS测序技术发展共同促进NGS技术在临床诊断中的增长。Illumina公司预测基因测序全球总市场容量为200亿美元,肿瘤诊断与治疗应用方向为120亿美元,占比为60%,是基因测序最大的应用市场。麦肯锡预测基因测序技术在肺癌、肠癌、乳腺癌和前列腺癌等领域的渗透率将高于20%。
海外最早于2017年底出现基于二代测序的伴随诊断试剂。
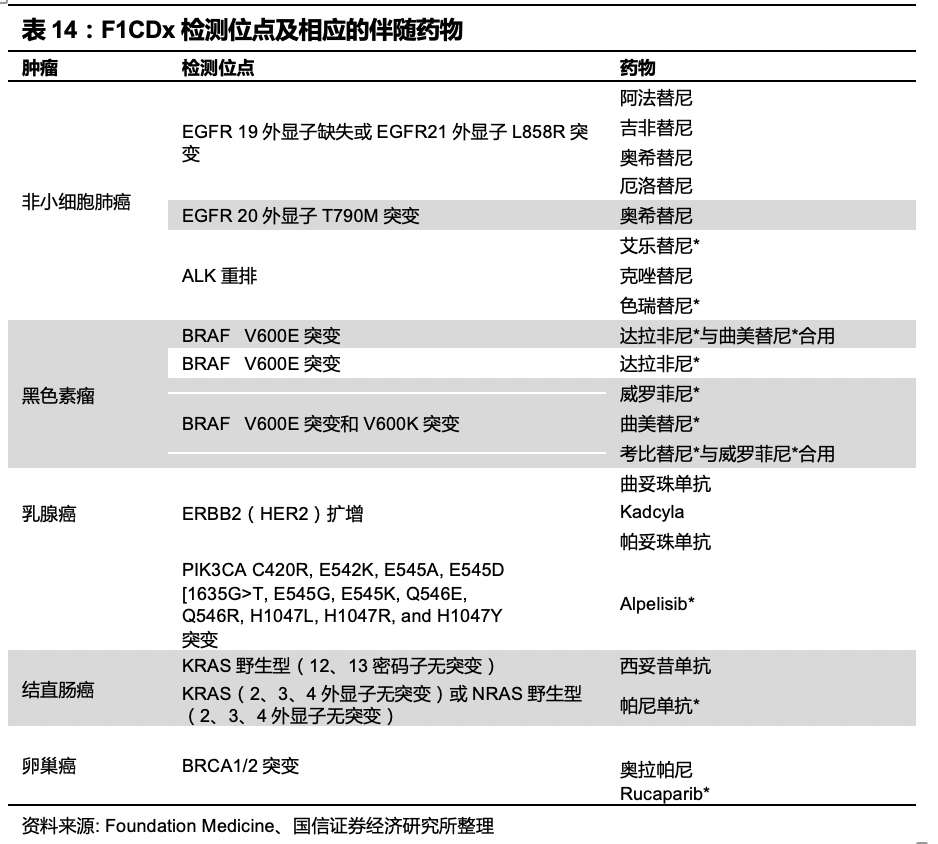
美国FoundationOne CDx于2017年11月30日由FDA批准上市,也是全球第一个基于二代测序的多肿瘤、多位点伴随诊断产品,覆盖了5种肿瘤、涉及17种药物共18种治疗方法。该产品针对324个基因进行检测,所检测的突变类型包括替换、插入、缺失、拷贝数变化、基因重排等突变,以及微卫星不稳定性、肿瘤突变负荷检测。适用的样品类型为福尔马林固定石蜡包埋组织样本(FFPE)。F1CDx是美国FDA第一个通过“突破性产品”分类途径(BreakThrough Designation)审批上市的IVD产品。截至目前,美国FDA共批准5个基于NGS的伴随诊断试剂盒。
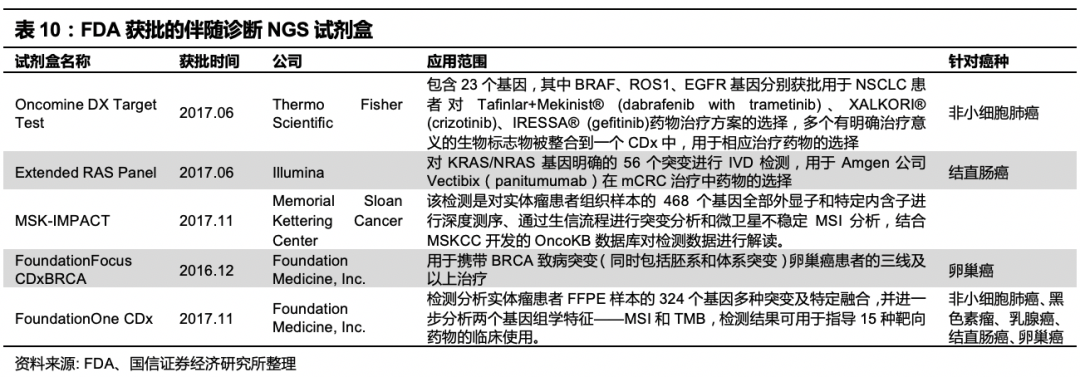
目前中国获批的基于测序原理的肿瘤伴随诊断试剂盒并不多,主要集中在非小细胞肺癌领域,均为小Panel的测序试剂盒。
小Panel指基因检测的数量和位点较少,大Panel则包含上百个位点,覆盖区域较多。还有很多公司以LDT模式开展业务,LDT(Laboratory Developed Test)在美国指实验室内部研发、验证和使用,以诊断为目的的体外诊断实验。LDT仅能在研发的实验室内使用,可使用购买或自制的试剂,但这些试剂不能销售给其他实验室、医院或医生。LDT的开展不需要经过FDA的批准。国内主要方向是肿瘤检测的公司有燃石医学、世和基因、泛生子,吉因加,思路迪等等。目前国内还没有大Panel的测序试剂盒获批,有关申报原则还待进一步明确。2019年10月15日,中国食品药品检定研究院发布了《关于TMB 注册检验用体外诊断试剂国家标准品和参考品说明书》,公布肿瘤突变负荷检测国家参考品(也就是大Panel标准盘)以及四家参研单位,贝瑞和康位列其中(另三家为吉因加、世和基因、华大智造),可以看到公司已经开始积极布局大Panel的申报,谋求率先突破。我们认为,未来随着申报原则清晰、产品注册规范化,市场将迎来爆发。肿瘤伴随诊断领域的NGS试剂盒研发在技术和资金方面都有壁垒,先发企业和龙头企业较有优势。
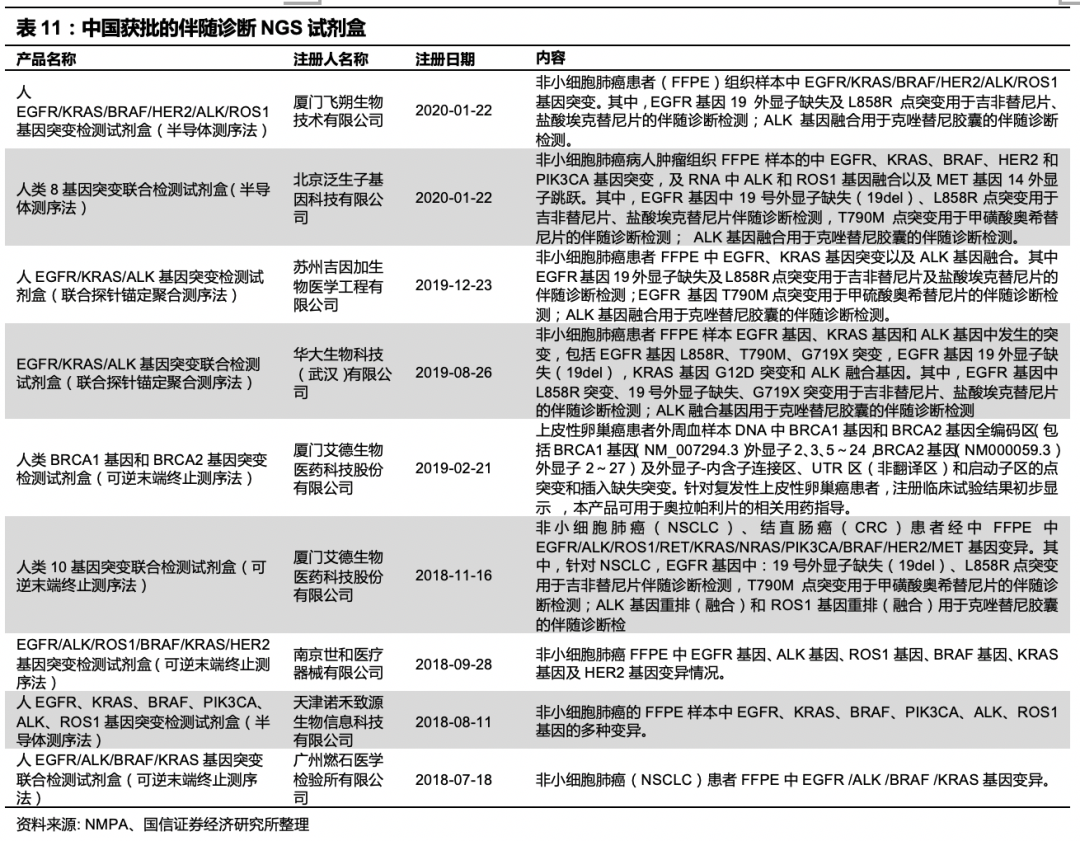
市场预测:
2015年中国恶性肿瘤发病约392.9万人,死亡约233.8万人。假设未来癌症相关基因测序应用的费用在5000元-1万元,每年癌症发病人数400万左右,检测频率每年2次,NGS伴随诊断的市场潜在空间在400~800亿,如果我们假设渗透率根据价格不同在15%-30%,那么市场规模可能在120亿左右。根据目前肿瘤领域测序公司营收情况,我们估计现有市场规模应该不到20亿,后续随着价格下降和渗透率提升,整体市场估计还有6倍左右空间。我们认为,肿瘤基因检测需求强,患者付费意愿较高,目前虽然荧光定量PCR等产品是药物伴随诊断的主流,但是基因测序反映的信息更为全面,未来行业趋势应
该是测序应用崛起,并且测序将从小Panel向到大Panel过渡。
小结:肿瘤检测业务空间巨大,肝癌早筛落地在即
贝瑞基因子公司和瑞基因专注基因测序在肿瘤检测业务中的应用,分为肿瘤早筛和肿瘤伴随诊断两部分。公司的肝癌早筛项目全球规模最大的前瞻性队列研究,预计2020年结题,2021年产品落地,市场潜在空间约500亿,市场销售规模估计超过100亿,公司独家产品具有领先优势,预计峰值销售会在50亿。伴随诊断项目目前国内才刚刚起步,目前以检测位点数较少的试剂盒为主,未来会涌现更多检测位点丰富的测序试剂盒产品,市场潜在空间在400-800亿,市场规模估计百亿,公司作为先发企业也有望获得20%左右市场份额。
Exact Sciences——
推出全球第一个癌症早筛产品
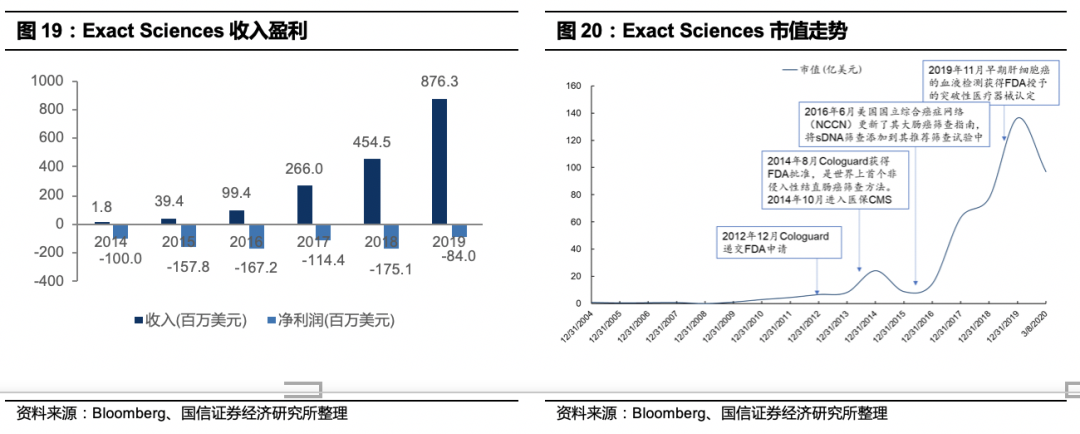
Exact Sciences Corporation (EXAS)精密科学公司1995年成立,是一家专注于非入侵性大肠癌筛检的分子诊断公司,总部位于美国威斯康星州麦迪逊市,2001年登陆纳斯达克。结直肠癌是中常见的恶性肿瘤,早期症状不明显,发病率死亡率较高。传统检测手段有三种:指检、肠镜、粪便潜血检测。该公司开发的Cologuard是一种非侵入性、基于粪便DNA的大肠癌筛检,用于检测癌症前的病变或息肉与大肠癌的四个阶段,准确率高而且无伤害,其检测大肠癌(I-IV期)的总体灵敏度为92%、特异性为87%,在早期阶段(I-II期)检测大肠癌的灵敏度为94%,晚期大肠癌的灵敏度为67%。而常用的FIT(粪便免疫化学测试)灵敏度仅为74%。Cologuard筛查包含一系列DNA靶点检测,包括
KRAS点突变定量分析、异常NDRG4和BMP3基因甲基化分析、内参基因β-actin定量分析,外加血红蛋白酶联免疫反应,总计11种标记物并未完全透露。检测结果通过Logistic回归算法分析,数值183以上判定为阳性结果。检查阳性的人群将进一步使用“金标准”肠镜确认。
2009年公司开始研发基于sDNA的肠癌筛查技术。2011年7月公司开始大规模的临床试验DeeP-C,这是一项前瞻、双盲、横向、多中心的研究,是该公司针对结直肠癌的关键临床试验,在美国和加拿大的90个临床站点共入组12700人。2012年12月完成并递交FDA,2014年8月Cologuard获得FDA批准,是世界上首个、也是唯一一个非侵入性结直肠癌筛查方法。2014年10月美国医疗保险和医疗补助服务中心(Centers for Medicare & Medicaid Services, CMS)在发布了针对Cologuard检测的国家医疗覆盖指标,其中规定符合特定条件的人群每三年做一次检测,费用由医保承担,报销额度为508.87美元/次。2014年11月美国癌症协会(ACS)更新其结直肠癌筛查指南,将Cologuard纳入推荐筛查程序。2016年6月美国国立综合癌症网络(NCCN)更新了其大肠癌筛查指南,将sDNA筛查添加到其推荐筛查试验中。2019年9月FDA将适用人群年龄从50岁以上拓展到45岁以上。截止2019年5月Cologuard已经筛查220万人次。公司预计美国肠癌筛查市场180亿美元。
研发管线涉及肝癌液体活检,并获得FDA突破性器械认证。
2018年6月,由Exact Sciences和梅奥诊所开发的基于血液的DNA测序panel在一项2期临床验证性研究在2018 年消化疾病周会议公布结果,该研究使用全甲基组DNA测序来鉴定HCC标记物,采用了来自独立档案的244个冷冻血浆样品进行评估测定,其中包括95个确认的HCC病例样品,51个肝硬化对照样品和98个没有肝病或癌症病史的对照样品。整体灵敏度达到以95%,在不同阶段的肝癌中灵敏度不同,0期为75%,A期为93%,B期为93%,C期为96%,D期为100%.健康对照组中有95%的特异性,在肝硬化对照组中有86%的特异性,比常用的AFP血清测试更准确。
2019年11月Exact Sciences宣布其早期肝细胞癌(HCC)的血液检测获得FDA授予的突破性医疗器械认定
,该测试通过检测血浆中的4种甲基化DNA标记物和两种蛋白质标记物检测肝癌。具体的试验数据在美国美国肝脏疾病研究协会(AASLD)年会上公布,试验有443名参与者,包括135例HCC病例和308例对照。结果显示Exact Sciences的检测对早期HCC达到71%的敏感度、对所有阶段的HCC达到80%的敏感度,而常规AFP水平测试的结果则分别为45%和62%,肝癌所有阶段六项指标的AUC曲线为0.92 ,而AFP指标为0.8。综合来看,公司的结果优于常用的甲胎蛋白水平检测。公司计划在2020下半年推出产品。
EXAS与辉瑞合作推广产品。
Exact Sciences 2018年10月宣布与药企巨头Pfizer 达成协议,共同推动Cologuard检测产品的推广销售。Cologuard是第一个也是唯一一个FDA批准的用于结直肠癌的非侵入性DNA筛查选项。根据交易条款,辉瑞将向Cologuard提供销售支持,承诺将在未来三年内投入7000万美元用于营销费用。并向Exact Sciences派遣销售代表,从2018年第四季度开始接触医生和医疗系统。Exact Sciences将全权负责Cologuard的制造和实验室运营等其他方面,辉瑞将在合作基础上分享毛利和营销费用。辉瑞公司拥有庞大且经验丰富的销售队伍,与领先的医疗系统关系紧密,并且具备深厚的营销专业知识,这对于Cologuard的推广将有很大帮助,公司的销售收入也在2019年大幅增长。
持续与梅奥合作产品开发。
从成立之初Exact Sciences就与梅奥诊所开始合作。1998年Exact Sciences与梅奥诊所合作对PreGen进行了三项临床研究。2001年10月梅奥诊所启动了PreGen-Plus的临床研究,该研究旨在比较PreGen-Plus与FOBT的结果,后来由于缺乏大规模临床试验,被FDA拒绝上市。此后Exact Sciences与梅奥诊所开始重新研发新的基于sDNA的肠癌筛查技术。2009年6月11日,Exact Sciences有梅奥医学教育与研究基金会签订了专利授权协议,主要针对粪便或血液为基础的癌症诊断和筛查领域。
收购加强液体活检领域布局。
2018年10月收购了Biomatrica,是一家位于加利福尼亚州圣地亚哥的血液、唾液样本预备技术制品供应商。2019年11月以28亿美元完成对癌症检测公司Genomic Health的收购,并加快癌症诊断产品的开发推出。后者主要产品是乳腺癌和前列腺癌检测,其Oncotype DX平台利用RT-PCR对乳腺癌的病理标本进行检测,分析其中相关基因和参考基因21个,利用公式进行计算出一个复发指数(RS),再判断采用何种治疗方法受益最大。2020年3月初,收购了两家癌症诊断公司Paradigm Diagnostics和Viomics。Paradigm为患有晚期、难治性或复发性癌症的患者提供了全面的基因组分析测试,以便医生有效地推荐靶向治疗或临床试验,已获得当地Medicare承保范围。Viomics主要通过测序识别实体组织和血液中存在癌症的独特生物标志物,此前有肺癌相关数据。
盈利及估值情况
:公司2019财年全年续亏8399.3万美元,亏损缩减;营业收入8.76亿美元,同比增长92.82%。毛利率75.27%,研发投入9.7亿美元。公司股价从2012年试验进展顺利,还未递交FDA申请起开始启动上涨,在产品获批后迅速上涨,2016年年报公布收入大幅增长后2017年股价大幅上涨,后一路走高,截止2019/12/31,公司市值137亿美元,PS PS(TTM)=16.6;近期美股大跌后,2020/03/18,市值56亿美元,PS(TTM)=6.4。
Guardant Health
——专注液体活检领域
Guardant Health成立于2011年,总部位于美国加州,是全球第一家将全面的基因组液体活检商业化的公司。公司通过对血液测试来追踪、检测癌症的种类、分期和进展,致力于用基因组测序方式对患者进行诊断,找出病因并确定最佳治疗方案。Guardant Health, Inc. (GH) 2018年10月5日登陆纳斯达克。
公司液体活检总共有晚期癌症检测、高风险人群早期癌症筛检、复发患者检测三部分业务。
目前有四个产品(GUARDANT 360、GUARDANT OMNI、LUNAR-1、LUNAR-2)。Guardant360作为公司主要收入来源,2014年上市,以LDT模式销售,可检测73个基因,主要针对晚期癌症检测,辅助医生选择最佳靶向治疗方案。2018年获FDA快速通道,待批准。其他三种产品主要是针对肿瘤早期筛查、复发患者检测,目前仅用于实验室研究以及制药公司的药物开发,尚未商业化。

Guardant360在部分当地医保中覆盖,2020年2月3日起,扩大医疗保险覆盖范围至12种实体瘤类型。
此前该检测已覆盖晚期非小细胞肺癌,扩大后使得Guardant360成为目前首个也是唯一一个覆盖大多数晚期实体瘤的液体活检产品,可帮助更多晚期癌症患者获得更广泛的基因组信息。估计如果后续获得FDA的批准,则可能会支持保险覆盖范围和费用的进一步提高,如能进入CMS,则潜在覆盖范围在美国超过1.7亿人。2019年公司向临床客户销售49926项测试,较上一年增长70.75%,向药企销售20643份测试产品,较上一年增长99%。公司预测晚期癌症液体活检检测在全美约有60亿美元市场,癌症复发检测市场约150亿美元,癌症早筛市场约180亿美元。
“Guardant 1 Million”计划,利用大数据推动癌症早筛。
公司计划在未来5年内对100多万癌症患者进行肿瘤DNA测序。公司重视癌症早筛这一新业务,借助测序数据推动癌症治疗的进步,加速基于血液检测的癌症早筛早检产业的发展。
公司高管均技术创业背景出身,曾就职于Illumina。
公司CEO Helmy曾就职于Illumina,是技术研究部的高级主任。为斯坦福大学的电气工程学博士曾,2007年创立Avantome公司,将半导体测序商业化,该公司2008年被Illumina收购。公司总裁AMIRALI同样曾就职于Illumina,担任诊断研究高级主任,主导了下一代测序技术的临床应用。在加入Illumina之前,他创立了Auriphex Biosciences专注于循环肿瘤细胞的纯化和遗传分析技术研发,该技术在2009被Illumina收购。
与药企巨头广泛合作。
基于液体活检技术,Guardant已经与40多个生物制药类客户建立了关系,包括阿斯利康、默沙东、辉瑞和BMS等。主要合作方向包括共同进行液体活检类的伴随诊断产品的研发、加速药物研发。
(1)研发液体活检类伴随诊断产品:2017年年末与默沙东达成合作,默沙东的肺癌靶向药物C-MET抑制剂Tepotinib,主要用于治疗MET基因14号外显子跳跃的患者。在临床试验中,默沙东利用Guardant360来筛选可能受益的患者。Guardant360在未来可能获批成为这些药物的伴随诊断产品。
(2) 加速药物研发:2017年初,辉瑞与Guardant合作,基于液体活检技术,
对临床试验中的患者进行ctDNA基因检测,动态跟踪癌症的进展,帮助药企加速临床试验的进度、深入了解耐药机制、加速靶向药物的研发。
布局海外市场
。Guardant与SoftBank宣布建立合资企业,推动在亚洲、中东和非洲等地区的商业化检测。
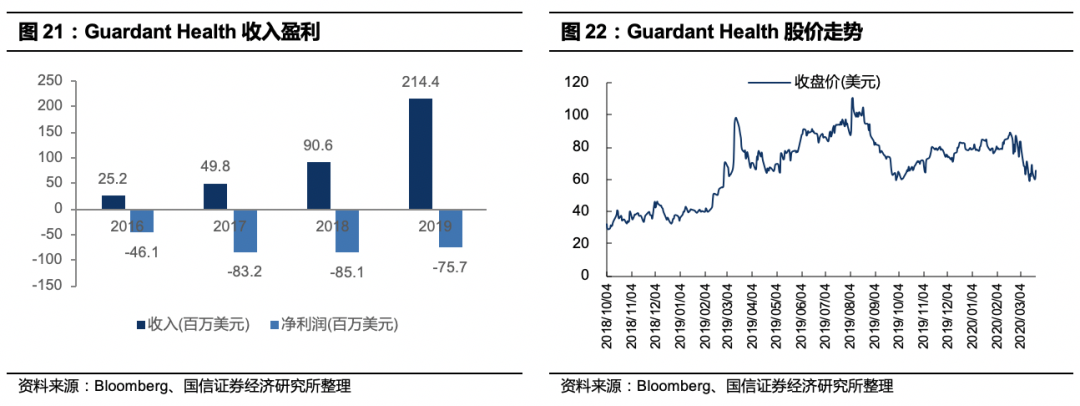
盈利及估值情况
:Guardant Health 2019财年全年续亏7565.1万美元,亏损缩减;营业收入2.14亿美元,同比增长136.52%。毛利率67.01%,研发投入6.0亿美元。公司股价从2012年试验进展顺利,还未递交FDA申请起开始启动上涨,在产品获批后迅速上涨,2016年年报公布收入大幅增长后2017年股价大幅上涨,后一路走高,截止2019/12/31,公司市值74亿美元,PS(TTM)=39.8;近期美股大跌后,市值59亿美元(2020/03/18),PS(TTM)=27.3。
Foundation Medicine:NGS癌症伴随诊断标杆
Foundation Medicine(FMI)成立于2000年,是基因检测服务领军企业,因曾为乔布斯进行检测而知名,2013年登陆纳斯达克。2018年2018年6月,瑞士制药巨头罗氏宣布以24亿美元收购FMI其余全部在外流通股份,即FMI估值达到53亿美元,之后公司退市。现有超过35万患者选用FMI产品,拥有超过30家生物医药公司合作伙伴,已发表的学术文章达到300篇。

FMI推出全球首个获批上市的基于二代测序的伴随诊断产品。
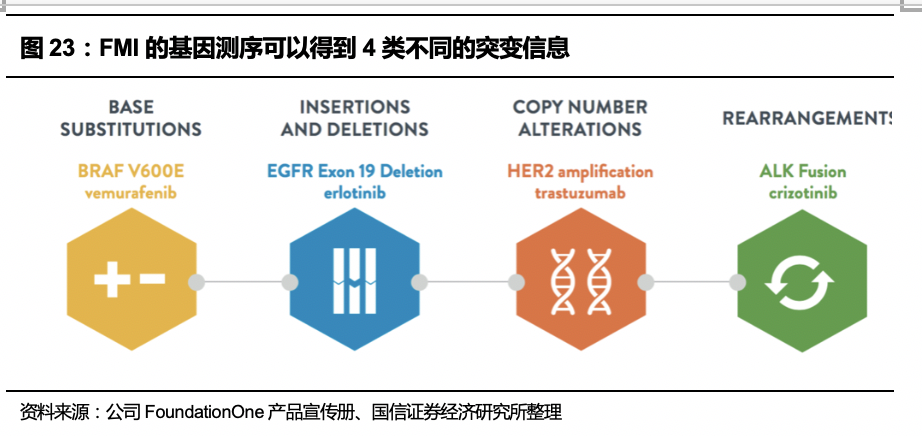
2012年首个全基因组分析产品FoundationOne®正式发布,2017年11月30日FDA和CMS同时批准Foundation Medicine旗下产品--FoundationOne CDx(F1CDx)用于泛癌症临床伴随诊断,这是首款突破性的基于NGS的体外诊断产品,能对任何实体肿瘤进行诊断,在体外诊断领域具有里程碑式的意义。该产品基于NGS技术,可覆盖324个肿瘤相关基因的替换、插入、缺失、拷贝数变化、基因重排等突变以及MSI (微卫星不稳定性)和TMB(肿瘤突变负荷)两大基因组特征,总体准确率可达94.6%。覆盖了5种肿瘤、涉及21种药物共20种治疗方法。
公司三个产品,主要为肿瘤伴随诊断和液体活检
。公司研发分为分子信息平台、免疫疗法检测平台、ctDNA平台、伴随诊断平台4个方向,现有产品包括FoundationOne®CDx——检测全部实体瘤(除肉瘤);FoundationOne®Heme——检测血液恶性肿瘤和肉瘤,包括但不限于白血病、骨髓增生异常综合征、骨髓增生性肿瘤、淋巴瘤、多发性骨髓瘤、尤文氏肉瘤和平滑肌肉瘤。检测血液恶性肿瘤, 肉瘤,检测406个基因的DNA测序和265个基因的RNA测序;FoundationOne®Liquid——所有实体肿瘤(液体活检),2018年8月推出,2019年12月向FDA申报。FoundationOne®CDx最初定价5800美元,目前价格为3500美元。
产品获得大型医保覆盖具有里程碑意义。
2015年,公司公告与美国最大私立保险公司UnitedHealthcare达成协议,UnitedHealthcare将覆盖其主力产品FondationOne在IV期转移性非小细胞肺癌患者的应用。2018年,CMS将FondationOne CDX纳入医保覆盖认定,涵盖所有合适的实体肿瘤患者。
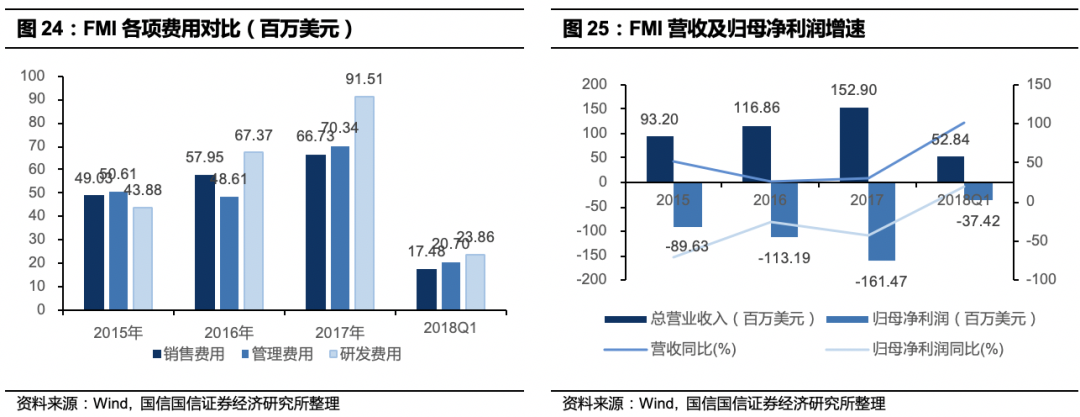
营收大幅增加,但尚未实现盈利。
2017年,FMI为大约6.7万患者提供了基因检测服务,比2016年增加54%,癌症患者筛查和与制药商合作开发新药的收入增加,导致2017年全年销售额为1.53亿美元,比2016年增长31%。2017年的强势表现已经延续到2018年,2018年第一季度临床测试量达到近22000次,同比增长57%,因此,2018年第一季度收入5280万美元,增长101%。但净利润并仍为负,2018年第一季度临床测试量达到近22000次,由于公司尚不是Medicaid项目提供商,未确认收入大幅增加,由于持续教育医生导致的销售费用上升以及主流保险公司此前并未大规模覆盖该产品,公司未实现盈利。
通过合作迪安诊断和罗氏,FoundationOne进入中国内陆。
2018年4月26日,迪安诊断与罗氏及Foudation Medicine(FMI)分别签订了独家战略合作协议,将携手助推中国肿瘤个体化诊断进程。根据相关协议,迪安诊断将成为FMI肿瘤全面基因组测序分析服务在中国临床市场的独家合作伙伴,推出先进的全面基因组测序服务产品,建立迪安肿瘤精准诊断实验室,构建标准化的全流程质量管理体系,在中国内陆实现FMI旗下FoundationOne®、FoundationOne®Heme和FoundationACT®产品的应用,为患者寻找适合的治疗方案。罗氏将与迪安共同推动上述产品在中国临床市场的商业化进程。 2018年8月,中国大陆首张FoundationOneCDx(F1CDx)检测报告签发,目前价格仍然昂贵,约在3万左右。
Grail
——背靠Illumina的液体活检公司
公司历史:Illumina系的液体活检公司。2016年1月,Illumina、比尔.盖茨、杰夫.贝索斯等联合投资1亿美元成立Grail,将开发通过血液中的循环核酸进行全范围癌症筛查的检测方法。Grail意为圣杯,最初获得Illumina强大的资金和团队支持,Illumina CEO Jay Flatley亲自担任Grail的董事长,谷歌高级副总裁Jeff Huber出任CEO。2017年3月,获得由ARCH Venture Partners和Johnson & Johnson Innovation联合领投的超过9亿美金的B轮融资,除此之外,Amazon, BMS, Celgene, McKesson Ventures, Merck,Tencent以及Varian Medical Systems跟投,金额除了用于当时已经开展的CCGA计划之外,还将作为Grail从Illumina独立后的资金储备,Illumina随后将自己手中剩余的Grail股份以2.78亿美元售出,Grail正式从Illumina脱离。2017年6月,Grail宣布与Cirina公司合并,将专注早期癌症测试及诊断产品的开发,Cirina在2014年由香港中文大学的卢煜明、赵慧君、陈君赐以及主要投资者德诚资本共同创建,总部位于香港,研究团队则分布于香港和加州南旧金山。合并后卢煜明将被任命为科学联合创始人,并将加入Grail的科学咨询委员会。德诚资本的创始合伙人兼董事总经理崔相民(Min Cui)将作为观察员加入Grail的董事会。Cirina行政总裁Maneesh Jain也将会加入Grail团队。
公司研发目前有四个研究计划包括泛癌种检测、乳腺癌、肺癌等早筛。
1)
2016年底,GRAIL启动“循环游离基因组图谱”计划(CCGA计划)
,通过对病人和健康人群的游离DNA进行提取、测序,比较二者之间的差异,为早期诊断提供帮助。这项研究是一项前瞻、观察性的纵向研究,旨在表征患有或患有癌症的人血液中的基因组癌症信号的情况。该研究已在美国和加拿大的142个地点招募了大约15000名参与者,既包括10500名癌症患者(新诊断出并且尚未接受治疗),也包括4500名没有已知癌症诊断的人,计划随访时间至少为五年。
2018年4月,GRAIL在美国癌症研究协会年度会议上公布了CCGA计划的最新进展。CCGA计划完成了一期研究工作,对象包括878名确诊癌症但还没开始治疗的患者和580名尚未发现癌症的志愿者。在常规早筛比较普遍的癌症类型中,三种测序模型对早期癌症的检测评分基本都超过了60%,晚期癌症则超过了80%;在没有常规筛查的部位(肺、卵巢、肝脏、胰腺、食管),检测评分同样可以达到上述水平。
2019年5月13日,其多癌种早期检测产品已被美国FDA批准为突破性设备(Breakthrough Devices)。美国FDA突破性设备认证通常授予那些为癌症等危及人类生命的疾病提供更有效诊断的产品设备,以通过加快医疗器械的开发、评估和评审,使其获得授权,为病人和医疗健康服务提供方提供及时的服务。
2019年9月27日欧洲肿瘤内科学会(ESMO)年会上Grail公布基于cfDNA的靶向甲基化液体活检分析方法在癌症早筛领域的最新研究数据,试验检测超过3580个血液样本,以99.4%的特异性发现癌症的存在。针对包含20多种癌症类型的总患者群,灵敏度达到54.7%。针对预先指定的14种癌症类型(包括HR阴性乳腺癌、结直肠癌、胃癌、头颈癌、肺癌、肝癌、多发性骨髓瘤、卵巢癌、淋巴瘤、胰腺癌等),检测的敏感度则达到75.8%。研究人员对3583份血液样本的cfDNA进行了分析,包括1530例被诊断患有癌症患者的样本和2053例无癌志愿者的样本。其中癌症患者的血液
样本涵盖了20余种不同癌症类型,包括HR阴性乳腺癌、结直肠癌、食管癌、胆囊癌、胃癌、头颈癌、肺癌、淋巴白血病、多发性骨髓瘤、卵巢癌和胰腺癌等。研究结果显示,该方法的总体特异性为99.4%;总体灵敏度为54.7%(95% CI: 52.2%-57.2%)。对于预先指定的高死亡率类型癌症(约占美国癌症死亡63%的14种癌症),该方法的灵敏度为75.8%(72.9%-78.5%);I期癌症患者的灵敏度为32%,II期患者为76%,III期患者为85%,IV期患者为93%。此外,该方法还能在97%的样本中精确定位肿瘤的器官或组织来源,89%的返还结果被证明为正确溯源结果。
2)
2017年4月GRAIL宣布了STRIVE研究计划
,对拍摄乳房X光片的12万名女性进行血样收集、检测,并建立一套检测乳腺癌的血液检测方案。除此之外,这项研究还将用于建立一套全范围癌症检测方案,在早期筛查多种癌症。2017年4月,GRAIL启动了名为STRIVE大型临床试验,开发乳腺癌早筛产品。在梅奥诊所与Sutter Health的协助下,该临床试验计划招募12万名18岁以上的女性,当这些女性接受筛查性乳房X光造影术的28天内,收集血样并高深度测序来分析血液中的cfDNA,随访时间五年。如果后续不幸确诊癌症,会进一步收集她们的组织样本。这些信息将被用于训练一款人工智能,并验证它在早期诊断乳腺癌上的可行性。
3)
2018年12月,GRAIL公司宣布与伦敦大学等机构合作,在2019年初启动SUMMIT计划
。该计划是一项具备前瞻性、观察性的纵向队列研究,将招募5万名50岁~77岁的无癌男性和女性入组,其中一半人因吸烟史而有患肺癌的风险。SUMMIT研究的参与者将在入组时提供血液样本,然后每年提供一次,连续三年。同时参与者也会进行LDTC筛查,与液体活检结果进行比较,以支持GRAIL癌症早筛技术的开发。据GRAIL方面介绍,该研究所有基因数据将全部用于GRAIL多癌症cfDNA检测技术的研发。
4) 2020年2月启动PATHFINDER研究,是一项前瞻性、多中心研究,针对多种癌症早期筛查,将招募大约6200名参与者,追踪12个月。














