
据估计,在目前世界范围内有5000-8000种罕见病,虽然每种罕见病只有几百人或几千人患病,但在美国与欧盟得罕见病的人总数加起来至少也有5500万人。在美国,有3300万人遭受7000多种罕见病的折磨,在欧洲,大约有6%-8%的人患有罕见病,如果把所有罕见病归为一类的话,则在现实中患有罕见病的人不再“罕见”。但是,在法律出台之前,制药公司并不重视孤儿药的开发,就是因为它无利可图。面对这样的一种尴尬的局面,美国于1983年开始立法,并通过了世界上第一部《孤儿药法案》(ODA)。
依据该法案,美国国会为孤儿药研发提供了政策激励,主要包括:(1)孤儿药上市后,在7年内享有独占权,FDA不批准其他新药上市(NDA);(2)具有临床试验的优先权;(3)向孤儿药公司提供开发补助及研究基金;(4)为孤儿药的新药申请提供快速审批通道;(5)FDA可以协助公司完成孤儿药的临床试验;(6)孤儿药的新药申请费用给予免除。欧盟、日本、澳大利亚、新加坡、韩国等地也相继颁布了孤儿药法。这些法案的出现,极大地推动了孤儿药的研发和上市。
孤儿药涉及的患病人群虽少, 但却因竞争少、政策利好等原因而往往业绩不俗,研发企业获得了巨额利润。目前制药公司由于新药的研发难度加大,药物专利到期,仿制药众多的影响,利润在逐步下降,同时药监部门对药物申请要求越来越严格,新药研发成本上升,罕见病药物领域不失为大型制药公司新的选择。在2016年,孤儿药的发展状况一片大好,FDA批准的孤儿药增长率为6%,欧盟孤儿药增长率为9%,日本孤儿药增长率为15%。全球孤儿药自2003年起便发展迅猛。
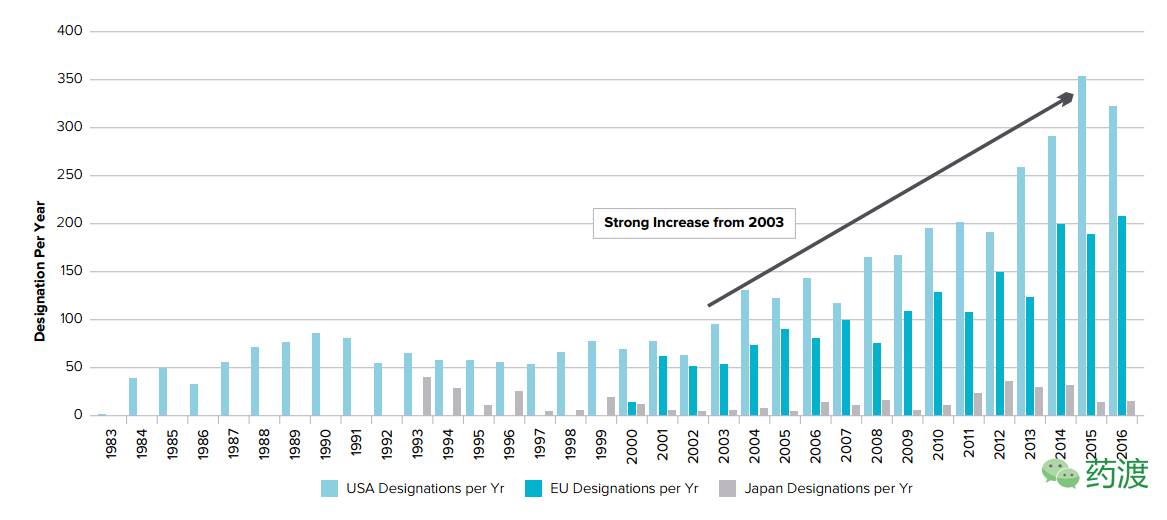
美国、欧盟、日本三国的孤儿药发展情况
随着孤儿药适应症的不断增加,出现的重磅炸弹药物也越来越多。排名第一的孤儿药来那度胺(Revlimid)2016年全球销售额超过70亿美元,在美国的销售额也超过40亿美元,成为全球最畅销的孤儿药。
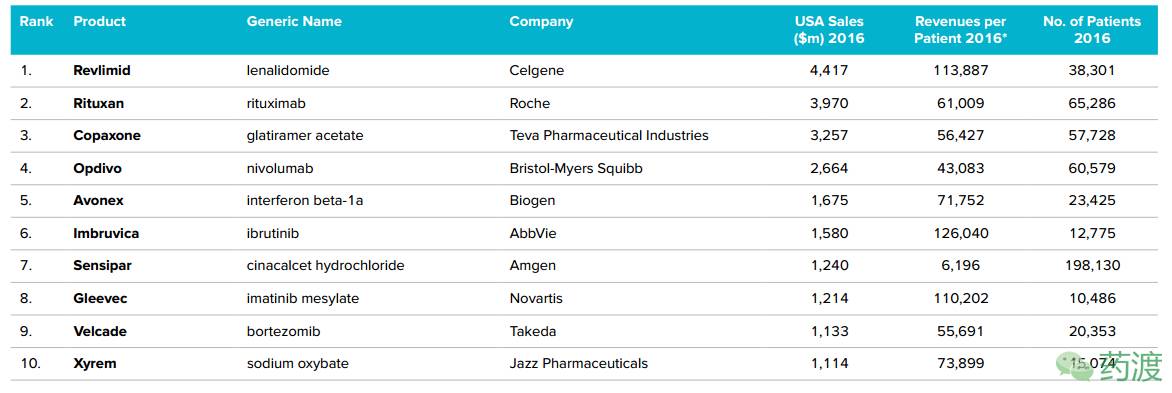 2016年美国孤儿药销售TOP10
2016年美国孤儿药销售TOP10
孤儿药市场前景广阔,2016年,孤儿药的销售额为1140亿美元,比2015年增加12.2%。未来五年,孤儿药的销售总额将达到2090亿美元,复合年均增长率为11% (2017-2022年),是处方药市场增长率的2倍。到2022年,孤儿药将占全球药物销售额的21.4%。
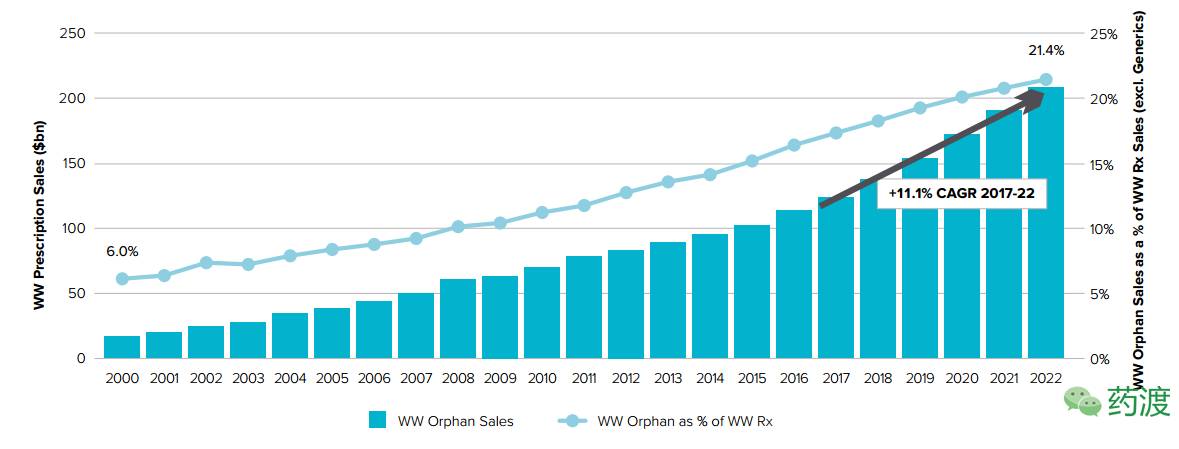
全球孤儿药销售额及其增长率(2000-2022年)
预计到2022年,Celgene公司将会孤儿药销售榜的排名位列第一,成为世界头号孤儿药厂商,而百时美施贵宝(BMS)公司和Novartis依次位列第二和第三。Abbvie和强生公司的排名会继续前进。排名前4位的孤儿药厂商其销售额彼此差距在4亿美元之内,且其中3家公司的销售业绩主要依赖于一种产品,即Celgene公司(产品Revlimid)、百时美施贵宝公司(产品Opdivo)和罗氏公司(产品Rituxan)。其中,Revlimid占Celgene公司销售额的80%,Opdivo占BMS公司的68%。到2022年,前10强孤儿药厂商中有7家有望成为全球孤儿药企业巨头,前5强孤儿药厂商将占有孤儿药市场近1/3 (30.6%)的份额。
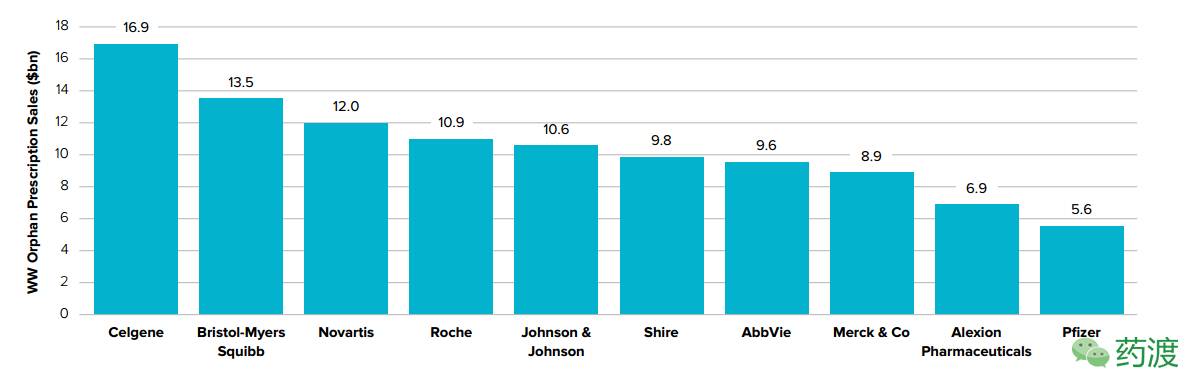
未来五年孤儿药公司TOP10
据预测,在2022年,Revlimid仍是全球最畅销的孤儿药,它于2005年12月被FDA批准用于罕见病骨髓增生异常综合征(myelodysplastic syndrome)的治疗,随后又被批准用于罕见病适应证—— 非霍奇金淋巴瘤(Non-Hodgkin lymphoma)和多发性骨髓瘤(multiple myeloma),而且目前其还在被开发用于其他若干罕见病适应证。相比于2016年,Revlimid的复合年均增长率为12%,销售额达到135亿美元。百时美施贵宝公司的Opdivo以销售额91亿美元位列第二位,它的年增长率为16%,在销售药物的前十中,以强生公司的Darzalex、Imbruvica以及Merck公司的Keytruda的增长势头最为强劲,销售额由2016年的5.7亿、6.3亿、14亿美元增长到58亿、34亿和79亿美元,复合年均增长率依次为47%、32%和33%,在销售前十产品中,只有Roche公司的Rituxan表现不佳,将出现负增长情况。
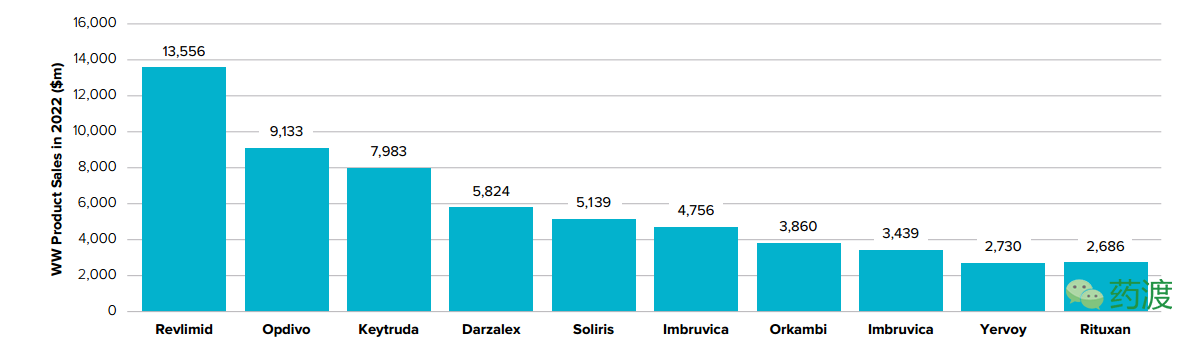
未来5年孤儿药销售TOP10
自美国颁布了《孤儿药法案》和《Hatch-Waxman法案》,短短30年,孤儿药井喷而发,上市的药物就有上百个。同时,法律的保障加速了中小型生物技术企业在孤儿药研发领域的创新和投入,在政府引导和科技发展的双重作用下,美国生物制品中孤儿药的研发占有绝对的比例。对于中国来说,我国罕见病患者数量众多,患者对孤儿药需求巨大, 并且孤儿药低投入、高回报、开发周期短,拥有巨大的市场空间。但由于我国尚未出台相关政策法规,为提高我国药物创新水平,仍要付出诸多努力。
参考数据及文献:
1. http://www.evaluate.com
2. 欧美孤儿药研发激励政策及对我国的启示
3. Orphan drugs and orphan drug legislation
声明:
本文由药渡头条投稿作者撰写,观点仅代表作者本人,不代表药渡头条立场,欢迎交流补充。联系方式:010-82826195 转8048
如需转载,请务必注明文章作者和来源
投稿详情请点击“3月-4月 | 王牌写手获奖名单”

















