作者 | 悟行
编辑 | 小卒子
肿瘤(实体瘤)并不是由单一的肿瘤细胞构成,其内除了肿瘤细胞之外还有大量的非肿瘤细胞,包括免疫细胞、成纤维细胞、内皮细胞和新生血管等,它们与肿瘤细胞之间的相互作用构成了复杂的肿瘤微环境,对肿瘤的发展至关重要,肿瘤微环境的异质性对肿瘤治疗的疗效和预后有巨大影响。
肿瘤微环境也存在一个争议:是肿瘤造就了肿瘤微环境,还是先有肿瘤微环境才使肿瘤得以生存?当受到肥胖、炎症和吸烟等因素影响,微环境发生改变时,正常生长的环境会变为增加肿瘤风险和促进肿瘤的环境,有利于肿瘤细胞的存活和增殖,促使肿瘤发生。而肿瘤细胞又会通过释放一些细胞因子,将一些抗肿瘤的免疫细胞改变为促进肿瘤生长的细胞,或将基质变得更适宜肿瘤定植和生长。肿瘤与其微环境之间相互影响、互相促进,因此在研发肿瘤治疗方式的同时必须考虑到肿瘤微环境对治疗的影响,或是采用靶向肿瘤微环境的治疗方式。
肿瘤微环境中有多种非肿瘤细胞,包括免疫细胞、成纤维细胞、周细胞、脂肪细胞、血管等(图1)。并且每种组织中的肿瘤微环境都不同,如脑中有星形细胞(astrocytes),神经和小神经胶质细胞,乳腺癌中有脂肪细胞。
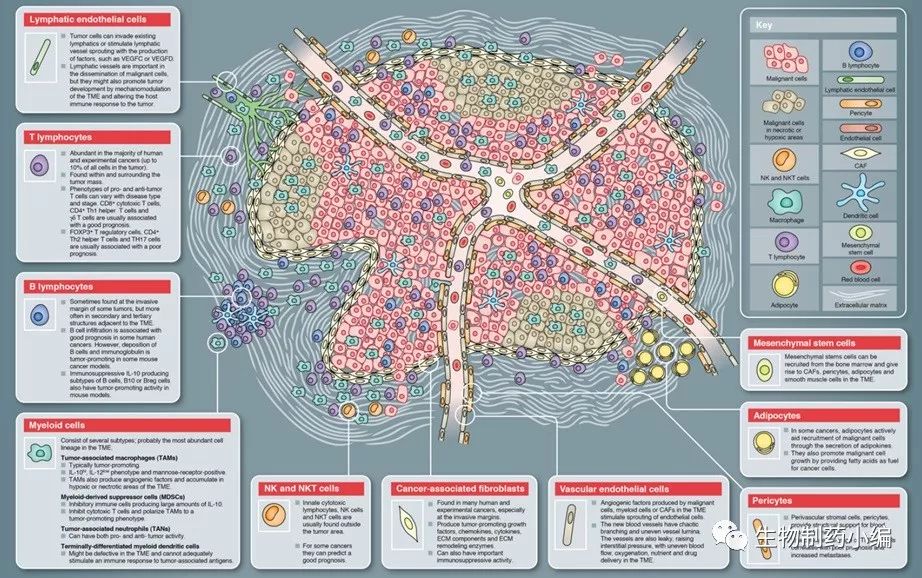
▲ 图1 肿瘤微环境模型(Balkwill, F.R. et al. J cell Sci,2012)
1. 淋巴细胞
淋巴细胞是免疫系统的重要组成部分,T淋巴细胞在肿瘤免疫中的作用尤为重要。
T细胞中CD8
+
记忆T细胞(CD8
+
CD45RO
+
)是抗肿瘤的主力。CD4
+
T helper 1(TH1)细胞对CD8
+
T细胞有支持作用。而其他CD4
+
T细胞,如TH2、TH17则在大多数情况下促进肿瘤生长。Treg细胞(FOXP3
+
,CD25
+
)能被IL-10,CTLA-4和TGF-β诱导,抑制效应T细胞的功能,促进肿瘤的生长。GITR是最近研究较多的一个免疫检查点,越来越多的研究表明,GITR也是Treg的标志之一,只要表达GITR的CD4
+
T细胞都能行使Treg细胞的免疫抑制功能,并且将这些细胞清除即能促进免疫反应,而不会影响效应T细胞的功能[1,2]。
B细胞在肿瘤微环境中的作用还存在争议。在乳腺癌和卵巢癌中,微环境中的B细胞预示着良好的预后。但在很多小鼠肿瘤模型中,B细胞却能抑制免疫反应,促进肿瘤的进展。
2. 巨噬细胞
巨噬细胞能吞噬病原体、细胞碎片和靶细胞。正常情况下,激活的M1巨噬细胞是促进炎症和抗肿瘤的,它们会分泌TH1细胞因子。而M2巨噬细胞可以被选择性的激活,分泌TH2细胞因子,抑制炎症并促进肿瘤。肿瘤微环境中的肿瘤相关的巨噬细胞(TAM)通常是M2型的,高表达IL-10,低表达IL-12,能够促进血管生成和肿瘤侵袭。肿瘤中的缺氧环境是M1巨噬细胞向M2巨噬细胞转换的可能原因,TAM常聚集在肿瘤中的缺氧区域和坏死区域,缺氧环境诱导的VEGF、endothelins和EMAP2等因子会吸引TAM。
促肿瘤的巨噬细胞对肿瘤血管生成有重要作用,其转录组中有多种促血管生成的因子高表达基因。
3. NK细胞
NK细胞是先天免疫中重要的细胞,通常占外周血淋巴细胞的10-15%。NK细胞不与肿瘤细胞直接接触,而是通过释放颗粒酶和穿孔素杀伤肿瘤细胞。NK细胞表面的CD16是抗体Fc段的受体,可以介导ADCC活性杀伤靶细胞。NK细胞在多种数肿瘤中代表好的预后,但很多情况下会被肿瘤细胞释放的TGF-β抑制而失去杀伤活性[3]。
4. 树突状细胞(DC细胞)
DC细胞对抗原的加工和呈递有重要作用,但肿瘤微环境中的DC细胞通常是失活的,它们并不能刺激针对抗原的免疫反应。肿瘤内的缺氧和炎症环境削弱了DC细胞刺激免疫反应的功能,并且还能抑制肿瘤内的T细胞。
5. 骨髓源的抑制性细胞(MDSC)
MDSC具有很高的分化活性,其表型多变,因此难以鉴定,有些MDSC甚至可以分化为TAM。MDSC能抑制CD4
+
和CD8
+
细胞的激活及介导的免疫反应,也能抑制DC细胞、M1巨噬细胞、自然杀伤细胞和NK细胞的杀伤活性,促进肿瘤血管生成。
6. 中性粒细胞
中性粒细胞可以抑制抗肿瘤的免疫细胞。中性粒细胞还能促进肿瘤转移,它通过分泌生长因子,为肿瘤细胞提供选择压,或抑制CD8
+
T细胞或NK细胞的免疫监管。但在一些报道中,中性粒细胞也有抑制肿瘤细胞或抑制TGF-β的作用。
7. 成纤维细胞
癌症相关的成纤维细胞(CAF)是组织遭受损伤时,由成纤维细胞分化而成,该过程会促使纤维化,导致癌症的风险。肿瘤微环境中有很多CAF,它们被TGF-β、MCP1、PDGF、FGF等细胞因子激活,CAF激活后会分泌VEGF、TGF-β等多种生长因子,造成肿瘤抑制的微环境[4]。CAF常在肿瘤组织周围形成致密的纤维间质包裹肿瘤,阻止抗肿瘤药物到达靶点。
肿瘤的中心部分是缺氧环境,有一些死亡的肿瘤细胞,肿瘤和免疫细胞在此都难以存活,而逃逸的肿瘤细胞和免疫细胞,通常聚集都在肿瘤边缘。因此,肿瘤边缘是多种细胞活跃的位置,也是肿瘤细胞和免疫细胞相互作用最密切的区域,未成熟的骨髓细胞能抑制APC,TAM提供EGF等因子,CAF通过TGF-
β
、PDGF促进上皮细胞向间充质细胞的转化(EMT)。
血管生成是肿瘤转移的重要助力,肿瘤微环境中生成的血管有不均一性,且容易渗漏,使血压、氧化和营养都发生变化,促使缺氧环境和肿瘤转移。
在血液中,NK细胞会被血小板、中性粒细胞抑制,无法发挥其抗肿瘤的活性(图2)。血小板还能帮助肿瘤细胞在内皮细胞上聚集、附着(类似于血栓形成过程),并通过与内皮细胞上的P2Y2受体介导ATP依赖的激活过程,使内皮细胞短暂打开,使肿瘤细胞转移到血管外。
淋巴管内皮细胞能帮助肿瘤细胞在淋巴器官中扩散,并通过改变对肿瘤的免疫反应而调节肿瘤微环境。
间充质细胞具有较高的干细胞特性,有多向分化的能力。EMT是肿瘤转移侵袭的早期步骤,可以被基质中的
TGF-β
诱导,肿瘤细胞会失去上皮细胞的标志,增加间充质细胞的特性,且易于转移。而在肿瘤转移的晚期,转移形成的新肿瘤的间充质细胞又会变为新的上皮细胞,成为成熟的肿瘤[4]。
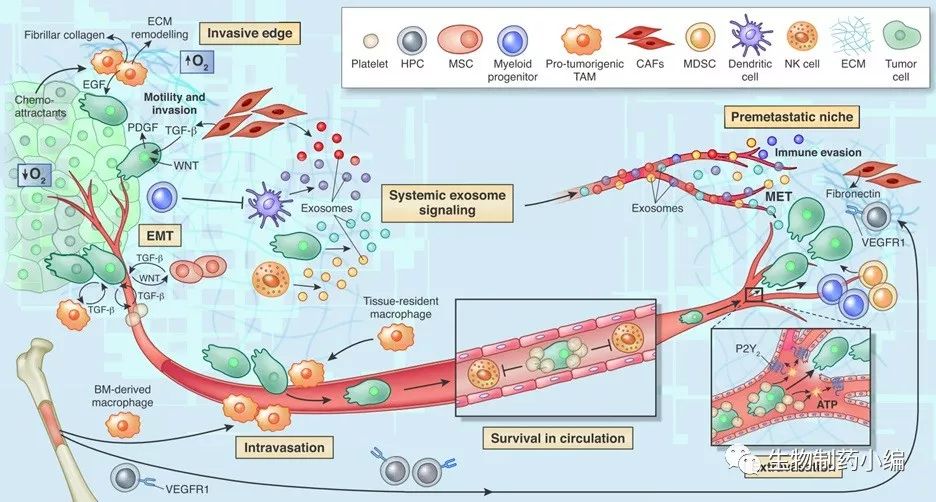
▲ 图2 肿瘤微环境对肿瘤转移的支持(Quail, D.F. & Joyce, J.A. Nat Med,2013)
肿瘤干细胞理论是一个经过长期发展的理论,最初发现肿瘤中的大部分细胞在移植后并不会成瘤,只有少数细胞具有致癌性,后来逐渐发现这些肿瘤细胞具有分化为其他类型细胞的能力,因此被认为是肿瘤干细胞。肿瘤干细胞既能作为恶性细胞增殖,也可以分化为多种非肿瘤细胞,包括促进肿瘤生长的基质和免疫细胞等[5]。肿瘤干细胞虽然只占整个肿瘤中的一小部分,但却是“万恶之源”,影响了附近的多种细胞和基质,改变了微环境,并逐渐突变,从良性变为恶性,且易于转移。
肿瘤干细胞与肿瘤的转移和复发密切相关。肿瘤干细胞在环境中渗透,并释放促肿瘤的因子,如TGF-β,
CCL2, PDGF,
FGF等,改变附近细胞的表型。这些细胞因子还能影响机体其他部位的微环境,将其改造为适合转移的肿瘤细胞附着、生长的位点,一旦肿瘤细胞转移到这些位点就能适宜的生长、增殖。
肿瘤干细胞的特性和标志可能是不稳定的,在不同的环境下,其细胞特性可以相互转换。肿瘤干细胞对化疗等治疗方式有抗性。
1. 靶向淋巴细胞
由于淋巴细胞在肿瘤微环境中的重要作用,目前研究最多的是针对T细胞的一些疗法,如免疫检查点PD-1,CTLA-4等,解除T细胞的抑制状态,使其恢复杀伤效应。免疫检查点的研究已有很多详细的阐述,这里不再展开讨论。
此外,靶向Treg细胞能解除其对效应T细胞的抑制,增强效应T细胞的活力。Treg细胞表面有CTLA-4、OX40、GITR表达,它们的抗体能抑制Treg细胞的调控功能,还可以通过ADCC等效应杀伤Treg细胞。IDO由肿瘤细胞和骨髓细胞产生,它能促使天然T细胞转变为Treg细胞,并且增加MDSC的活性。IDO抑制剂可以抑制Treg细胞的活性,与PD-1抗体联用有良好疗效。持续性低剂量的环磷酰胺(CTX)也能消灭Treg细胞,并恢复T细胞和NK细胞的功能,但剂量过高会杀伤免疫细胞。紫杉醇、
三氧化二砷
和VEGFR抑制剂sunitinib、吉西他滨也能减少Treg细胞数量,增加CTL与Treg比值。吉西他滨还能增强DC细胞的呈递作用和杀伤MDSC细胞[6]。
2. 靶向血管生成
靶向血管生成可以防止肿瘤的转移,常见的有VEGF抗体或VEGF捕获剂(VEGF trap),不仅能抑制血管增生,还能促进效应T细胞渗透进入肿瘤部位。
3. 靶向巨噬细胞
肿瘤分泌的生长因子CSF-1和CCL2能激活微环境中的巨噬细胞,促进肿瘤生长,而抑制CSF-1R和NF-κB信号通路能诱导M2巨噬细胞转化为M1巨噬细胞,使其具有抗肿瘤的活性。
CD47在多种肿瘤细胞上表达,它与巨噬细胞上的SIRPα结合后可以给巨噬细胞传导“别吃我”的信号,抑制巨噬细胞对肿瘤细胞的吞噬作用。CD47的抗体可以阻断这样的信号,使巨噬细胞重新发挥抗肿瘤的功能。但CD47广泛在人体正常细胞上表达,CD47的抗体用药后会被大量的表达CD47的血细胞结合而消耗,必须增加抗体用药量才能维持疗效,带来较高的血液系统副作用。SIRPα则较为专一的表达于巨噬细胞上,因此SIRPα的抗体可以避免带来类似的副作用,而同样达到激活巨噬细胞吞噬肿瘤细胞的作用,目前已有几个SIRPα抗体处于研发阶段。
4. 靶向NK细胞
KIR是一种包含14个蛋白的受体家族,表达于NK细胞和部分T细胞上,其中几种蛋白有抑制NK细胞活性的功能。Lirilumab是KIR的全人源抗体,Lirilumab与Nivolumab联用在治疗头颈癌的临床试验中曾展现出不错的临床数据,但后续临床试验效果都不好。
5. 靶向环境
常用方法有降低基质硬度和纤维化,以改善药物递送;改善血管提高氧化水平,提高免疫力等。
肿瘤可以利用DNA甲基化抑制细胞因子CXCL9和CXCL10的表达,阻碍T细胞到达肿瘤微环境。而调节甲基化的治疗方式可以解除这种抑制,使更多的T细胞浸润肿瘤,改善PD-L1免疫检查点的疗效。
肿瘤的缺氧环境会诱导腺苷的产生,腺苷会上调CD39和CD73,抑制NK细胞和CD8
+
T细胞的杀伤活性。因此,抑制腺苷受体A2AR和CD39,CD73能解除腺苷对免疫反应的抑制。
6. 靶向细胞因子
抑制Treg细胞释放的细胞因子,如TGF-β, IL-10, 和IL-35等,可以解除Treg细胞对效应T细胞的抑制作用。也可以通过向肿瘤内注射IL-2, IL-12, TNF-α, I型干扰素和GM-CSF等细胞因子来激活免疫反应。
肿瘤微环境是复杂而动态变化的,具有很高的多样性,不同类型的肿瘤,甚至不同位置的肿瘤其微环境都有差别。在研发过程中考虑肿瘤微环境的影响并利用肿瘤微环境是必不可少的。开发可靠的标志物来判定肿瘤微环境的特点,从而制定个性化的治疗方案,调节肿瘤微环境,使其成为利于免疫反应的状态,可以有效提高癌症治疗效果。
参考文献
1. Ronchetti,S. et al. Glucocorticoid-induced tumour necrosis factor receptor-related protein: a key marker of functional regulatory T cells. J Immunol Res 2015, 171520 (2015).
2. Uraushihara, K. et al. Regulation of murine inflammatory bowel disease by CD25
+
and CD25- CD4
+
glucocorticoid-induced TNF receptor family-related gene+ regulatory T cells. J Immunol 171, 708-16(2003).
3. Balkwill, F.R.,Capasso, M. & Hagemann, T. The tumor microenvironment at a glance. J Cell Sci 125, 5591-6 (2012).
4. Quail,D.F. & Joyce, J.A.
Microenvironmental regulation of tumor progression and metastasis. Nat Med 19, 1423-37 (2013).
5. Clevers, H. Thecancer stem cell: premises, promises and challenges. Nat Med 17, 313-9(2011).
6. Pitt, J.M. et al. Targeting the tumor microenvironment: removing obstruction to anticancer immune responses and immunotherapy. Ann Oncol 27, 1482-92 (2016).
欢迎加入小编团队成为小编一员
请加 小编微信号:wuwenjun7237
如有技术解读、行业洞见愿意分享
欢迎投稿到小编邮箱:
[email protected]















