
欢迎点击「PaperRss」↑关注我们!
iNature
:由于iNature编辑组一直准备诺贝尔奖方面的材料,导致这一期的Cell播报晚了几天,在此深表歉意。
Song研究组,Ming研究组同何川研究组合作,揭示
m 6 A 可以控制哺乳动物的皮质神经元的发生
;Kim研究组揭示,
在单细胞水平上,衰老与转录的失调控增加及细胞命运的丧失相关;Eichler研究组收集了516个自闭症症家庭的综合性的全基因组CNV / SNV数据集,为后续的自闭症研究
提供了前进的途径; Cravatt 研究组使用化学蛋白质组学的方法,鉴定到了
NRF2调节蛋白(NR0B1) , 这个蛋白可以促进
KEAP1
突变体的癌细胞的生长。
1
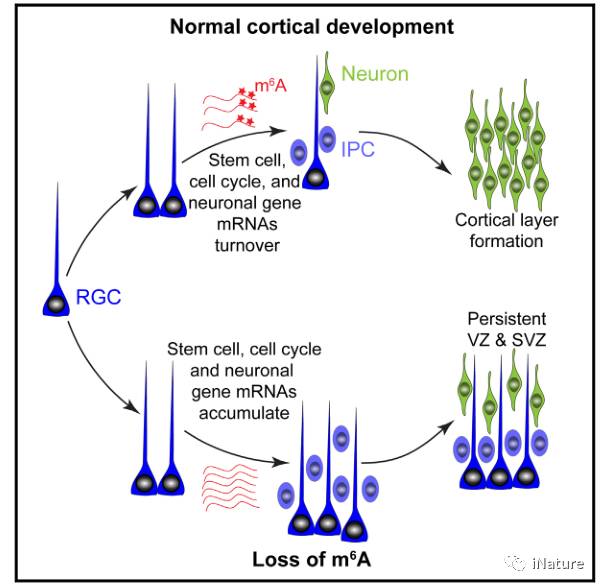
m 6 A 可以控制哺乳动物的皮质神经元的发生

由Mett13 / Mett14甲基转移酶复合物催化产生的N6-甲基腺苷(m6A)是最普遍的
mRNA
内部修饰。 m6A是否调节哺乳动物的大脑发育是未知的。在这里,我们显示胚胎小鼠脑中Mettl14敲除下,m6A缺失,延长了神经胶质细胞的细胞周期,并将皮质神经发生延伸到出生后阶段;通过Mettl3敲除,也得到了类似的现象。胚胎小鼠皮层的m6A测序显示,
m6A主要富集在
转录因子,神经发生,细胞周期和神经元分化的mRNA中,m6A标记促进其衰老。进一步的分析发现皮质神经干细胞中以前未被认可的转录模式中,m6A信号也调节前脑组织中的人皮质神经发生。小鼠与人类皮质神经发生之间的m6A-mRNA全基因组的比较,揭示了
人特异性m6A标记的
转录本
与脑障碍风险基因相关。
亮点
-
m 6 A缺失,导致皮质神经原始细胞的细胞周期延长;
-
经过比较小鼠及人类的m 6 A图谱,呈现出保守及独特性;
-
m 6 A促进标记的神经发生相关的转录本被延迟降解;
-
转录本的提前印记对于神经元的发生是必需的。
原文链接
http://www.cell.com/cell/fulltext/S0092-8674(17)31052-8
2
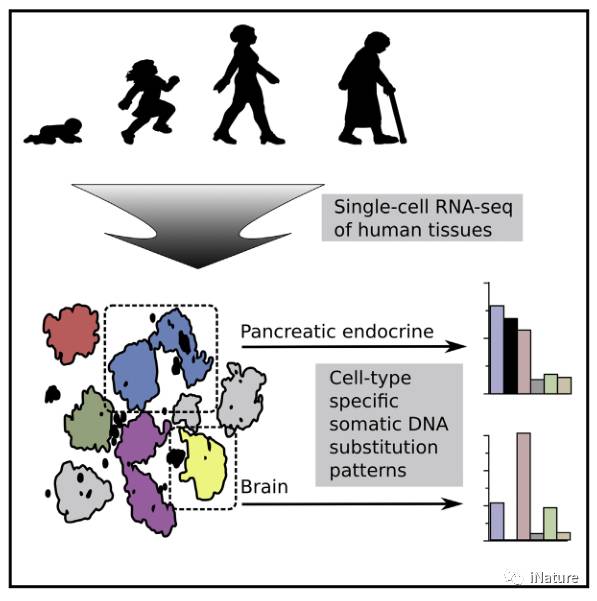
在单细胞水平上,衰老与转录的失调控增加及细胞命运的丧失相关

随着生物的年龄增长,细胞积累遗传和表观遗传学错误,最终导致受损的器官功能或灾难性转化,如癌症。由于衰老反映了随机性增加的过程,器官中的细胞将以不同的方式受到单独的影响,从而使得散发性成体细胞的大量分析难以解释。在这里,我们通过对来自8位横跨六十年的献血者的2,544个人胰腺细胞进行单细胞转录组分析,来直接测量人体组织中老化的影响。我们发现来自老年供体的胰岛内分泌细胞显示出转录噪声水平和潜在的命运漂移。通过确定单个细胞的突变历史,我们发现了健康老龄的内分泌细胞中的新型突变特征。我们的研究结果表明使用来自原代细胞的单细胞RNA测序(RNA-seq)数据的可行性可以获得对老年人体组织的遗传和转录过程的见解。
亮点
-
来自供体的单细胞的RNA-seq允许检测随机年龄相关的错误;
-
来自老年捐赠者的细胞增加了转录噪声和命运漂移的迹象;
-
内分泌胰腺细胞显示氧化应激相关突变特征;
-
细胞应激和代谢基因在错误积累的细胞中显示更高的水平。
原文链接
http://www.cell.com/cell/fulltext/S0092-8674(17)31053-X

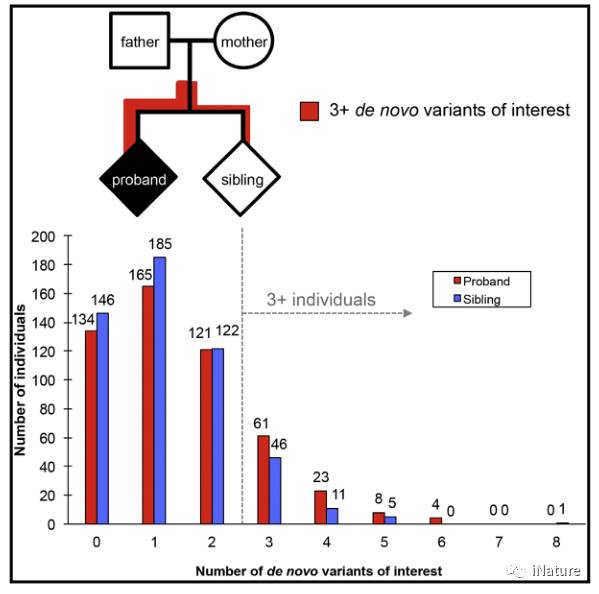
为了进一步了解自闭症的遗传病因,我们生成并分析了516例特发性自闭症家族(2,064人)的基因组序列数据。该资源包括5900万个单核苷酸变体(SNV)和9,212个个人拷贝数变异体(CNV),其中133,992中的88个是全新突变(DNM)。我们估计每一代每个SNV位点的突变率为〜1.5×10-8,重复DNA中的突变率更高。比较probands和不受影响的兄弟姐妹,我们观察到几种DNM趋势。 Proband携带更多的基因破坏性CNV和SNV,导致严重的错义突变和映射到预测的胎儿脑启动子和胚胎干细胞增强子。自闭症基因的这些差异变得更加显着(p = 1.8×10-3,OR = 2.2)。患者更可能在不同的基因中携带多个编码和非编码的DNM,这些基因丰富了在纹状体神经元中的表达(p = 3×10-3),这表明为进一步表征更复杂的自闭症病例提供了前进的途径。
亮点
原文链接
http://www.cell.com/cell/fulltext/S0092-8674(17)31006-1
4
NRF2调节蛋白(NR0B1)促进
KEAP1
突变体的癌细胞的生长

转录因子NRF2是细胞抗氧化反应的主要调节因子,并且通常在非小细胞肺癌(NSCLC)中通过负调节KEAP1中的突变而被遗传激活。而直接药理学 NRF2的抑制被证明是有挑战性的,其异常活化可以重新活化癌细胞中的生物化学网络,这可能造成特殊的副反应。在这里,我们使用化学蛋白质组学来寻找在NSCLC细胞中的KEAP1突变体中选择性表达的可药用蛋白质。我们发现其中主要的是NR0B1,这是非典型孤儿核受体,参与多聚体蛋白复合物以调节KEAP1突变体NSCLC细胞的转录产物。我们进一步鉴定共价靶向NR0B1蛋白质相互作用区域内的保守半胱氨酸的小分子,这些化合物破坏NR0B1复合物并损害KEAP1突变型癌细胞的锚定独立生长。我们的研究结果表明,NR0B1作为可支持NRF2依赖性肺癌的药物转录调节因子。

亮点
原文链接
http://www.cell.com/cell/fulltext/S0092-8674(17)31047-4
全文来自公众号《inature》,版权属原创作者刘盼,欢迎转发!


如果您觉得这篇文章不错,请转发到您的朋友圈吧!
( 免责声明: 本文中的部分信息援引自网络。本公众号发布的图文一切仅为分享交流,并不代表本公众号的观点。所有援引自网络的部分,其版权归原作者、原公号或原网站所有,如有涉及版权敬请及时告诉我们,定将及时删除或妥善处理。)

长按下面二维码,关注我们!
觉得不错点个赞吧!





