
“华兴资本医疗与生命科技行业周报”定期发布,专注从资本角度,解读一周数据,提供最新行业观察。
医疗与生命科技是华兴资本多年来关注并深耕的领域,目前已为超过100个融资及并购项目担任财务顾问。
医疗与生命科技行业创新不断涌现,已经发展成为最活跃的行业之一,华兴资本始终支持、陪伴这一领域创业企业成长,致力为行业带来理性专业的声音。
关注华兴资本微信公众号(ID:iChinaRenaissance),后台点击“兴观点”-“行业观察”-“生命科技”,获取更多医疗与生命科技行业相关信息。
10月20日,叮当快药宣布完成10亿元B+轮融资,本轮融资由泰康、海尔医疗、龙门投资,原股东招银国际招银电信基金、国药中金、软银中国继续跟投。华兴资本担任独家财务顾问。
叮当快药致力于服务百姓健康搭建药物上门配送平台,已经在北京、上海、广东等10多个省市完成了医药新零售布局,预计2021年全面覆盖全国一二三线核心城市。围绕大健康核心,在夯实 ‘快医’、‘快药’服务基础上,通过建立个人健康大数据,结合AI等高科技手段推出‘快检’、‘快险’以及慢病健康管理等创新服务,与股东泰康等多家保险公司构建‘医+药+检+险’健康生态。

10月23日,圣诺制药宣布完成1.05亿美元D轮融资,本轮融资由旋石资本、沃森生物和阳光融汇资本领投,仙瞳资本、隆门资本、弘陶资本和中源资本跟投,华兴资本担任本轮融资财务顾问。
圣诺制
药
专注于应用核酸干扰技术进行新药开发,
其核心候选产品
siRNA
药物
STP705
已进入
2
期临床研究阶段,治疗皮肤原位鳞状细胞癌。
本
轮融资将用于进一步推进和拓展圣诺制药的
RNAi
药物产品管线。
10月19日,思路迪诊断宣布完成15亿元人民币新一轮股权融资,本轮融资由CPE领投,中金资本旗下基金、济民可信、清松资本、浦东科创、海尔医疗、睿亿投资、兰尚资本跟投。原股东鲁信创投、山东交通发展基金和仙瞳资本继续跟投。
思路迪诊断致力于精准诊断领域,拥有第三方医学检验服务以及IVD设备和试剂两大业务线,布局了包括肿瘤和微生物诊断领域的一系列产品研发管线。拥有包括基因二代测序技术、qPCR、外泌体核酸/蛋白检测和人工智能数据分析等技术平台,是行业内集成设备工程、
电气、生命科学技术、材料学、数据分析为一体的综合性研发平台。
10
月
19
日,
禾木生物宣布完成
数千万
美元
B
轮融资
,
本轮融资由高瓴创投领投,君联资本、三正
健康投资
跟投。
禾木生物致力于血管介入领域创新解决方案的平台企业,目前产品线覆盖缺血性卒中、出血性卒中及颅内血管狭窄等疾病的治疗。已上市产品TracLine为全新一代远端通路导管,适用于各类神经介入手术,其他核心产品颅内血栓抽吸导管也即将登陆市场。

1. 多款新冠疫苗最新进展
2. FDA正式批准首个COVID-19疗法
3. 罗氏合作Atea Pharmaceuticals开发口服抗病毒疗法

10月24日,阿斯利康宣布其与牛津大学联合开发的新冠病毒候选疫苗AZD1222,得到美国FDA的批准在美国重新开始3期临床试验,检验AZD1222的3期临床试验已经在英国、巴西、南非和日本重新开始。同日,强生公司宣布将准备在美国继续进行检验其候选新冠疫苗的关键性3期临床试验,此前一名参与者出现严重不良反应而导致临床试验暂停。在对试验中一名参与者出现的严重不良事件进行全面评估后,未发现导致这一事件的明确原因。
10月20日,巴西布坦坦研究所宣布,北京科兴中维生物技术有限公司联合多家合作单位开发的新冠灭活疫苗克尔来福在3期临床试验的中期分析中表现出良好的安全性数据。巴西已有9000名18-59岁志愿者接受两剂克尔来福的疫苗接种,只有35%的志愿者在接种疫苗后表现出轻度不良反应。
10月18日,《柳叶刀-传染病》发表了中国北京生物制品研究所有限责任公司、中国疾病预防控制中心、清华大学等多家机构共同合作的一款新冠灭活疫苗BBIBP-CorV的临床研发进展。在1/2期试验中,BBIBP-CorV在所有18-80岁的健康受试者中都表现出了良好的安全性,并都成功诱导了免疫反应,两种加强接种方案诱导的抗体滴度更为理想。
10月23日,吉利德宣布,FDA批准其抗病毒药物Veklury (瑞德西韦)上市,此前瑞德西韦已经获得FDA的紧急使用授权,Veklury是目前美国唯一一款获得FDA批准的COVID-19疗法,适用于治疗12岁以上,体重至少40公斤,需要住院治疗的COVID-19患者。
罗氏合作Atea Pharmaceuticals开发口服抗病毒疗法
10月23日,罗氏和Atea Pharmaceuticals宣布,将联合开发、生产和推广Atea公司的在研口服抗病毒药物AT-527。AT-527是一款病毒RNA聚合酶小分子抑制剂,不但可以作为口服疗法治疗住院COVID-19患者,而且可能成为非住院患者的首个口服治疗选择。AT-527还具有作为暴露后预防性治疗的潜力。

1. 国家医保局发布区域点数法总额预算和按病种分值付费试点工作方案
2. 国家药监局将29项三类体外诊断试剂调整至二类
3. 美国医疗保险和医疗补助服务中心发布决定备忘录草案,描述结直肠癌筛查测试的覆盖标准

国家医保局发布区域点数法总额预算和按病种分值付费试点工作方案
10月19日,国家医疗保障局官方发布了《国家医疗保障局办公室关于印发区域点数法总额预算和按病种分值付费试点工作方案的通知》。用1-2年的时间,将统筹地区医保总额预算与点数法相结合,实现住院以按病种分值付费为主的多元复合支付方式。建立起现代化的数据治理机制,形成数据采集、存储、使用的规范和标准。逐步建立以病种为基本单元,以结果为导向的医疗服务付费体系,完善医保与医疗机构的沟通谈判机制。加强基于病种的量化评估,使医疗行为可量化、可比较。形成可借鉴、可复制、可推广的经验,为下一步在更大范围推广打好基础。将实施实行区域总额预算管理,实现住院病例全覆盖,制定配套的结算方式,打造数据中心,加强配套监管措施,完善协议管理,加强专业技术能力建设。
2020年10月20日,国家药监局对《6840体外诊断试剂分类子目录》中产品类别为III-7与肿瘤标志物相关试剂的部分体外诊断试剂管理类别及预期用途进行了调整。自公告发布之日起,药品监督管理部门依据《体外诊断试剂注册管理办法》《体外诊断试剂注册管理办法修正案》《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》,按照调整后的类别受理体外诊断试剂注册,进行审评审批。对于已受理尚未完成注册审批的体外诊断试剂,药品监督管理部门继续按照原受理类别审评审批,准予注册的,核发医疗器械注册证,并在注册证备注栏注明调整后的产品管理类别。对于已注册的体外诊断试剂,其管理类别由高类别调整为低类别的,在有效期内的医疗器械注册证继续有效。医疗器械注册证有效期内发生注册变更的,注册人应当向原注册部门申请注册变更。各省级药品监督管理部门要加强《6840体外诊断试剂分类子目录(2013版)》类别调整的宣贯培训,切实做好相关产品审评审批和上市后监管工作。
美国医疗保险和医疗补助服务中心发布决定备忘录草案,描述结直肠癌筛查测试的覆盖标准
10月19日,美国医疗保险和医疗补助服务中心(CMS) 发布了一份决定备忘录草案,描述当前和未来基于血液的结直肠癌筛查测试的覆盖标准。根据CMS,结直肠癌血液检测试剂Epi proColon不符合建议标准,不打算将其划入医疗保险。另外,血液生物指标检测得到美国食品和药品管理局的市场授权,CMS预将此检测列入医保范围。

1. 基石药业PD-L1抗体获美国FDA突破性疗法认定
2. 宜明昂科VEGF/PD-L1双特异性抗体临床申请获CDE受理
3. 亚盛医药第三代BCR-ABL抑制剂白血病候选药被纳入优先审评

10月22日,基石药业宣布,其PD-L1抗体舒格利单抗获得美国FDA授予的突破性疗法认定,单药治疗成人复发或难治性结外自然杀伤细胞/T细胞淋巴瘤。舒格利单抗是一种很接近人体的天然G型免疫球蛋白4单抗药物。舒格利单抗在患者体内产生免疫原性及相关毒性的风险非常低。CS1001-201的单臂、多中心、2期研究数据显示,在38例疗效可评估患者中,客观缓解率为44.7%,完全缓解率为31.6%,中位缓解持续时间为16.8个月。接受给药的43例患者,中位总生存期19.7个月,1年OS率为55.5%。
宜明昂科VEGF/PD-L1双特异性抗体临床申请获CDE受理
10月21日,中国国家药监局药品审评中心最新公示,宜明昂科1类生物新药注射用IMM2510临床申请获得受理。IMM2510是一款可同时靶向VEGF和PD-L1的双特异性抗体,拟开发用于实体瘤。临床前研究数据证实,IMM2510在多种肿瘤模型中均取得显著的治疗效果,在安全性上具有明显的优势。
亚盛医药第三代BCR-ABL抑制剂白血病候选药被纳入优先审评
10月21日,亚盛医药宣布其全资子公司顺健生物的1类新药奥瑞巴替尼片已正式被中国家药品监督管理局新药审评中心纳入优先审评。奥瑞巴替尼是第三代BCR-ABL抑制剂,本次以“符合附条件批准的药品”被纳入优先审评,适应症为慢性髓性白血病。奥瑞巴替尼有望成为中国大陆地区首个上市的第三代BCR-ABL抑制剂,亚盛医药将迎来首款获批上市的新药。
1. Alnylam公布多项RNAi药物积极数据
2. 2020北美洲肺癌大会,安进和德国默克公布新药肺癌研究最新数据
3. Stryker推出全球首款AI、完全无线病床

10月24日,Alnylam在2020年美国肾脏病学会年会上公开Lumasiran儿科研究ILLUMINATE-B的数据,接受Lumasiran治疗的儿童患者3至6个月的平均随机尿草酸肌酐较基线平均减少72%。半数患者的尿草酸水平正常或接近正常。这些结果为推进Lumasiran上市提供了极为有力的支持。如果获得批准,Lumasiran将成为首个上市的治疗PH1的药物。Lumasiran已经获得FDA授予治疗PH1的儿科罕见病资格认定、孤儿药资格认定、突破性疗法资格认定;以及EMA授予治疗PH1的孤儿药资格认定、优先药物资格认定。
2020北美洲肺癌大会,安进和德国默克公布新药肺癌研究最新数据
10月19日,在国际肺癌研究协会2020年北美洲肺癌大会上,德国默克公布了其“first-in-class”在研双功能融合蛋白Bintrafusp Alfa二线治疗晚期非小细胞肺癌患者的3年随访数据。在PD-L1表达的亚组中,PD-L1阳性(≥1%)患者中位OS为21.7个月,高PD-L1表达(≥80%)患者中位OS未达到。PD-L1阳性患者36个月OS率为33.6%,高PD-L1表达患者这一数字为66.7%。接受Bintrafusp Alfa二线治疗的晚期非小细胞肺癌患者表现出了持久的反应和长期生存,且毒性可控制。在中国,Bintrafusp Alfa已获批针对非小细胞肺癌、胆管癌、宫颈癌等适应症的临床研究。
同时,安进公布其“first-in-class” KRAS G12C突变体抑制剂Sotorasib治疗的晚期非小细胞肺癌患者的可持续临床益处和生物标志物数据。有31例患者之前接受了2次以上的治疗,19例患者接受了3次以上的治疗。3例患者出现不良事件导致停药,没有出现剂量限制毒性或致命的治疗相关不良事件。大多数患者实现了疾病控制,平均PFS为6.9个月。
10月23日,Styker的AI、无线病床ProCuity Bed诞生,内置iBed Wireless无线技术可以连接到护士呼叫系统,无需使用电缆或电线。ProCuity Bed比同类产品低近30cm,具备符合人体工程学设计,直观的患者定位、床上警报以及符合人体工学的扶手能够减少与跌倒相关的伤害。其Three-position Secure栏杆,使患者更容易进出;独有的自适应床位报警器使用重量传感器技术感知患者的体重,病床的侧轨定位、床头角度和高度都受到监控,以确保它始终处于患者的安全位置。如果有任何部件错位,护理人员会立即得到警告;Zoom电动驱动技术帮助护理人员安全、高效地移动患者。
 10月20日,华东医药其全资子公司中美华东宣布获得
美国ImmunoGen新型
抗体偶联药物Mirvetuximab Soravtansine(简称MIRV)在大中华区的独家权益,此笔交易首付款和里程碑付款最高可达3.05亿美元。MIRV是全球首个针对FRα阳性卵巢癌的ADC在研药物,拟开发用于治疗卵巢癌,目前正在美国进行III期临床试验,预计2021年底递交上市申请,2022年有望获批上市。华东医药计划于2021年上半年启动该产品在中国区的临床注册申请。
10月20日,华东医药其全资子公司中美华东宣布获得
美国ImmunoGen新型
抗体偶联药物Mirvetuximab Soravtansine(简称MIRV)在大中华区的独家权益,此笔交易首付款和里程碑付款最高可达3.05亿美元。MIRV是全球首个针对FRα阳性卵巢癌的ADC在研药物,拟开发用于治疗卵巢癌,目前正在美国进行III期临床试验,预计2021年底递交上市申请,2022年有望获批上市。华东医药计划于2021年上半年启动该产品在中国区的临床注册申请。
○
医疗与生命科技资本市场本周动态一览:
近期交易概况(2020年10月19日-10月23日)

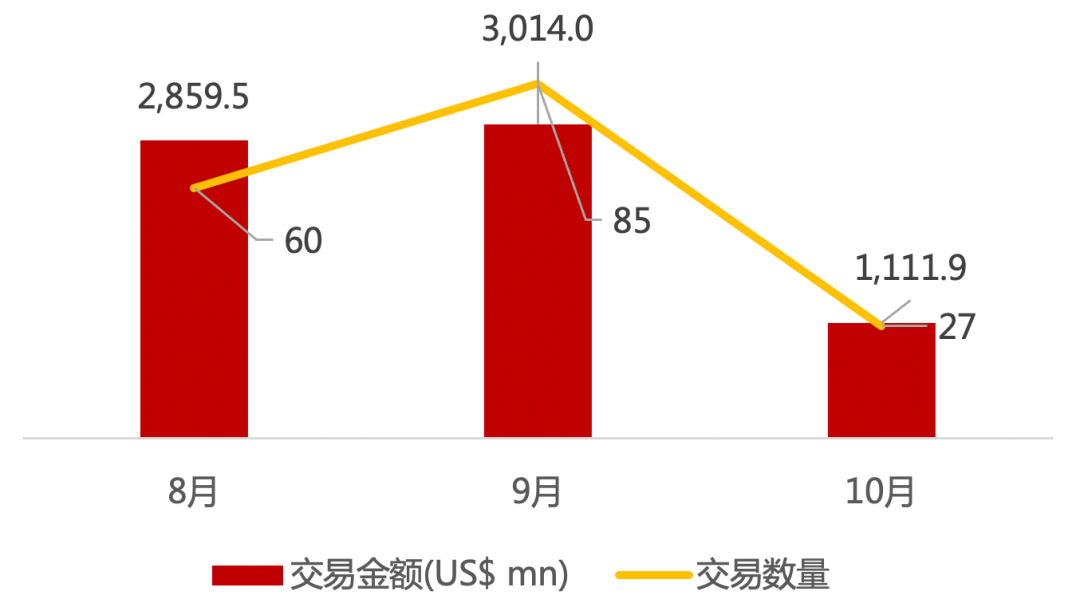
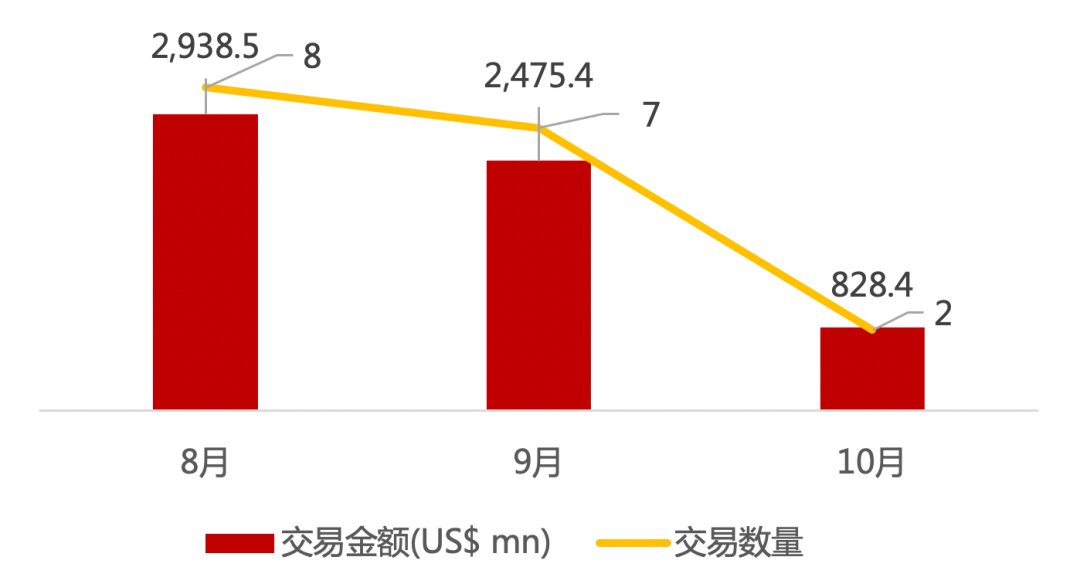
* 数据来源:华兴资本内部整理
上市公司市值及估值倍数一览
(2020年10月23日)市值单位:百万美元

< < 左右滑动图片查看完整表格 > >

< < 左右滑动图片查看完整表格 > >

< < 左右滑动图片查看完整表格 > >


















