
左力
1
刘雪丽
2
韩晟
2
1.北京大学人民医院肾内科
2.北京大学医药管理国际研究中心
【
摘要
】
目的
对慢性肾脏疾病(CKD)合并贫血患者及非贫血患者的经济负担进行对比分析,并对贫血治疗用药情况进行描述统计分析。
方法
本研究数据来源于 2015 年中国医疗保险研究会(CHIRA)《全国城镇基本医疗保险参保患者药品医疗器械和诊疗项目利用情况调查》,根据患者的诊断或治疗情况进行识别,最终纳入 CKD 患者共计 31 886 人。研究中对分类变量指标采用频次和百分比;对连续性数值变量指标采用中位数。
结果
CKD 合并贫血比 CKD 非贫血患者全因和因 CKD 发生年均直接医疗费用中位数分别增加了 4 倍(23 562 元)、12.46 倍(9893 元),差异均有显著统计学意义(P<0.0001)。
结论
CKD 合并贫血患者疾病负担显著高于 CKD 非贫血患者,积极治疗贫血、预防贫血并发症的发生或是降低我国 CKD 患者经济负担的关键之一。
【
关键字
】
慢性肾脏疾病;肾性贫血;直接医疗费用
2012 年改善全球肾脏病预后组织(KDIGO)临床实践指南中,将慢性肾脏疾病(Chronic Kidney Disease, CKD)明确定义为:肾脏结构或功能异常,持续时间>3 个月,且这种结构或功能的异常对健康有影响
[1]
。近几年,CKD 作为一项重要的公共健康问题在我国引起了广泛关注。调查结果显示,我国成年人群中 CKD 的占比为 10.8%,据此估计我国现有成年 CKD 患者 1.2 亿人口
[2]
。肾性贫血是 CKD 患者的主要并发症之一,必须符合如下各条标准才能做出临床诊断:①患者患有 CKD,并已有肾功能损伤;②血红蛋白(Hb)已达到贫血诊断标准(WHO标准:男性 Hb<13 g/dl,女性 Hb<12 g/dl);③能够除去 CKD 以外因素所致的贫血
[3]
。促红细胞生成素(EPO)绝对和相对缺乏、慢性失血(反复抽血检查、血液滞留于透析器、胃肠道出血等)、红细胞寿命缩短、铁和叶酸不足、急性或慢性感染状态等均有可能造成 CKD 患者贫血
[4]
。据国外统计的数据显示,约40%~60%的CKD 患者有贫血发生
[5]
。国内研究表明,透析与非透析 CKD 患者贫血占比分别为 98.2%和52.0%
[6]
。肾性贫血程度与肾功能减退程度呈正相关,而且肾性贫血是 CKD 患者合并心脑血管事件的独立危险因素
[7]
,其不仅会对 CKD 患者的生活质量造成严重的影响,还可能会加快 CKD 肾功能恶化的进展
[8]
。慢性肾脏病患者贫血发生率高,对患者的长期存活及生存质量均有重要影响。因此,纠正肾性贫血是慢性肾脏病一体化治疗的重要组成部分。
有限的国内外肾脏疾病负担研究提示贫血显著增加 CKD 患者的经济负担,其中可能的原因包括贫血与心血管事件,肾功能恶化及住院等事件相关,增加了患者的经济负担,研究结果提示积极治疗肾性贫血能够降低慢性肾病患者的经济负担
[9-11]
。我国相关肾脏病经济负担研究中,除了少数几篇文献样本来自多个省市外
[12]
,大多文献都局限于单个省市,当地几家医院或仅选择一家医院作为目标医院
[13-14]
,根据该样本得到的结果是否具有广泛代表性值得商榷。另外,已有的研究多集中于终末期肾病,而针对贫血并发症给 CKD 患者带来的经济负担的研究寥寥无几。本研究样本覆盖了多个省市的上千家医院,不仅对 CKD 合并贫血患者及非贫血患者的经济负担情况进行了对比分析,还对 CKD 合并贫血患者的贫血治疗用药情况进行了统计分析,以期为更好地修订和执行临床诊治规范,减轻 CKD 患者经济负担提供参考和借鉴。
2.1 数据源介绍
本研究数据来源于 2015 年中国医疗保险研究会(CHIRA)《全国城镇基本医疗保险参保患者药品医疗器械和诊疗项目利用情况调查》。该数据库涵盖全国各省、自治区、直辖市城镇基本医疗保险参保患者当年的门诊/住院等全部就诊信息。直辖市和省会城市抽取当年参保患者总人数的2%;地级城市抽取总人数的 5%。抽样数据包括参保人员基本信息(性别、年龄、医疗保险类型、就诊类别、医疗机构名称、入/出院诊断、住院时间、总费用、医疗保险基金支付额)和参保人员医疗服务费用明细(服务项目名称、服务项目分类、服务数量、计量单位、单价、剂型、规格等)。
2.2 研究对象
本次研究的目标对象为数据库中所有 CKD 患者,具体纳入/排除标准详见表 1。最终纳入 CKD 患者共计 31 886 人,样本覆盖全国各地,其中省会及直辖市城市 25 个、地级城市 19 个。为了分析贫血并发症给 CKD 患者带来的疾病负担,本研究将 CKD 患者分为贫血组和非贫血组,贫血患者具体纳入/排除标准详见表 1。

2.3 研究方法
本研究主要采用描述性统计分析,对分类变量指标采用频次和百分比描述;对连续性数值变量指标采用中位数描述。所采用数据处理软件为 SAS 9.2、Access 和 Microsoft Excel。
本研究 CKD 患者费用分为两种,全因的年直接医疗费用和因 CKD 发生的年均直接医疗费用。全因年直接医疗费用指 CKD 患者一年中发生的所有就诊(包含门诊和住院)的总费用;因 CKD 发生的年均直接医疗费用指的是 CKD 患者在这一年中发生的第一诊断为CKD 的所有就诊(包含门诊和住院)的总费用。
本研究对 CKD 合并贫血患者在纠正贫血治疗过程中的用药情况以及相关费用进行了统计分析。首先本研究对样本数据进行清洗,剔除处方剂量或药品规格不明确、处方日期不明确、处方次数小于 2 次以及最晚处方日期与最早处方日期之差小于 30 d 的抗贫血药品处方患者,然后对剩余的 CKD 合并贫血患者样本进行统计分析。在数据分析中本研究采用公式:月均处方量=[总处方剂量/(最晚处方日期-最早处方日期)]×30,对各类抗贫血药物的月均处方量以及月均费用进行统计。
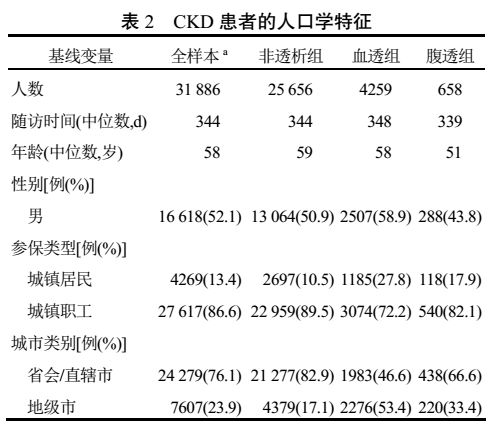
3.1 人口学特征
在本研究中,所有 CKD 患者以及各亚组患者的随访时间中位数均在 330 d 以上,可见本研究中大多数患者为一整年的数据,结果具有一定的参考意义。CKD 各组患者年龄中位数均在 50 岁以上,且大部分患者参保类型属于城镇职工。具体信息详见表 2。
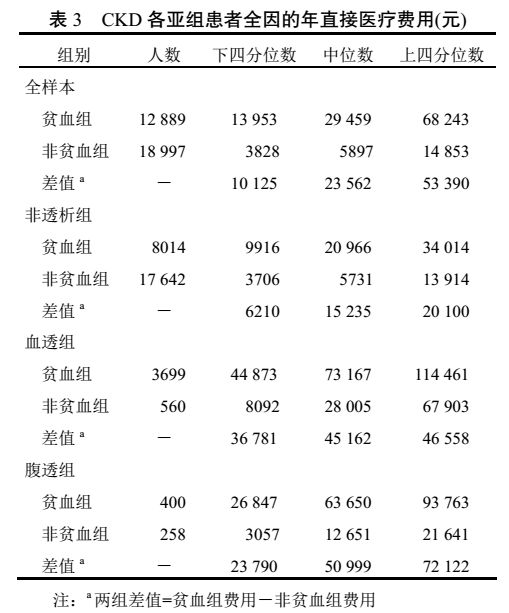
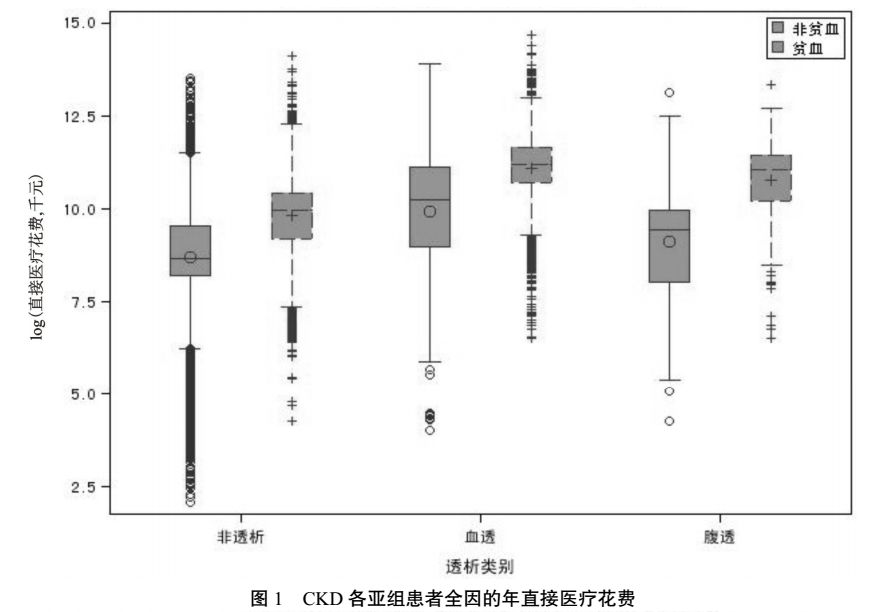
3.2 CKD 各亚组患者的疾病负担
对 CKD 患者全因的年直接医疗费用进行分析,结果显示贫血患者的直接医疗费用中位数比非贫血患者高出 4 倍(23 562 元),差异有显著统计学意义(两组比较,
P
<0.0001)。其中,非透析患者中贫血组比非贫血组中位数高出 2.66倍(15 235 元),差异有显著统计学意义(两组比较,
P
<0.0001)。血透患者中贫血组比非贫血组中位数高出 1.61 倍(45 162 元),差异有显著统计学意义(两组比较,
P
<0.0001)。腹透患者亚组中,贫血组比非贫血组中位数高出 4.03 倍(50 999 元),差异有显著统计学意义(两组比较,
P
<0.0001)。具体信息详见表 3 及图1。
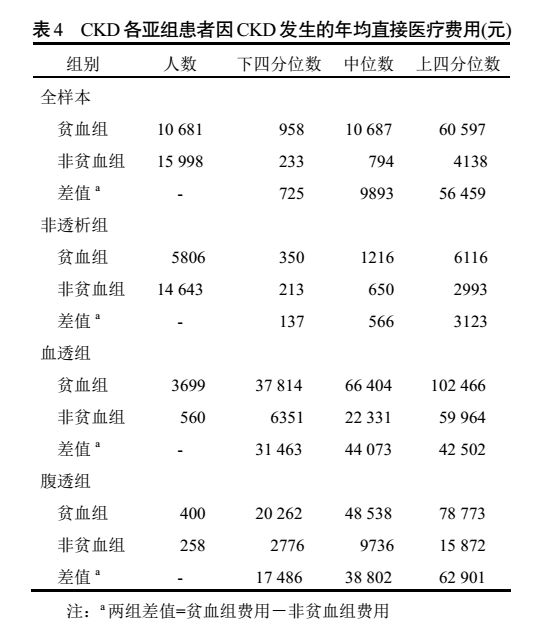
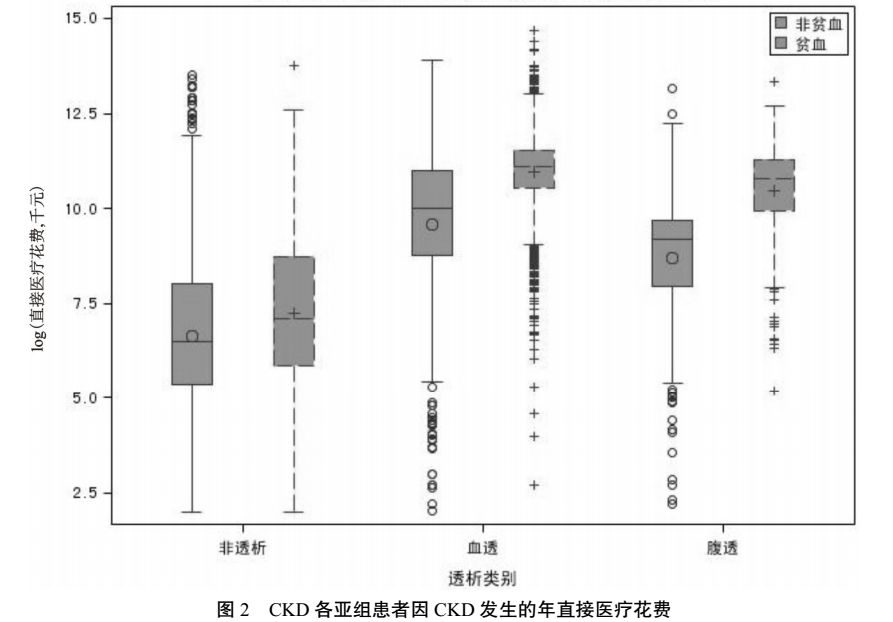
对 CKD 患者第一诊断为 CKD 发生的年均直接医疗费用进行分析,结果显示 CKD 合并贫血患者的年直接医疗费中位数比非贫血患者高出 12.46 倍(9893 元),差异有显著统计学意义(两组比较,
P
<0.0001)。其中,非透析患者中贫血组比非贫血组高出 0.87 倍(566 元),差异有显著统计学意义(两组比较,
P
<0.0001)。血透患者中贫血组比非贫血组高出 1.97 倍(44 073 元),差异有显著统计学意义(两组比较,
P
<0.0001)。腹透患者中贫血组比非贫血组高出 3.99 倍(38 802 元),差异有显著统计学意义(两组比较,
P
<0.0001)。具体信息详见表 4 及图 2。
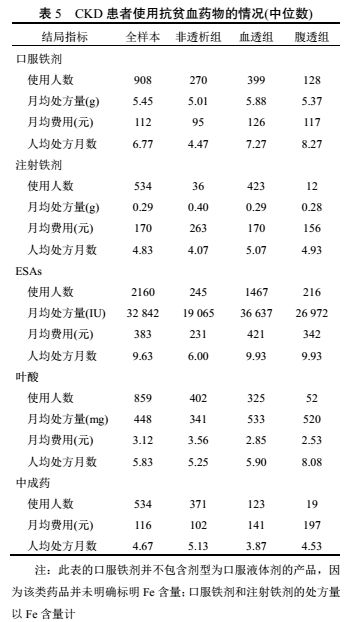
3.3 纠正贫血治疗费用
结果表明(表5),血透组及腹透组各类抗贫血西药中月均费用中位数最高的是促红细胞生成素(ESAs),其次为注射铁剂和口服铁剂,叶酸最低;非透析组各类抗贫血西药中月均费用中位数最高的是注射铁剂,其次为 ESAs 和口服铁剂,叶酸最低;同时,血透组和腹透组中成药的月均费用中位数高于非透析组。重组人促红素注射液(益比奥)是治疗肾性贫血的一种常用药品,CKD合并贫血患者处方益比奥的月均处方量以及月均费用中位数分别为 36 706 IU 和 411 元。另外,各组患者的年均输血次数均为 1 次,次均费用中位数均在750~900 元之间。CKD 贫血患者应用药物治疗时间在 3~9 个月之间,透析治疗组的治疗时间普遍高于非透析治疗组(中成药除外)。
4.1 研究结论
通过对比分析,本研究发现CKD合并贫血患者的经济负担远远高于非贫血患者,可见贫血是加重我国 CKD 患者经济负担的一个重要因素。同时,由于透析患者(无论血透或腹透)的贫血患病率高于非透析患者,因贫血带来的费用增加在透析患者也高于非透析患者,其中的原因可能是由于贫血加重了肾脏疾病进展或者并发症的出现增加了患者的治疗花费
[15-17]
,而且从本研究结果可以看出贫血治疗本身也在一定程度上增加了 CKD 患者的花费。积极治疗及纠正贫血、预防贫血并发症的发生可能是降低我国 CKD 患者经济负担的关键因素之一。
贫血不仅会导致各类并发症,而且是影响住院率和死亡率的重要危险因素,并显著影响 CKD 患者的生活质量
[18]
。因此,CKD 贫血治疗的目的,不仅是纠正患者的贫血,使血红蛋白(Hb)水平达到理想范围,更是减少患者输血、避免多种并发症,最终提高患者生活质量、改善临床预后、实现临床获益
[19]
。目前,治疗肾性贫血的主要药物是促红细胞生成素,同时铁剂及输血是重要的辅助治疗手段。本研究结果显示,ESAs 的月均费用较高,除本研究显示的EASs费用之外,在静脉注射或皮下注射ESAs的过程中也会产生相应的注射费用、交通费用以及家属陪护等成本。本研究结果也反映 CKD 贫血患者治疗贫血时间较短,在 3 个月至 9 个月之间,这可能是治疗不充分的体现。国际透析预后与实践模式研究(DOPPS)结果显示,中国血液透析(HD)患者中 Hb<9 g/dL 比例高于日本和美国,分别为21.0%、10.3%和 2.7%
[20]
,提示目前肾性贫血的控制情况不容乐观,需要更有效的药物治疗。既往研究显示,ESAs 的使用还可能会引起血压升高、血栓形成、心血管事件发生以及产生抗体导致纯红细胞再生障碍性贫血等不良反应
[21]
。因此,寻找新型肾性贫血治疗药物具有十分重要的临床意义。低氧诱导因子(Hypoxia-inducible factors, HIFs)是人体在缺氧环境下产生的一种非常重要的因子,可调节多种基因包括促红细胞生成素(EPO)的表达。HIFs稳定剂为口服制剂,可以有效提高 EPO 浓度,纠正贫血,并且可以降低铁调素水平。目前这类药物进入Ⅲ期临床研究阶段
[22]
,有望成为降低 CKD 患者贫血治疗花费的一类新型药物。
4.2 研究局限性
本研究存在以下局限性:①透析人群中贫血患者占比略低于国内以往研究,这可能是由于有些贫血患者在进行贫血治疗时选择药店购药,而全国医疗保险数据库中并不涉及药房购药数据,因此未能识别该部分贫血患者。②数据来源为真实世界的医疗保险数据,因此医师的处方习惯、各地药品的价格差异、患者的用药依从性以及患者购药行为等因素可能会导致各类抗贫血药物的月均处方剂量和月均费用计算结果存在一定程度的偏倚。另外,由于患者不规律或者停用贫血治疗药物也可能造成贫血患者混入非贫血患者人群,结果可能存在一定程度的偏倚。③部分医院或者城市存在诊断不规范或者不完整(例如疾病诊断仅书写疾病英文缩写)情况,该现象可能导致在检索过程中遗漏部分样本。
总之,慢性肾病患者合并贫血显著增加了慢性肾病患者的疾病负担,积极治疗贫血、预防贫血并发症的发生或许是降低我国 CKD 患者经济负担的关键因素。
参考文献
[1]Stevens PE,et al.Kidney Disease:Improving Global Outcomes Chronic Kidney Disease Guideline Development Work Group Members.Evaluation and management of chronic kidney disease: synopsis of the kidney disease:improving global outcomes 2012 clinical practice guideline[J].Ann Intern Med,2013,158(11):825-830.
[2]Yano Y,Fujimoto S,Asahi K,et al.Prevalence of chronic kidney disease in China[J].Lancet,2012,380(9838):214-216.
[3]谌贻璞.近期欧美肾性贫血诊疗指南的解读与思考[J].中国血液净化,2008,7(7):389-392.














