-治疗带状疱疹的药物Amenalief在日本获批
-韩国首先批准了Invossa-k细胞和基因疗法用于退行性关节炎
2017年7月31日,化合物KPM-2有望用于肿瘤和神经退行性疾病的治疗
NAD依赖的蛋白去乙酰化酶SIRT2属于组蛋白去乙酰化酶家族,尽管其在神经细胞和肿瘤细胞中的功能还没有被完全揭示,但由于它被认为与肿瘤和神经退行性疾病相关联,故针对SIRT2抑制剂的研究具有重要意义。来自Ono Pharmaceutical公司的研究人员和合作者们基于对化合物与SIRT2蛋白的复合物X-ray晶体结构研究发现了一个全新的抑制剂KPM-2。该化合物能够结合在SIRT2的活性位点而发挥活性,形成稳定的KPM-2-ADP-ribose复合物,竞争性的夺取NAD+与蛋白的结合。KPM-2可以抑制癌细胞的增殖和促进神经突起生长。研究结论显示,KPM-2有望用于肿瘤和神经退行性疾病的治疗。(Itoh, Y. et al. 11th AFMC Int Med ChemSymp (AIMECS) (July 23-26, Melbourne) 2017, Abst).
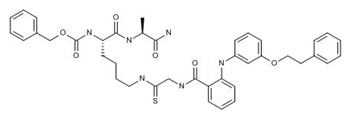
图为KPM-2结构
2017年7月18日,FDA批准Nerlynx用于早期 HER2 阳性乳腺癌的延长辅助治疗
FDA批准了Puma Biotechnology 公司的Nerlynx(来那替尼,Neratinib,曾用代号PB-272),一个日服一次的口服酪氨酸激酶抑制剂,用于成人早期受体酪氨酸激酶ErbB-2阴性/HER2 阳性的乳腺癌在服用曲妥珠单抗(Trastuzumab)后的延长辅助治疗,并将于今年九月份上市。该药的获批基于一项名为ExteNET的有安慰剂对照的多中心随机双盲III期临床试验结果(ClinicalTrials.gov编号NCT00878709)。该研究针对2840 名在2年内使用过Trastuzumab 治疗的HER2 阳性的早期患者进行了为期1年的随机分组治疗:Neratinib组1420人和安慰剂组1420人。两年后的随访表明,94.2%的Nerlynx治疗患者未经历癌症复发或死亡,而安慰剂组的这一比例为91.9%。Neratinib的常见副作用(> 5%)包括腹泻、恶心、腹痛、疲劳、呕吐、皮疹、口腔炎、食欲减退、肌肉痉挛、消化不良、AST 或 ALT 酶升高、指甲疾病、皮肤干燥、腹胀、体重减轻和尿路感染。Neratinib用药组有16.8%由于严重腹泻造成治疗中止,这是导致治疗中止的最普遍副作用。患者在接受Nerlynx 治疗的前 56 天应使用洛派丁胺治疗腹泻,之后按需使用。另有1.7%的用药患者出现肝毒性或转氨酶水平上升。该药目前已提交欧盟并正在评审过程中。(Puma Biotechnology公司新闻稿;FDA新闻稿)。
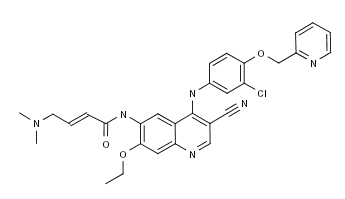
图为Neratinib结构
2017年7月3日,欧盟批准辉瑞的Inotuzumab ozogamicin
辉瑞公司宣布欧盟批准了旗下药物Besponsa(Inotuzumab ozogamicin)单药治疗复发或难治性的CD22+成人的B细胞前驱急性淋巴细胞白血病(ALL)。欧盟批准Besponsa是基于一项名为INO-VATE ALL的临床研究数据,该研究对比了326例复发或难治性B细胞前驱ALL患者随机接受Besponsa或标准化疗的疗效(ClinicalTrials.gov编号NCT01564784)。Besponsa是一个靶向CD22的抗体偶联药物,目前正在FDA的评审过程中,审批期限为今年8月份。(Pfizer公司新闻稿)。
2017年7月21日,BAY-386,一个有望用于治疗动脉血栓的PAR1受体抑制剂
来自拜耳制药的科学家近日发表了一个新颖的PAR1受体抑制剂BAY-386。抗血小板凝结疗法是缺血性脑血管疾病的重要治疗方法。由于PAR1是凝血酶的主要受体,也是重要和有效的血小板激活因子,故寻找靶向该受体的新疗法至关重要。BAY-386被证实是一个口服有效的新型PAR1受体可逆抑制剂。研究人员通过对化合物库的高通量筛选发现了一类苯基哌啶化合物,并进一步优化得到了BAY-386(IC50 = 0.01 mcM)。它对人体血小板的PAR1结合功能活性为0.056 mcM,并可以阻断由血小板激活的下游通路(IC50 = 5.6 mcM)和由凝血酶诱导的炎症细胞因子mRNA和蛋白的表达。该化合物的药代动力学性质证明它具备口服有效性。以上结论表明BAY-386有望成为治疗包括动脉血栓在内的凝血类疾病的PAR1受体抑制剂。(Gerdes, C. et al. 26th CongrInt SocThromb Haemost (ISTH) (Jul 8-Jul 13, Berlin) 2017, Abst PB 2198)。
2017年7月27日,巴比妥酸和硫代巴比妥酸衍生物可用于治疗脱发
脱发常常给病人带来外表方面的困扰。目前仅有非那雄胺(finasteride)和米诺地尔(minoxidil)被FDA批准用于治疗脱发。近日,Pusan National University的团队合成了一系列巴比妥酸和硫代巴比妥酸衍生物并筛选了它们刺激头发生长的效果。在脱毛小鼠的体内试验中,MHY-511,MHY-681,MHY-684,MHY-694和MHY-700这五个化合物可以刺激毛发生长。其中,化合物MHY-684,MHY-694和MHY-700进一步在C57BL/6小鼠模型中评价了药效,它们的作用机理正在进一步研究中。在共计80余个巴比妥酸和硫代巴比妥酸衍生物中,上述三个化合物对比阳性药米诺地尔具有更好的刺激毛发的生长作用,并能够促进人毛乳头细胞的增殖。该研究表明这类化合物有望用于治疗脱发并唤起对这类药物在化妆品用途的研究兴趣。(Kim, S.J. et al. 11th AFMC Int Med Chem Symp (AIMECS) (July 23-26, Melbourne) 2017, Abst).
2017年7月14日,FDA批准Tremfya用于治疗中度至重度的斑块性银屑病
FDA批准了强生旗下Janssen Biotech公司的抗炎药Tremfya(guselkumab)用于适合系统疗法或光疗的中度至重度斑块型银屑病成人患者的治疗。Tremfya是首个也是唯一获批的针对白介素-23(IL-23)具有选择性阻断作用的生物疗法。IL-23是一种细胞因子,在斑块型银屑病中发挥了关键作用。据悉,强生使用了一张优先审评券加速了Tremfya的获批。该药获批得到了一项III期临床项目的支持,包括3个名为VOYAGE 1、VOYAGE 2和NAVIGATE的III期临床研究,共涉及超过2000例患者(ClinicalTrials.gov 编号NCT02207231,NCT02207244和NCT02203032)。该研究证实Tremfya对比安慰剂具有显著的疗效。在治疗的第16周,guselkumab治疗组至少70%的患者实现了至少90%皮肤清晰,超过80%的患者获得了清晰或几乎清晰的皮肤;同时治疗组在头皮部位的银屑病以及包括痒痛、疼痛、刺痛、灼热、皮肤紧实在内的斑块型银屑病症状也实现了显著改善。接近90%的患者在第28周实现PASI90缓解并且持续至第48周,证实guselkumab疗法可以维持持久的药效。在治疗的第24周,Tremfya治疗组超过70%的患者实现至少90%的皮肤清晰,对比Humira治疗组仅为40%。NAVIGATE试验证实了guselkumab对已上市抗炎药Stelara(ustekinumab)应答不足的患者也具有显著的疗效。在Stelara治疗的12周后随机继续Stelara治疗或切换至Tremfya治疗的第28周,Tremfya治疗组有31%的患者达到了皮肤清晰或几乎清晰,而Stelara治疗仅组为14%。(Janssen Biotech公司新闻稿)。
2017年7月11日,长效GLP-1类似物BPI-3016在临床前研究中显示有效
来自Betta Pharmaceuticals的研究人员发现了一个新的长效GLP-1类似物BPI-3016,并进行了针对II型糖尿病治疗的临床前研究。对hGLP-1进行结构优化而得到的BPI-3016被证实显著改善了hGLP-1的半衰期并提高了对DPP4切割的耐受性。在体外研究中,BPI-3016具备对GLP受体的亲和力并能够刺激cAMP的生成。数据表明,BPI-3016对GLP-1受体的亲和力(Ki = 19.4 nM)比GLP-1(Ki = 1.2 nM)稍低;它能够剂量依赖的刺激cAMP的生成(EC50 = 1.80 nM,GLP-1的EC50为0.10 nM)。在体内试验中,BPI-3016在ob/ob小鼠、db/db mice小鼠和自发性糖尿病猕猴模型中评价了对血糖控制,beta细胞数量和体重的影响。猕猴体内药代动力学研究显示BPI-3016的半衰期为95小时。此外,在单次给药后,BPI-3016能够减少禁食和餐后血糖水平并维持活性长达一周。该药也被证明具有降低体重指数和体脂以及改善葡萄糖耐受的能力,并在每周注射一次的七周内持续表现出促胰岛素分泌效应。上述临床前研究结论显示BPI-3016具备GLP-1的功能并具有更长效的作用,有望开发成每周使用一次的II型糖尿病治疗药物。(Ding, L. et al. Pharmacol Res 2017, 122: 130).
2017年7月4日,Mitsubishi Tanabe Pharma公司的Canalia复方片剂在日本获批
Mitsubishi Tanabe Pharma公司获得了日本厚生省对旗下用于治疗II型糖尿病的复方药物Canalia(替格列汀/卡格列净)的生产和销售批准。Canalia是DPP-4抑制剂替格列汀(Tenelia)和SGLT2抑制剂卡格列净(Canaglu)组成的复方药物。替格列汀和卡格列净均是由Mitsubishi Tanabe Pharma公司在日本研发的治疗II型糖尿病的药物。Canalia复方每日服用一次,它结合两种药物并提供了两种不同的治疗机制:DPP-4抑制剂增加胰岛素的释放,SGLT2抑制剂则通过排尿控制血糖浓度。该药在接受Tenelia或Canaglu治疗后血糖水平控制不佳的日本II型糖尿病患者中开展了临床研究,研究数据证实了Canalia的疗效、安全性和耐受性。Canalia对于正在同时服用Tenelia和Canaglu并实现稳定控制血糖水平的II型糖尿病患者可提高服药便利性和治疗依从性;对于接受Tenelia或Canaglu单药治疗血糖水平控制不佳的II型糖尿病患者可更有效的控制血糖。目前,Tenelia由第一三共(Daiichi Sankyo)负责营销,Canaglu则由Mitsubishi Tanabe Pharma负责营销。此次批准的Canalia将由第一三共负责营销并两家公司共同推广。(Mitsubishi Tanabe Pharma公司新闻稿)。
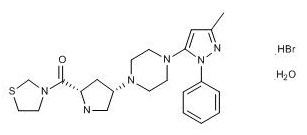
图为替格列汀结构
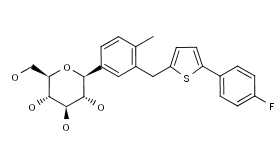
图为卡格列净结构
2017年7月21日,欧盟批准了Dompe公司的滴眼液Cenegermin用于治疗神经营养性角膜炎
欧盟委员会批准了意大利Dompe公司的滴眼液cenegermin用于治疗中度或重度神经营养性角膜炎。Cenegermin是一个重组的人体神经生长因子,可帮助恢复眼睛的正常愈合过程并修复角膜损伤。该药在2015年获得了孤儿药认证。Dompe已经向FDA提交了该药的BLA申请,并正在与日本药品与医疗器械管理局(PMDA)共同讨论其发展计划。
2017年7月10日,Praeventix和Temple University发现了可用于治疗炎症性肠病5-HT7拮抗剂
根据5-HT7拮抗能抑制免疫反应、预防肠道炎症并阻碍炎症性肠病(IBD)进展的假说,来自Temple University和Praeventix公司的研究者们研究了一系列新颖的5-HT7拮抗剂,这项工作最近发表在2017年在费城举行的ACS MEDI-EFMC药化会议中。其中一个先导化合物PR-073显示出了高活性(Ki = 89 nM)和高选择性(> 10 mcM at 5-HT1-6),其小鼠口服生物利用度为17%,半衰期为3.4小时。在急性葡聚糖硫酸酯钠的小鼠IBD模型中,腹腔注射PR-073剂量10 mg/kg连续6天后可以有效降低炎症标志物浓度(髓过氧化物酶、白细胞介素-6、白细胞介素-1beta和TNF-alpha)和肠道损伤。在慢性IBD小鼠模型中,组织学和宏观评价均显示10 mg/kg 的PR-073腹腔注射6天后能够减轻肠道损伤并逆转慢性损伤,证实了之前的假说。对PR-073的进一步研究正在进行中,包括该化合物在脑组织和中枢神经系统中的分布和药效。(Canney, D. ACS MEDI-EFMC Med Chem Front (June 25-28, Philadelphia) 2017, Abst).
2017年7月10日,FDA 批准 Endari 用于镰状细胞病的治疗
FDA批准了Emmaus Life Sciences公司的新药Endari(L-谷氨酰胺口服粉剂)用于 5 岁及以上年龄患有镰状细胞病的患者,用以减轻与该血液疾病相关的严重并发症。Endari可在镰状红细胞中增强烟酰胺腺嘌呤二核苷酸(NAD)的氧化还原电势从而降低氧化应激反应。Emmaus公司计划在今年第四季度将该药推向市场。Endari 的获批基于一项时长48周的有安慰剂对照的多中心随机双盲III期临床研究,共有230名镰状细胞病受试者入组(ClinicalTrials.gov编号NCT01179217)。该药被证实可以降低25%的镰状细胞病风险,并降低33%的住院治疗概率。此外,研究显示该药能够减少41%的住院治疗时间并降低超过60%的急性胸部综合症。Endari的安全性研究共有298名用药组患者和111位安慰剂受试者参加,研究证明该药对儿童和成人均有良好的耐受性,其最常见的不良反应(>10%)为便秘、恶心、头痛、腹痛、咳嗽、四肢疼痛、背部疼痛和胸痛(非心源性)。Endari获得了FDA的孤儿药认证。(FDA新闻稿;Emmaus Life Sciences公司新闻稿)。
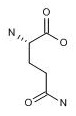
图为L-谷氨酰胺结构
2017年7月31日,欧盟批准艾伯维的Maviret用于治疗慢性丙肝(基因型1-6)
欧盟批准艾伯维的Maviret(glecaprevir/pibrentasvir)每日一剂用于全部6种基因型(GT1-6)慢性丙型肝炎病毒(HCV)成人感染者的治疗。Maviret的批准经过了EMA的加速评审。该药对于没有发生肝硬化的丙肝初治患者仅需8周疗程。此外,Maviret也适用于具有特定治疗挑战的患者群体,如伴有代偿性肝硬化的慢性HCV患者以及目前治疗选择有限的患者,包括伴有严重慢性肾病以及基因型3型的HCV感染者。Maviret的获批基于共计8个已注册的临床试验的数据支持。该药在所有6个基因型HCV感染群体中治疗无肝硬化、初治患者群体在8周内取得了高达97.5%(n=779/799)的病毒学治愈率(SVR12)。Maviret在各类临床背景和病毒学特征的患者亚组中均取得了非常高的病毒学治愈率,包括患有慢性肾病的群体。在伴有肝硬化的患者中,Maviret的12周治愈率为98%(n=201/205)。在有或无代偿性肝硬化的基因型3丙肝患者中,Maviret 16周的治愈率为96%(n=66/69)。在所有注册研究中,该药的停药率少于0.1%,最常见的不良事件(发生率≥10%)为头痛和疲劳。其中,复方之一的Glecaprevir是由Enanta Pharmaceuticals公司发现的第二个蛋白酶抑制剂,由艾伯维开发和推向市场。(艾伯维公司新闻稿;Enanta Pharmaceuticals公司新闻稿)。
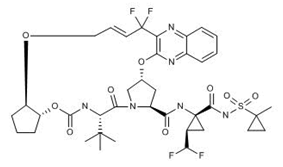
上图为Glecaprevir结构
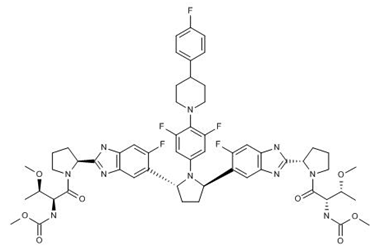
上图为Pibrentasvir结构
2017年7月27日,Vosevi在美国上市销售
吉利德的抗HCV新药Vosevi(sofosbuvir/velpatasvir/voxilaprevir三联方)目前已经在美国上市,由Diplomat Pharmacy负责销售。该复方片剂可用来治疗没有肝硬化或有代偿性肝硬化且以前接受过含NS5A抑制剂的治疗方案的成人慢性丙型肝炎病毒所有基因型造成的感染。Vosevi也可用于以往接受过含sofosbuvir但不含NS5A抑制剂治疗方案的基因型1a或3丙肝成人感染的治疗。(Diplomat Pharmacy公司新闻稿)。
2017年7月19日,FDA批准新药Vosevi用于慢性丙型肝炎的再治疗
FDA批准了吉利德公司的新药Vosevi(索非布韦,sofosbuvir 400 mg/维帕他韦,velpatasvir 100 mg/和voxilaprevir 100 mg的复方制剂),用于治疗接受过含NS5A抑制剂方案治疗失败的全部6种基因型的丙肝成人感染者的再治疗和接受过含sofosbuvir但不含NS5A抑制剂方案治疗失败的基因型1a或3丙肝成人感染者的再治疗。FDA授予了该药优先评审资格和突破性疗法认证。该药的基于两个3期临床试验POLARIS-1(ClinicalTrials.gov编号NCT02607735)和POLARIS-4,研究评估了Vosevi 12周治疗方案对无肝硬化或有代偿性肝硬化患者的安全性和有效性。两项研究中共计353位Vosevi受试者中的340位达到了主要临床终点SVR12,即治疗结束后在12周内可维持体内病毒未检出状态。Vosevi带有一个安全性警告,指出HCV/HBV的合并感染患者需要注意HBV的复发风险。(Gilead Sciences公司新闻稿;FDA新闻稿)。
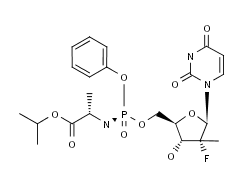
上图为Sofosbuvir结构
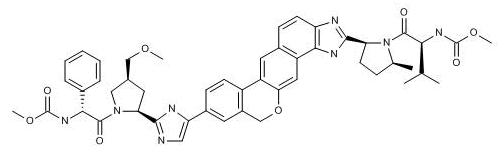
上图为Velpatasvir结构
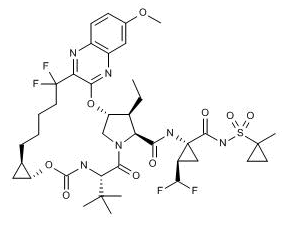
上图为Voxilaprevir结构
2017年7月5日,治疗带状疱疹的药物Amenalief在日本获批
日本厚生省批准了Maruho公司的新药Amenalief(amenamevir,200mg片剂)用于治疗带状疱疹。. Amenalief是由AstellasPharma公司研发的具有新颖作用机制的抗疱疹病毒药物。它通过抑制病毒复制过程中的关键步骤—螺旋酶复合物的活性,从而阻断病毒的增殖。Maruho公司自2012年起从 Astellas公司获得授权,对Amenalief进行了后续的开发并成功的将其推向日本市场。(Maruho公司新闻稿)。
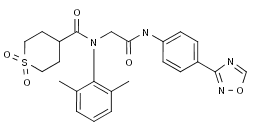
图为Amenamevir结构
2017年7月13日,韩国首先批准了Invossa-k细胞和基因疗法用于退行性关节炎
TissueGene公司宣布其在韩国的合作伙伴Kolon Life Science公司获得了韩国药监局对Invossa-K(tonogenchoncel-L)的上市批准,这是一种针对退行性关节炎的同种异体细胞的基因疗法。该药的批准得到了一项临床III期研究的支持,结论证实了经过一次关节注射后,患者的减轻疼痛,关节的活动性增加且关节结构得到了改善。(TissueGene公司新闻稿)。
延伸阅读:
【Drug News】2017年6月药物快讯 — 帮助您及时把握药物研发动态
【Drug News】2017年5月药物快讯 —— 帮助您及时把握药物研发动态
【Drug News】2017年4月药物快讯 — 帮助您及时把握药物研发动态
【Drug News】2017年3月药物快讯 — 帮助您及时把握药物研发动态
【Drug News】2017年2月药物快讯汇总—— 帮助您及时把握药物研发动态
【Drug News】2017年1月药物快讯汇总——帮助您及时把握药物研发动态
科睿唯安(原汤森路透知识产权与科技集团事业部)对本文的全部内容以及可能附带的全部资料拥有全部知识产权,并受法律保护。网络转载、编译及其他商业使用请联系市场部:[email protected]
点击【阅读原文】可查看该药物快讯中英文网页版。
■ 每周一至五, Clarivate Analytics药物新闻(Clarivate Analytics Drug News)精选最新、最重要的药物研发新闻在线发布,并以简明扼要的格式发送提醒邮件至您的邮箱,帮助您快速锁定重要的新闻事件。
■ 您可以在线检索我们所有的新闻资源,并设定检索条件(限定新闻发生的时间、药名、专利号、公司、大学、机构、治疗类别/分组、化合物类型、信息源)找到与您研究相关的内容。药物新闻(Drug News)内容可回溯至1996年,并可查看化学结构式。
■ 从海量信息源中总结出的摘要报告。
■ 在全球重要会议中披露的新闻信息。
■ 每周更新的邮件提醒服务,以表格的形式告知您进入临床前开发最有前景的化合物、lead compounds和最新的作用机制。
■ 每周更新的邮件提醒服务,告知您在研药物研发状态的变更。















