Notch
信号通路是多细胞生物体内一类高度保守的信号通路,通过参与细胞间相互作用介导外界环境对细胞的影响和调控,在生物体的早期发育中程序性地操控细胞的命运和组织的分化。而在多种癌症中,该类通路的程序性以各种形式受到破坏,对癌细胞的增殖、抗凋亡、血管新生等多种特征的形成和维持起到一定的促进作用。本文即简述
Notch
信号通路与癌症的关系,并对基于该信号通路的药物研发状况作一个梳理。
Notch
信号通路简介
Notch
信号通路的激活涉及两个部分:
Notch
受体和
Notch
配体。
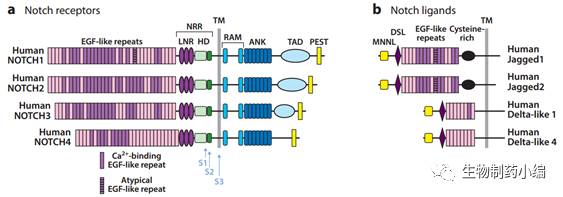
Notch
受体
是一类单次跨膜蛋白。其胞外段(
N
端)由
EGF
样重复片段和一个近膜区的负向调节区域(
NRR
)构成,而
NRR
是由
3
个
Lin12/Notch
重复片段和
1
个异二聚化区域(
HD
)组成。胞内段通常由一段蛋白结合
RPBJ
相关分子(
RAM
)区域、
7
个锚蛋白重复片段、
1
个转录激活区域(
TAD
)和
1
个
PEST
(富含脯氨酸、谷氨酸、丝氨酸和苏氨酸)降解决定子区域构成。在哺乳动物中,
Notch
受体有
4
种类型(
Notch1-4
),它们在胞外段的区别集中在
EGF
样重复片段区域;在胞内段中,
Notch4
缺失
TAD
区域(如下图)。在表达分布方面,
Notch1
和
Notch2
表达较为广泛,存在于多种处于发育阶段和成熟后的器官中;
Notch3
主要分布在血管平滑肌和血管周围细胞中,
Notch4
主要高表达于血管内皮细胞中。
在哺乳动物中,功能性的
Notch
配体
有
4
种,即
Delta
家族的
DLL1
、
DLL4
(
DLL3
为非典型的配体),
Serrate
家族的
JAG1
、
JAG2
,均为单次跨膜蛋白。人体中的这
4
个蛋白的结构如下图。相对于
Notch
受体,
Notch
配体的表达分布情况人们还没有清楚的认识。
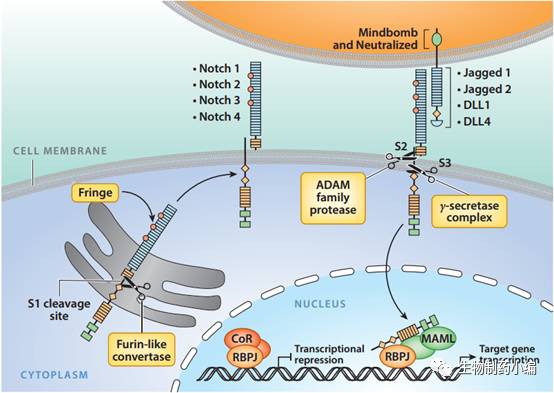
Notch
受体的成熟和激活是基于
3
种不同的蛋白酶:
Furin
样蛋白酶、
ADAM
金属蛋白酶家族和γ
-
分泌蛋白酶。
在
Notch
受体被从高尔基体向细胞膜转运的过程中,
Furin
样蛋白酶在其
HD
区域切割将其切割为成熟且非激活的非共价异二聚体;当膜表面的
Notch
受体与相邻细胞表面的配体结合后,构象改变,暴露出酶切位点,被
ADAM
金属蛋白酶切割;紧接着,γ
-
分泌蛋白酶切割其跨膜区域,从而释放其胞内区域。从膜上被释放后,
Notch
受体的胞内区域进入细胞核,在其他蛋白的辅助下,启动
Notch
相关基因的转录。
虽然
Notch
信号通路原理较简单,但与其相关的机体生命过程则非常多样。它参与机体多个组织和器官的早期发育和功能维持,如神经元的发育和功能、骨发生过程中造血干细胞的扩增和成骨细胞的形成、
T
细胞的分化、动脉内皮细胞的稳态维持和血管新生等等。
Notch
信号通路与癌症的关系
在多种类型癌症中,
Notch
信号通路平衡受到破坏,而这种破坏主要体现在
3
个方面:
Notch
受体的突变
基于对多种癌症的
Notch
受体基因进行的测序结果,
Notch
受体基因的突变情况可大致分为
3
种模式:
-
第一种是
NNR
区域的突变,导致
Notch
受体发生非配体依赖的酶切和激活。有时
候,PEST区域也同时会有突变。
-
第二种是
PEST
区域单独发生突变,使得
Notch
受体不易被降解。
-
第三种是
Notch
受体发生失活型的突变,显示其具有肿瘤抑制作用的一面。
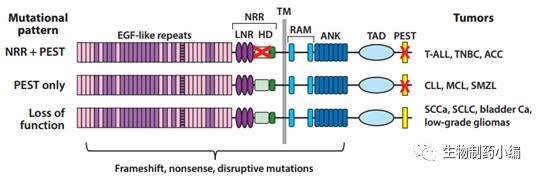
根据统计,第一种类型的突变主要发生于
T
细胞急性淋巴母细胞白血病、血管球瘤、乳腺癌等癌症中,其中
T
细胞急性淋巴母细胞白血病的
Notch1
突变频率较高,而血管球瘤的
Notch2
突变频率较高。
Notch3
的突变在这几种类型的癌症中都很少。
第二种类型的突变发生在各类白血病、淋巴瘤中,其中以
B
细胞相关白血病
/
淋巴瘤为主。突变位置在
Notch1
或
Notch2
上。
第三种类型的突变主要发生在鳞状上皮癌、小细胞肺癌、尿路上皮癌等癌症中,其中鳞状上皮癌中主要是
Notch1
和
Notch2
的突变,小细胞肺癌和尿路上皮癌则涉及
Notch1/2/3的
突变。
当然这只是部分工作,相信
Notch
受体的突变型在癌症中的分布比上述总结所提到的更加广泛和复杂。
Notch
受体的突变增加了该信号通路的自主性或对外在环境的敏感性,从而导致了下游信号的异常。
Notch
受体下游信号通路其他组分的突变
Notch
下游信号通路中的突变也在一些癌症中被检测到,如经常性的
RBPJ
基因拷贝数缺失和
RBPJ
蛋白表达丧失在部分癌症尤其是一些乳腺癌中被发现。但整体而言,这一类突变较为少见,
Notch
信号通路中的突变集中在
Notch
受体上。
Notch配
体的过表达
Notch
配体中,根据文献报道在多种癌症中过表达的主要是
DLL4
,其作用主要是促进肿瘤细胞的血管生成。另外一个比较特殊的是
DLL3
,它不是
Notch
受体的典型配体,被发现在小细胞肺癌和大细胞神经内分泌癌患者的癌细胞表面有表达,而在正常组织中检测不到,是一个创新的小细胞肺癌的靶点。
以上
3
种原因单独或共同导致了
Notch
信号通路的异常。而根据
Blacklow
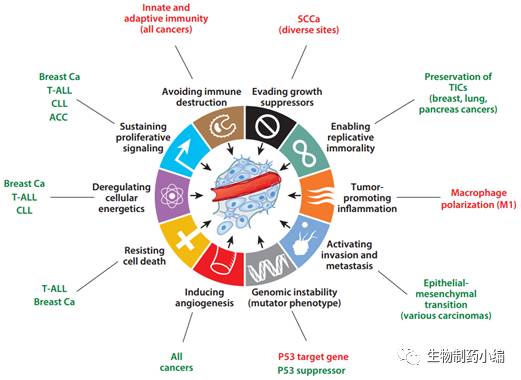
教授的综述的总结,异常的
Notch
信号通路在癌症中所起的作用主要包括:促进癌细胞增殖,帮助癌细胞生存、调节癌细胞的命运决定,维持癌细胞的干性,增加细胞基因组不稳定性,介导癌细胞与基质细胞的相互作用,等等。另外,
Notch
信号通路也具有抑癌作用,在部分癌症中,
Notch
信号通路发生了失活突变。
Notch
信号通路相关的药物研发情况
靶点和适应症整体分析
整理目前在研的
Notch
信号通路相关的抗癌药物,总结这些药物针对的靶点,如下:
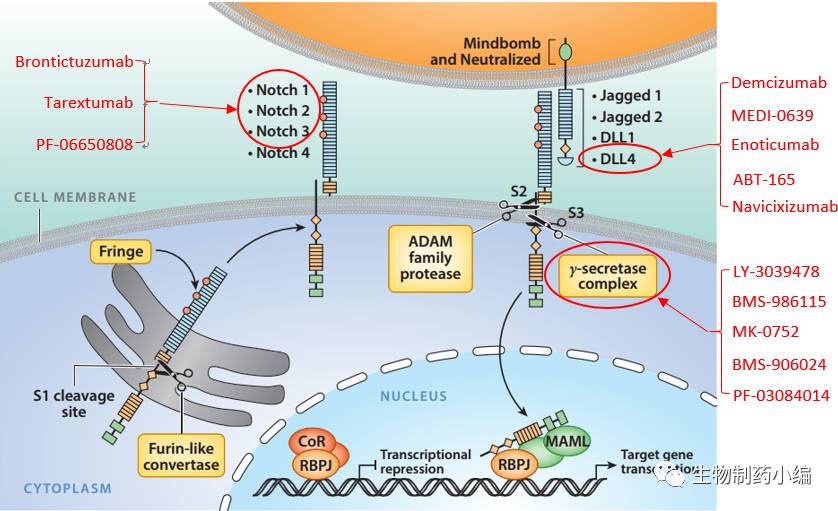
胞外的药物靶点包括
3
种
Notch
受体和
1
种
Notch
配体:
3
种
Notch
受体分别为
Notch1
、
Notch2
和
Notch3
,因为癌细胞中
Notch
受体的突变主要发生在这
3
个受体上,它们与癌症的关系相对紧密,因此成为药物靶点。
成为靶点的经典
Notch
配体只有
DLL4
,因为目前的基础研究表明这个配体与各类癌症的关系最为明显。研究表明,
DLL4
主要参与癌细胞的血管生成。
胞内靶点只有
γ-
分泌蛋白酶,信号通路中的其他组分则没有成为临床在研药物的靶点。
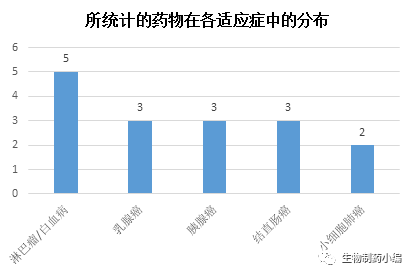
从所统计的药物涉及的适应症类型来看(以
ClinicalTrials.gov
数据为准,剔除已暂停或终止的适应症),除了晚期实体瘤以外(因为一期临床通常不明确区分癌症类型),药物分布最多的
5
个适应症分别为淋巴瘤
/
白血病、乳腺癌、胰腺癌、结直肠癌和小细胞肺癌。
抗体药物
统计到的在研抗体药物的情况如下表所示,共
9
个。
|
药物
|
公司
|
靶点
|
适应症
|
研发阶段
|
|
Brontictuzumab
|
GSK
|
Notch1
|
复发或难治型淋巴瘤等
|
临床一期
|
|
Tarextumab
|
GSK
|
Notch2
Notch3
|
四期胰腺癌等
|
临床二期
|
|
PF-06650808
|
辉瑞
|
Notch3
|
晚期实体瘤
|
临床一期
|
|
Rovalpituzumab tesirine
|
Stemcentrx/
艾伯维
|
DLL3
|
小细胞肺癌等
|
临床三期
|
|
Demcizumab
|
GSK
/
新基
|
DLL4
|
胰腺癌等
|
临床二期
|
|
MEDI-0639
|
阿斯利康
|
DLL4
|
晚期实体瘤
|
临床一期
|
|
Enoticumab
|
再生元
赛诺菲
|
DLL4
|
晚期实体瘤
|
临床一期
|
|
ABT-165
|
艾伯维
|
DLL4
VEGF
|
晚期实体瘤
|
临床一期
|
|
Navicixizumab
|
OncoMed Pharmaceuticals /
新基
|
DLL4
VEGF
|
晚期实体瘤等
|
临床一期
|
已进入三期临床的只有
Stemcentrx
与艾伯维合作开发的
Rovalpituzumab tesirine
,它是由抗
DLL3
的单克隆抗体和
DNA
小沟结合剂
PBD
偶联而成的
ADC
药物。目前各期临床研究的适应症基本为小细胞肺癌,但
Stemcentrx
也在尝试多种癌症类型(
NCT02709889
)
。这个项目相对特殊,因为
DLL3
不属于经典的
Notch
配体,而且
Rovalpituzumab tesirine
以
DLL3
为靶点是基于其在部分肿瘤上的特异性表达而非功能。
其余的项目均在一期或二期阶段。从靶点上看,
Notch
受体方面,
Notch1/2/3
均有涉及;
Notch
配体方面,均为
DLL4
,其中艾伯维的
ABT-165
和
OncoMed Pharmaceuticals /
新基的
Navicixizumab
都是同时靶向
DLL4
和
VEGF
的双特异性抗体。
Brontictuzumab
和
Tarextumab
分别针对
Notch1
和
Notch2/Notch3
,两者均为
OncoMed Pharmaceuticals
最初研发并均在
2007
年由葛兰素史克获得全球开发和商业化权利。其中
Tarextumab
于
2014
年被
FDA
授予小细胞肺癌和胰腺癌的孤儿药资格。
辉瑞的
PF-06650808
为抗
Notch3
单克隆抗体与奥瑞他汀(微管抑制剂)偶联而成的
ADC
药物,目前处于临床一期,用于治疗多种实体瘤。
Demcizumab
由
OncoMedPharmaceuticals
最初研发,之后其全球开发和商业化权利转移至葛兰素史克和新基。它靶向
DLL4
,用于胰腺癌等实体瘤的治疗。
2014
年,它被
FDA
授予胰腺癌孤儿药资格。
MEDI-0639
和
Enoticumab
也针对
DLL4
,用于晚期实体瘤等适应症的治疗,但整体不顺利,多个临床试验已经被终止。
ABT-165
和
Navicixizumab
均为同时靶向
DLL4
和
VEGF
的双特异性抗体,其设计是基于
DLL4
可促进肿瘤细胞血管新生的基础发现。同时抑制
DLL4
和
VEGF,
理论上可以增强药物对血管生成的抑制效果。这
2
个药物目前均处于一期临床。
小分子药物
小分子方面,具有代表性的在研药物列表如下:
|
药物
|
公司
|
靶点
|
适应症
|
研发阶段
|
|
LY-3039478
|
礼来
|
γ-分泌蛋白酶
|
T细胞淋巴母细胞淋巴瘤
|
临床二期
|
|
BMS-986115
|
百时美施贵宝
|
γ-分泌蛋白酶
|
晚期实体瘤
|
临床一期
|
|
MK-0752
|
默沙东
/NCI
|
γ-分泌蛋白酶
|
转移性乳腺癌等
|
临床二期
|
|
BMS-906024
|
百时美施贵宝
|
γ-分泌蛋白酶
|
实体瘤等
|
临床一期
|
|
PF-03084014
|
辉瑞
|
γ-分泌蛋白酶
|
硬纤维瘤等
|
临床二期
|
从小编检索到的小分子药物来看,靶点无一例外都是γ
-
分泌蛋白酶。究其原因,可能是该信号通路的性质。
Notch
信号通路较为直接,
3
步酶切激活之后,成熟的
Notch
受体直接参与基因转录,胞内过程只涉及简单的蛋白间相互作用,并无酶类参与。因此,可以作为小分子药物靶点的基本只有γ
-
分泌蛋白酶。
目前的临床在研的小分子药物均处于较早期的阶段,表中礼来的
LY-3039478
、默沙东的
MK-0752
、辉瑞的
PF-03084014
已进行到临床二期,但这几个药物的所有临床试验整体情况并不十分顺利。
结语
通过对
Notch
信号通路的抗癌药物研发情况的梳理,小编得到了不少启发,也有一些思考。
首先是基因筛查对治疗方法选择的指导作用。如前文所述,各种类型的
Notch
受体突变广泛存在于多种癌症中并且分布具有一定的偏向性,因此做肿瘤基因筛查时,
Notch
受体的突变情况可以作为一项检测指标。当确定癌细胞上具有
Notch
受体的某种突变型时,我们可以考虑单独或联合使用针对
Notch
信号通路的药物进行治疗。在精准医疗的巨大风口上,这是一个顺应趋势同时也是合理的策略。
其次是联合用药的尝试。当
Notch
信号通路的突变与其他的癌细胞特征共存时,可以考虑将针对
Notch
信号通路的药物与其他抗癌药物联用,尝试更有效的治疗组合。这也符合未来的治疗趋势。
最后是关于针对
Notch
信号通路的药物的可能副作用的探讨。
2015
年发表在《
Nature
》上的文章
Therapeutic antibodies reveal Notch control of trans differentiation in the adult lung
报道了科研人员利用抗
JAG
抗体将小鼠肺部的杯状细胞转分化为纤毛细胞,并且证明这是一个不涉及细胞增殖的直接转分化。
Notch
信号通路作为一个高度保守的直接调控转录的上游信号通路,相比激酶受体、生长因子受体等,对细胞命运的决定更加广泛和深刻,对它的调控和干扰对生命机体的影响更加深入和复杂。因此,以这样的信号通路作为靶点,需要慎重。另外,靶点功能的非特异性也是需要考虑的问题。如γ
-
分泌蛋白酶,其底物除了
Notch
受体之外,还有
CD44
、
ErB4
、
E-Cadherin
等,阻断该靶点会对细胞表面的微环境造成巨大的干扰,其副作用也是不可回避。从以往的研发情况来看,
Notch
信号通路的药物研发终止率确实很高。
当然,随着人们对基础问题的理解的加深,药物研发策略会趋于精细和合理。希望研发人员在这一领域能有能多的收获,更大的成功。
参考文献
[1] Aster J C,et al., The Varied Roles of Notch in Cancer. Annu Rev Pathol. 2017 Jan 24;12:245-275
[2] Rossi A, Rovalpituzumab tesirine and
DLL3: a new
challenge for small cell lung cancer. Lancet Oncol. 2017 Jan; 18(1):3-5
[3] Therapeutic antibodies reveal Notch controlof transdifferentiation in the adult lung. Nature. 2015 Dec 3; 528(7580):127-31
[4] 药渡、ClinialTrials.gov等网站
欢迎加入小编团队成为小编一员
请加小编微信号:wuwenjun7237
如有技术解读、行业洞见愿意分享
欢迎投稿到小编邮箱:
[email protected]

版权为生物制药小编所有。欢迎个人转发分享。其他任何媒体、网站如需转载或引用本网版权所有内容须获得授权且在醒目位置处注明“转自:生物制药小编”。

坚持原创、坚持专业
欢迎关注
生物制药小编
投稿信箱:[email protected]
小编团队现有13位成员:
Armstrong、医药局外人、Fairy、
Jone、
东胜西牛、Alpharesearcher、MT、百草、
Irene、北望、蛋白工人、At.Zhou、Julia
欢迎有共同兴趣的朋友加入





