小伙伴们,好久不见,甚是想念!今天馆长带来了一篇可谓大家心心念念的文章——
中医药
。这时肯定就有小伙伴们疑惑了,我也知道现在刮起了这研究风,但中医药那么多靶点,该怎么下手呢,怎么搭上这辆顺风车呢,不急,今天馆长就给各位掰扯清楚。
小伙伴们,好久不见,甚是想念!今天馆长带来了一篇可谓大家心心念念的文章——
中医药
。这时肯定就有小伙伴们疑惑了,我也知道现在刮起了这研究风,但中医药那么多靶点,该怎么下手呢,怎么搭上这辆顺风车呢,不急,今天馆长就给各位掰扯清楚。
该
研究团队以
甲状腺癌(TC)和黄独(DBL)作为切入点,采用网络药理学技术、分子对接和体外细胞实验验证DBL是否具有治疗PTC的潜力。
这篇文章巧妙地结合了中医药多靶点和网络药理学的优势如DBL抗TC靶点的整合、功能富集和PPI网络的构建,在投入成本较小的情况下,系统性探究了DBL的潜力。此外,作者还以体外细胞试验、细胞周期分析和铁死亡的角度再次验证了上述生信结论。快准狠,可复现性极高YYDS!
Ps:文章原文信息已放至文末,小伙伴们自行查看哦~
!
Ps:文章原文信息已放至文末
(
ps:中医药方向这顺风车必须搭上,我说的!谁来劝都不管用。感兴趣的小伙伴快来扫码联系馆长!)
定制生信分析
云服务器租赁
加好友
备注“99”
领取试用

l
题目:基于网络药理学和实验验证的黄独通过铁死亡和PI3K/AKT通路抗甲状腺乳头状癌作用
l
杂志:
Journal of Ethnopharmacology
l
影响因子:IF=4.8
l
发表时间:2024年2月
研究背景
甲状腺癌(TC)
是最常见的内分泌恶性肿瘤之一,其全球发病率呈持续上升趋势,其中甲状腺乳头状癌(PTC)是最常见的组织学亚型。在PTC的临床治疗中,通常采用手术切除PTC病变从而减轻临床症状,但有研究表明PTC术后易发生颈部淋巴结转移。因此,进一步加强对PTC的研究势在必行。近年来,中医药如
黄独(DBL)
以其疗效持久、副作用小、多靶点和全面性调控等综合特点,在PTC的防治中显示出优势,但作用机制尚不是非常明确。因此,在这个研究中,作者采用网络药理学技术、分子对接和体外细胞实验验证DBL是否具有治疗PTC的潜力中药。
数据来源
|
数据集/队列
|
数据库
|
数据类型
|
详细信息
|
|
GSE3467
|
GEO
TCMSP
GeneCards
|
RNA-seq
靶点数据
|
DBL有效成分及其和PTC潜在靶点
|
研究思路
首先,作者分别从
TCMSP和GeneCards数据库
收集DBL的化学成分并鉴定其靶点和PTC相关疾病靶点,取交集后构建
活性成分和靶基因网络
。随后作者以
PTC细胞系
TPC-1和BCPAP以及正常甲状腺上皮细胞系Nthyori3-1验证DBL是否具有治疗
PTC
的潜力,并通过
PPI网络分析、分子对接分析、功能富集和流式细胞仪
等方法探究两者的作用机制。
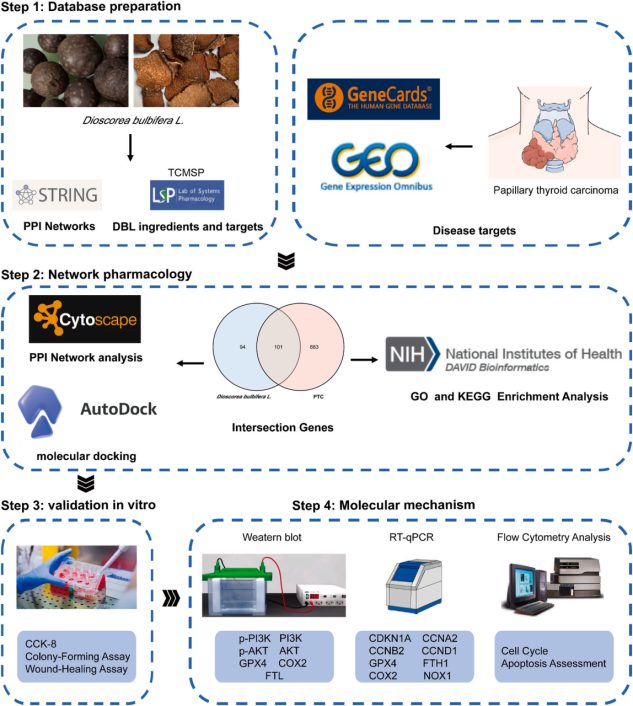
图1 技术路线
主要结果
1.
DBL治疗PTC的潜在治疗靶点和成分的鉴定
首先,作者从TCMSP数据库中收集到DBL中的116种化学成分,并鉴定出14种具有靶点相互作用的有效成分和195个DBL靶点。随后在GeneCards数据库中作者检索到10,625个PTC相关疾病靶点。对DBL有效化学成分靶基因与PTC相关疾病靶点取交集。结果表明195个DBL靶点中有127个与PTC有关,这表明DBL对PTC具有显著的治疗潜力(图2A-B)。
使用Cyto-scape 3.8.0构建活性成分和靶基因网络(图2C)。
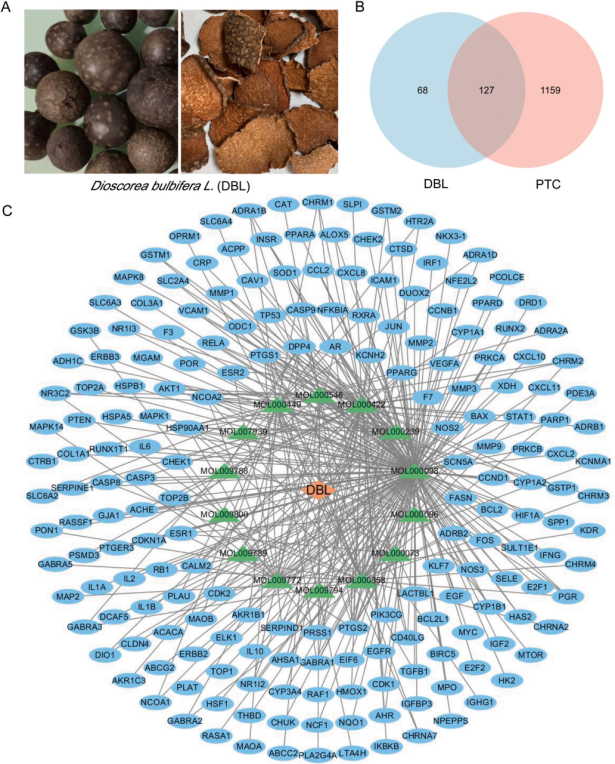
图2 DBL治疗PTC的潜在治疗靶点和成分的鉴定
2.体外细胞试验
为了进一步验证DBL对PTC的影响,作者以PTC细胞系TPC-1和BCPAP以及正常甲状腺上皮细胞系Nthyori3-1为研究对象。用不同浓度的DBL处理它们并孵育48小时。使用CCK-8法评估细胞活力。结果表明,高浓度的DBL开始对TPC-1和BCPAP的细胞活力表现出剂量依赖性和时间依赖性的抑制作用(图3A-D)。
集落形成和划痕实验的结果进一步表明DBL可以显著抑制PTC细胞的增殖和迁移(图3E-F)。以上结果显示了DBL治疗PTC的显著潜力。
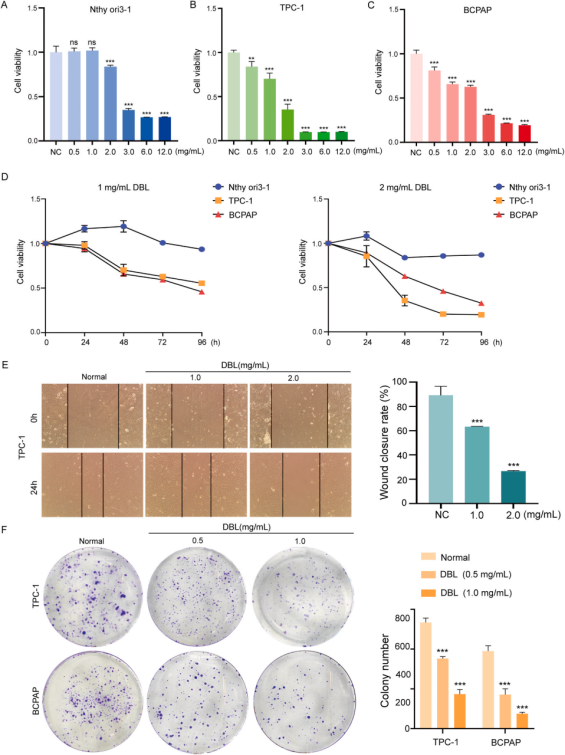
图3 体外细胞试验
3.
PPI网络分析和RT-qPCR分析
为了深入研究DBL在PTC中的作用机制,作者对195个DBL靶基因、127个药物-疾病基因交叉基因和347个PTC相关基因进行PPI网络分析,并以度、中间中心性和接近中心性作为参考指标确定了枢纽基因(图4A-C),最后共得到了11个关键基因(图4D)。此外作者通过对外部PTC测序数据筛选了关键差异表达基因如STAT1、CDKN1A、TGFB1和VEGFA(图4E-F)。
RT-qPCR结果显示DBL显著降低了PTC细胞中STAT1、VEGFA和TGFB1的表达,显著增加了CDKN1A的表达(图4G)。
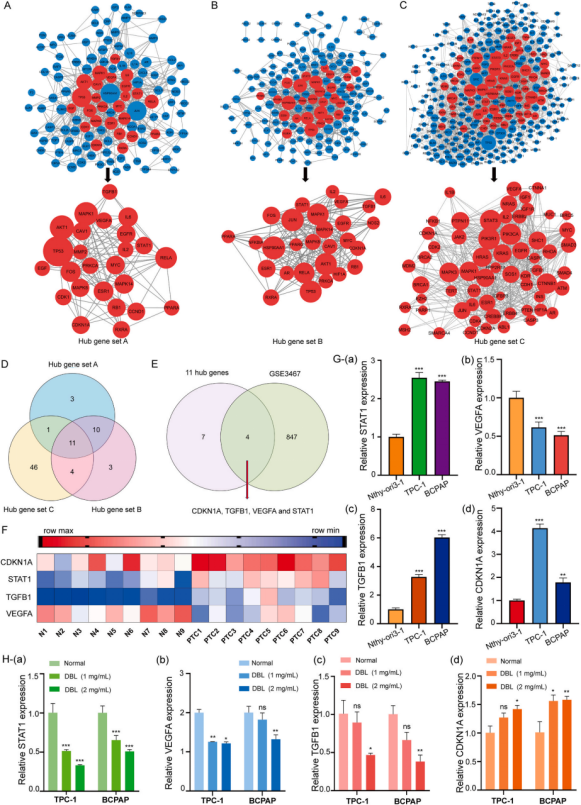
图4 PPI网络分析和RT-qPCR分析
4.分子对接、功能富集和Western blot分析
接着作者对四个关键基因即CDKN1A、STAT1、TGFB1和VEGFA和四种关键活性化合物槲皮素、β -谷甾醇、薯蓣皂苷元和山奈酚进行了分子对接分析(图5A)。结果表明四种核心化合物与其对应的靶蛋白之间具有高度有利的结合亲和力(图5B-I)。这证实了上述化合物与其靶蛋白之间的相互作用,揭示了其良好的治疗前景。为了揭示DBL在PTC背景下的潜在作用机制,作者利用DAVID数据库对交叉基因进行了GO和KEGG富集分析。结果表明,DBL主要作用于细胞质和细胞膜等细胞组分(图6A-B)。
Western blot研究结果显示,与Nthy-ori3-1细胞相比,TPC-1和BCPAP细胞中PI3K和AKT的磷酸化水平显著升高(图6C-E)。然而DBL的应用使PTC细胞中PI3K和AKT的磷酸化水平显著降低(p < 0.01,图6F-I)。

图5 分子对接分析

图6 功能富集和Western blot分析
5.作用机制分析
此外该研究团队通过流式细胞仪等研究发现了细胞周期和铁死亡是DBL改变PTC细胞活性的重要途径(图7A)。DBL触发CDKN1A的高表达,同时抑制CCNA2、CCNB2和CCND1的表达。另外作者证实了DBL具有在G2/M期停止TPC-1和BCPAP细胞周期进程的能力(图7B-E)。
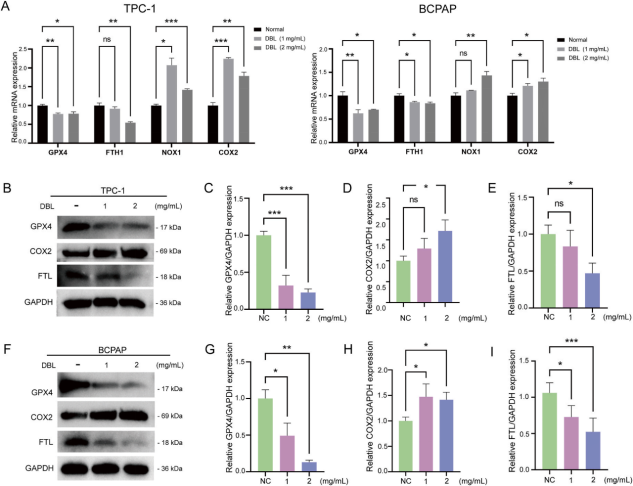
DBL提取物能够显著抑制GPX4和FTH1的表达,同时增加NOX1和COX2的表达(图8),这表明其对铁死亡相关因子的表达是显著的。而Western blot结果进一步证实了上述发现。
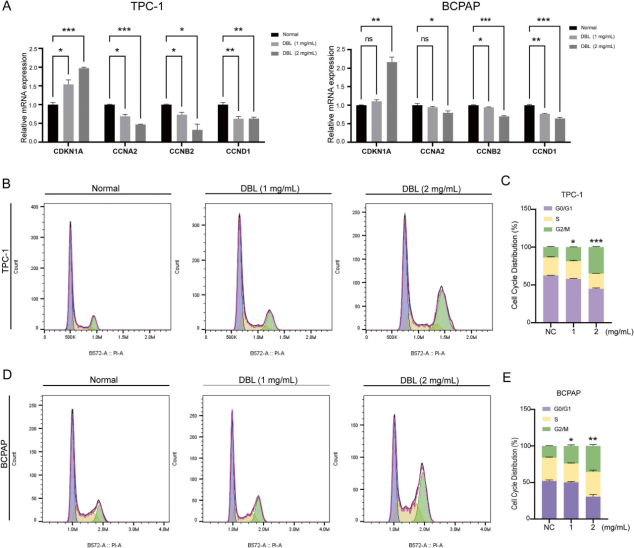
图7 细胞周期分析