肺结核(tuberculosis,TB)是一种侵袭肺部的传染病,全球每20秒就有一个人的生命被肺结核夺走,每年导致150万人死亡。长达一个多世纪以来,研究人员未能找到一种治愈TB的方法。幸运的是,在一项最新的研究中,来自加拿大蒙特利尔大学等研究机构的研究人员可能已发现一种新的武器来对抗这个全球性的杀手,他们
通过对造血干细胞进行重新编程,让免疫细胞杀死导致肺结核的结核分支杆菌(mycobacterium tuberculosis,Mtb)。
来自麦吉尔大学健康中心研究所的Maziar Divangahi博士说道,当前可用的卡介苗有效性低,而抗生素治疗是有毒性的,同时会导致耐药性肺结核菌菌株产生,因此如果不研究出新的替代方法,结核菌将对人类健康带来大麻烦。通过与蒙特利尔大学遗传学家Luis Barreiro博士及其团队合作,研究人员分析和鉴定出了涉及触发对肺结核菌产生增强的先天性免疫应答的基因组通路。
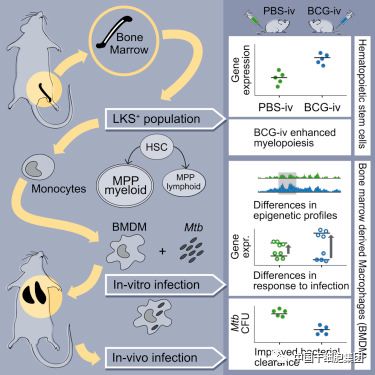
此前生产结核疫苗的努力主要集中在T细胞上,但是这些结核疫苗在临床前和临床试验中的结果都不尽如人意。Divangahi和Barreiro研究团队首次证明,当卡介苗以能够到达骨髓的方式给予小鼠时,它能够重编程小鼠造血干细胞,使其增殖并分化产生能杀伤肺结核菌的巨噬细胞。造血干细胞负责产生所有的免疫细胞,包括我们的先天性免疫系统中的细胞,这是抵抗肺结核的第一道防线。其中,巨噬细胞是一种吞噬和杀死入侵的肺结核菌等细菌的白细胞类型,是先天性免疫系统中的第一批免疫应答者。然而,肺结核菌会破坏巨噬细胞的杀伤程序,并将它们作为一种“避难所”进行复制和生长。在卡介苗促进造血干细胞增殖和免疫应答的分子机制方面,研究人员证实这些保护性程序是通过造血干细胞的遗传标记传递给巨噬细胞的,这些遗传标记经过分子信号通路的激活后会强化巨噬细胞杀伤肺结核菌的过程。
Divangahi博士表示,接下来的研究应充分利用造血干细胞在抵抗传染病时的免疫应答作用,
希望通过造血干细胞改造及其分化而来的巨噬细胞强化来开发新型结核疫苗,增强人体先天免疫记忆。
推荐阅读原文:
BCG Educates Hematopoietic Stem Cells to Generate Protective Innate Immunity against Tuberculosis.
The dogma that adaptive immunity is the only arm of the immune response with memory capacity has been recently challenged by several studies demonstrating evidence for memory-like innate immune training. However, the underlying mechanisms and location for generating such innate memory responses in vivo remain unknown. Here, we show that access of Bacillus Calmette-Guerin (BCG) to the bone marrow (BM) changes the transcriptional landscape of hematopoietic stem cells (HSCs) and multipotent progenitors (MPPs), leading to local cell expansion and enhanced myelopoiesis at the expense of lymphopoiesis. Importantly, BCG-educated HSCs generate epigenetically modified macrophages that provide significantly better protection against virulent M. tuberculosis infection than naive macrophages. By using parabiotic and chimeric mice, as well as adoptive transfer approaches, we demonstrate that training of the monocyte/macrophage lineage via BCG-induced HSC reprogramming is sustainable in vivo. Our results indicate that targeting the HSC compartment provides a novel approach for vaccine development.













