作者:仲夏秋夜云 来源:蒲公英
导读:看到思路迪和康宁杰瑞联合申报的PD-L1(KN035)在日本开始临床,我决定跑一次思路迪,找到了思路迪总助夏芳聊聊。原因很简单:1、他们为什么不做多中心的申报,而是在中、美、日进行单独的申报?2、在不够详尽的报道中,我发现了康宁杰瑞官网上的一句话:常温稳定、皮下注射。
在所有简单的报道中,这次申报的产品为“我国首个自主创新研发的新一代PDL1人源化单克隆抗体”,但我更愿意称作为重组人源化PDL1单域抗体Fc融合蛋白注射液。关于抗体类的药品,已经成功申报美国IND的,除了这次康宁杰瑞和思路迪联合申报的PD-L1单域抗体之外,较为著名的是康柏西普Conbercept和贝格司亭G-CSF-Fc,属于广义上的抗体类蛋白药。
关于原研:我不得不说,目前罗氏、默沙东推出的PD-L1是单抗,具有单独、经典的“蝎子结构”。虽然在很多报道里,我们总是把这次思路迪申报的PD-L1和默沙东、罗氏的产品做比较,可事实上具有一定的差异。虽然在结合实验上,部分CMC要求上,看似差不多,毕竟抗体的药学部分或者临床前的要求,目标便是结合,能结合上靶点便是最重要的。可是我个人担心体内动力学,特异性,及免疫原性。毕竟这种结构是人体内没有的,进到体内不知道我们免疫系统怎么想,一切期待临床数据。
KN035重组人源化PD-L1单域抗体Fc融合蛋白注射液是国内首个申报临床的PD-L1靶点的生物制剂,也是全球首个PD-L1靶点的单域抗体,所以体内数据预期并无先例可循。
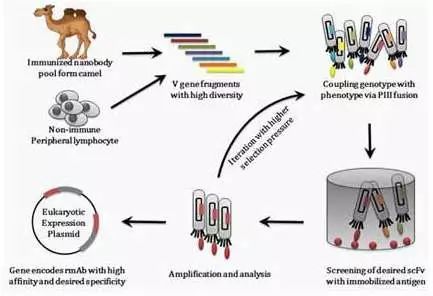
它是个新药:单域抗体没有轻链。也就是说,它的结构和默沙东罗氏的PD-L1肯定不一样,那便肯定是新药了,专利无忧。它来自于骆驼,然后进行了人源化。单域结构是双刃剑,有人认为它可能存在免疫原性的问题,但也有人指出,人体可能无法识别只是少了一个轻链的单域抗体,而且因为没有轻链,这样的结构“轻装上阵”,没有太多拖累,所以比起标准的单抗结构,它跑得更快,也就是分子量更小,活性更高,关键是对于肿瘤组织的穿透性更强。关于单域抗体的免疫原性是更低还是有隐患,似乎各派主张都是自己的观点。从康宁杰瑞的官网看来,免疫原性低是被强调的一个优势。也许我们可以查看一下单域单抗其他产品的临床数据作为参考。
关于常温稳定和皮下注射:没有什么比这个让我觉得兴奋的了。我们都知道,抗体药物的冷链运输是一个高成本付出,风险管理成本高,而且之前的产品是静脉滴注,这意味着患者必须在医院,专业护士的帮助下进行注射,因为PD-L1的适应症为肿瘤,所以此类患者似乎就必须长期住院,或者奔波了。所以无论对企业还是患者来说,必须冷链运输贮存、静脉滴注注射剂都不是最好的剂型,但之前基于单抗药物本身的特点,这方面的成本似乎绕不过去。如果这次KN035真的能做到常温稳定、皮下注射。这意味着,此产品可以和胰岛素一样,采取预装针的方式销售运用,无论是流通成本和使用顺应性都得到本质性的质量提升。当然了,我也关心了一下关于PD-L1的用量大约是PD1的5倍,皮下注射是否会因为剂量太大而无法实施的问题,我只得到了一个:这个问题已经在KN035完全解决了。至于是如何做到高剂量,高浓度稳定的,尚不得知。
关于申报策略:太多企业借助澳大利亚这样的市场进行先期临床。我们总是想着做一份临床,数据在多个地区申报使用。我确实没有太明白思路迪的想法,为什么会采取单独申报的方式呢?答案如下:
根据KN035 整体临床开发规划,日本的临床研究只是KN035全球同步临床试验的一个里程碑事件。针对KN035所设计的I期临床是美国、中国和日本的同步临床试验。首次人体试验先从美国开始,没有安全性问题,中国在提升2个剂量后加入;日本在提升另2个剂量后加入。国际同步I期临床研究,可以尽可能减少参与临床试验而不明显获益的病人数量,符合伦理要求,同时不同国家数据可以互相参照,降低临床风险,提高临床研究效率。在完成I期临床后,将迅速启动国际多中心临床试验(MRCT),争取尽快在国内外上市。
最新研究数据显示,目前总体I期临床已经进行了4个剂量,没有发生免疫反应。
















