想每天收到类似消息,就置顶“
药物一致性评价
”和分享到朋友圈吧!
文章来源:王凤 杭州民生药物研究院有限公司
NKG2D, C型凝集素样受体,是由NK细胞和效应T细胞表达的活化免疫受体。致癌性损伤诱导NKG2D配体在肿瘤细胞表面上的表达使得癌细胞易受免疫破坏。在人类晚期癌症中,肿瘤细胞通过释放NKG2D配体以产生免疫可溶形式来实现免疫逃逸。 可溶性NKG2D配体与癌症患者临床预后不良有关。 近年来,靶向NKG2D通路被认为是癌症免疫治疗的可行途径。
NKG2D受体能广泛识别结构多样的配体。人源NKG2D识别MICA和MICB (MHC I Chain-related molecules A and B,通常称为MIC)家族和ULBP1-6( family of six cytomegalovirus UL16-binding proteins)。 NKG2D配体通常不存在于正常细胞表面,但通常由致瘤性损伤诱导,通过化疗或放疗进一步上调。 在肿瘤细胞表面表达的NKG2D配体通过NKG2D激活NK细胞并共刺激效应T细胞从而使肿瘤细胞对免疫细胞介导的破坏敏感。
然而,肿瘤细胞通常通过蛋白水解介导从肿瘤细胞表面释放NKG2D配体或通过分泌释放可溶形式的NKG2D配体,从而逃避对NKG2D途径的免疫监视。
已证明NKG2D配体的脱落形式sNKG2D-L具有高度免疫抑制性。临床及临床前研究显示:高水平的循环sNKG2D-L与多种肿瘤类型的不良预后及对免疫检查点治疗效果差相关。
NKG2D介导的激活信号可以超过NK抑制性受体的抑制信号,因此NKG2D是NK细胞主要的激活受体。NKG2D在胞内的结构域不具有任何信号元件, NKG2D形成同型二聚体并将其跨膜结构域中的衔接蛋白与六聚体复合物结构相关联并启动信号级联。
在人和小鼠中,稳定的NKG2D表面表达需要在NKG2D和10kDa的DNAX活化蛋白(DAP10)之间形成复合物。在小鼠中,NKG2D也可以瞬时结合ITAM(immunoreceptor tyrosine-based activation motif)-包括DAP12,这取决于细胞的激活状态。结合后,DAP10细胞质结构域内的Tyr-X-X-Meth(YXXM)基序招募PI3K和Grb2以激活NK细胞的细胞毒性途径。
另一方面,DAP12通过基于免疫受体酪氨酸的激活基序发出信号,该基序在磷酸化后募集ZAP70和Syk以触发NK细胞效应器功能。
NKG2D配体的表达受到严密调节以防止自身免疫组织损伤。正常组织一般不表达NKG2D配体。尽管在一些非肿瘤组织如肠道上皮和气道上皮中检测到各种NKG2D配体在细胞内表达,但除非在致病性损伤下,表面表达这些配体是罕见的或仅在阈值水平。
在多样化的NKG2D配体中,MIC家族分子是研究最多的配体并且是人类肿瘤最普遍表达的配体,其中在肿瘤细胞表面MICA比MICB表达更频繁且表达量更高(表1)。 MICB在肿瘤细胞表面表达的频率可能取决于个体中HCMV阳性的状态。 ULBP家族成员在人类肿瘤细胞表面的表达很少,并且没有被充分表征。
人类NKG2D配体的表达可以在转录,转录后或翻译后水平进行调节。尤其是热休克应激途径可调控MICA / B。 DNA损伤通过DNA损伤应答ATM和ATR途径诱导NKG2D配体。用组蛋白去乙酰化酶(HDAC)抑制剂进行转录后表观遗传修饰以及DNA损伤低剂量化疗或放疗可以上调人类肿瘤细胞中的MICA / B表达。 MICA / B和ULBP3也可以被内源性microRNA调节。 在转录后水平,肿瘤中的NKG2D配体表达常常由从肿瘤细胞表面脱落成可溶形式。
高水平的循环可溶性MIC与多种癌症类型(如乳腺癌,结直肠癌,卵巢癌,前列腺癌,肺癌和其他癌症)的不良临床预后和转移相关。
据报道其他家族的NKG2D配体例如ULBP2的脱落与一些实体瘤和血液恶性肿瘤的预后不良有关。 最近临床研究表明黑色素瘤患者队列中,基线水平的血清可溶性NKG2D配体可能负面影响免疫检查点封锁治疗的临床结果。
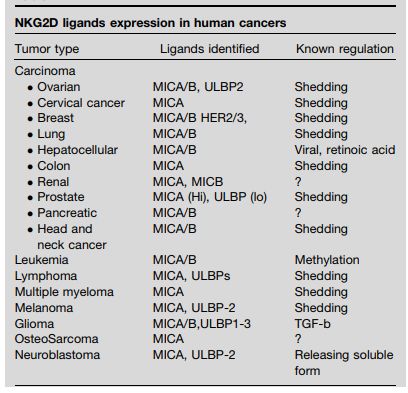
表1
由于MIC是人肿瘤中表达最多的NKG2D配体,因此关于sMIC(可溶性MIC)对肿瘤免疫影响的研究最多,sMIC被证明通过多种机制抑制抗肿瘤免疫应答,例如下调效应NK和T细胞表面NKG2D的表达,干扰NK细胞稳态,促进髓样抑制细胞扩散等。这些发现清楚地表明靶向sMIC释放或免疫抑制功能相关途径可能是癌症免疫治疗的可行方法。
多种方法已被提出可以用来靶向sMIC途径用于癌症免疫疗法。包括通过靶向MIC的α3结构域中调节脱落的序列或调节蛋白酶进入MIC的巯基异构酶ERp5阻断MIC的脱落;利用单克隆抗体清除sMIC等。这些方法的临床前验证的挑战是需要构建在肿瘤中表达MIC的基因工程小鼠模型(GEM),因为在啮齿动物中没有发现MIC同系物。














