2018年4月,FDA批准了用于治疗X-连锁低磷性佝偻病(XLH)的单抗药物burosumab(商品名Crysvita)的上市申请。在此之前,burosumab已于2018年2月份获得欧盟的有条件的上市许可。burosumab是靶向成纤维细胞生长因子23(FGF23)的全人源IgG1单抗,同时也是全球首个治疗XLH的药物。
抗FGF23抗体—burosumab
FGF23与X-连锁低磷血症(XLH)
XLH(X-Linked Hypophosphatemia)是一种X染色体上的PHEX基因存在突变的显性遗传病,当PHEX基因发生突变时,骨细胞会产生过量的FGF23。
FGF23是一种调节磷和维生素D代谢的骨源性激素
,其能阻断肾脏对磷酸盐的再吸收,并抑制维生素D依赖性磷酸盐的吸收,导致血液中磷酸盐的水平显著下降,从而使
FGF23成为遗传性低磷血症的主要罪魁祸首
。
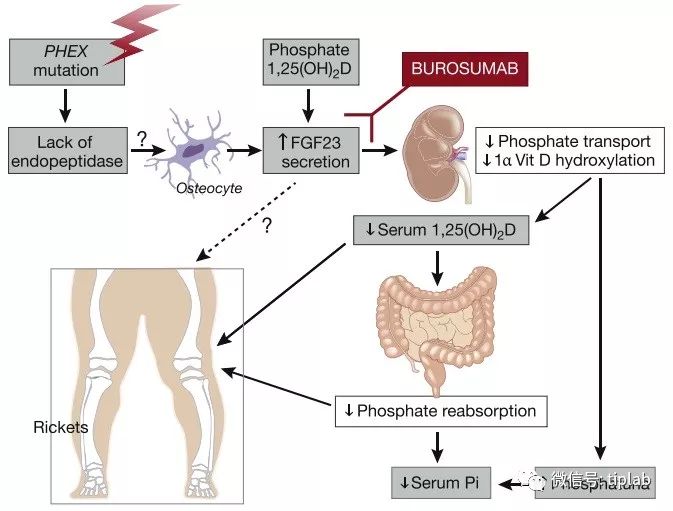
参见:Kidney Int. 2018 Nov;94(5):846-848.
当患有XLH的婴儿的腿部开始承受其自身的重量的时候,往往开始表现XLH的症状。
XLH患儿通常表现为腿部畸形、步态蹒跚和不成比例的身材矮小
。
患有XLH的成人则表现为关节炎、骨软化、腿部畸形和身高降低
。他们易遭受骨折、肌肉疼痛及牙脓肿等症状的困扰,这些都严重影响着他们的生活质量。
靶向FGF23的单抗burosumab
基于FGF23在XLH病理生理中发挥的关键作用,日本Kyowa Hakko Kirin公司首先开始了抗FGF23抗体的研发,代号为KRN23,即后来的burosumab。
Burosumab是全人IgG1单抗,能够结合并抑制FGF23的活性,恢复肾脏对磷酸盐的重吸收并增加血清维生素D的水平
。
2013年,Kyowa Hakko Kirin
与致力于罕见病药物研发的制药公司Ultragenyx签订了合作许可协议,根据该协议Ultragenyx负责领导研发burosumab并将其推向市场
。burosumab上市5年后,Kyowa Hakko Kirin
再接管burosumab在美国和加拿大的大部分商业活
动
。
基于针对5-12岁(NCT02163577)和1-4岁(NCT02750618)XLH患者的Ⅱ期临床试验结果:
2018年2月,
EMA有条件地批准了burosumab用于1岁及以上儿童及青少年XLH的治疗
。
后于
2018年4月,美国FDA也批准了burosumab用于治疗1岁及以上儿童和成人XLH的治疗
。
与此同时,
burosumab在欧盟和美国均获得治疗XLH的孤儿药资格
。
活性成分
2008年2月,Kyowa Hakko Kirin递交了
涉及抗FGF23抗体的国际申请PCT/JP2008/052918
。
CN中国
PCT/JP2008/052918进入中国国家阶段的专利申请,目前已经获得授权,授权公告号为:CN101652476B。
CN101652476B
的权利要求2为:

权利要求2涉及一种抗人FGF23抗体,限定了抗FGF23抗体重链和轻链的氨基酸序列
,经过序列比对,该序列与burosumab重链和轻链的序列一致。
CN101652476B的
分案申请
,目前也已经获得授权
,其授权公告号为CN102702355B。
CN102702355B涉及一种抗人FGF23抗体,权利要求1限定了抗体重链和轻链的CDR序列
。
US美国
PCT/JP2008/052918也进入了美国国家阶段,已经获得授权的专利
US7883705B2涉及一种抗人FGF23抗体,权利要求2限定了抗体重链和轻链的氨基酸序列
。
在US7883705B2的基础上,Kyowa Hakko Kirin递交了其
分案和延续案申请
。其中:
延续案US9290569B2涉及一种抗人FGF23抗体,限定了抗体的CDR序列
。
分案申请US20160159895A1涉及治疗FGF23活性过高的疾病的方法,包括向受试者施用结合FGF23的抗体,并限定了抗FGF23抗体重链和轻链的CDR序列。
Burosumab的临床应用
多年来,XLH的治疗依赖于每日多剂量的磷酸盐和活性维生素D的补充
,该常规疗法在一定程度上可以缓解XLH的症状,但由于每日多次给药,患者顺应性较差,而且该疗法还对部分患者无效。
Burosumab能够结合FGF23,抑制FGF23的活性,直接解决XLH患者低磷血症的问题,达到治疗XLH的目的。
治疗用途
针对burosumab的医药用途,2015年5月,
Ultragenyx与Kyowa Hakko Kirin共同递交了一项涉及使用抗FGF23抗体治疗低磷血症的国际申请PCT/US2015/033226
。
CN中国
PCT/US2015/033226进入中国国家阶段的专利申请CN106604743A,其权利要求10为:

权利要求10请求保护一种治疗与FGF23相关疾患的方法,包括向需要此类治疗的受试者施用抗FGF23配体
,限定了基于一个或多个PD参数确定的给药方案来施用抗FGF23配体。
CN106604743A的
权利要求12,限定了权利要求10中的受试者患有XLH
。
US美国
PCT/US2015/033226对应的美国专利申请US20150353633A1
,其权利要求1为:

该权利要求涉及一种使用抗FGF23配体的方法,包括向有此类治疗的受试者施用抗FGF23配体,限定了基于抗FGF23配体在受试者中的一个或者多个参数来确定抗FGF2配体的给药方案。
Burosumab的剂型
在欧盟和美国上市的Crysvita
®
为
皮下注射剂型
。
从2008年12月开始的一项旨在评估静脉内和皮下注射KRN23的安全性和耐受性的1期临床实验NCT00830674已经完成,但该临床试验的结果尚未披露。
目前,针对burosumab静脉注射剂型的研发似乎已经停止。
机制导向的新药研发
FGF/FGFR信号通路的异常是多种肿瘤的重要原因,因此FGFR也是靶向药物研发的一个热点领域。
针对FGFR靶点药物的研发,因伴随着高磷血症的毒副作用,迄今为止还没有相关抗体药物获批上市。
而XLH的主要特征却是血清中磷酸盐水平低下,引起骨骼畸形、发育不良。针对FGF23抗体药物burosumab后来居上,率先上市成为首个治疗XLH的抗体药物。
这也反映了
基于机制的了解,开发针对性的靶向药物,并将药物反应与基因的异常联系起来,合理化药物疗效的重要意义
。














