由于产品和生物制造工艺的复杂性,
QbD
在生物技术产品中的应用代表了一个重要的机会,《
A-Mab Case Study Version
》创建了一个全面的生物技术案例研究,支持生产和监管机构的教学和学习;通过举例说明
Q8
(
R2
),
Q9
和
Q10
中描述的有效成分和药品的更先进的原则和机会,展示了
“
先进知识
”
的概念,以及如何应用它来展示过程理解,实现整个流程开发和商业领域的持续改进;调动和挑战当前的想法,以激发讨论和推进新的概念;研究可能的机会,以加强与这些先进理念相关的基于科学和风险的监管方法,从而鼓励在整个行业更好地实施最近的
ICH
指南。
这个案例研究的目的是举例说明产品开发的
QbD
方法。通过设计方法来提高产品开发的质量,还会增加产品的开发以下要素:
1.
系统评估,理解和改进配方和制造过程,包括:
(
1
)通过例如先验知识、实验和风险评估来识别可能对产品
CQA
有影响的材料属性和工艺参数
;
(
2
)确定链接材料属性和过程的功能关系产品
CQA
的参数
;
2.
将增强的产品和过程理解与质量风险相结合,
管理层建立一个适当的控制策略,例如可以包括一个建议设计空间和
/
或实时发布测试。
A-Mab
产品实现的总体方法如图
1.1
所示,其中展示了从分子设计开始并跨越开发过程的一系列活动,最终形成了用于商业制造的最终过程和控制策略。
图
1.1
产品实现过程概述
《A-Mab Case Study Version》各章内容
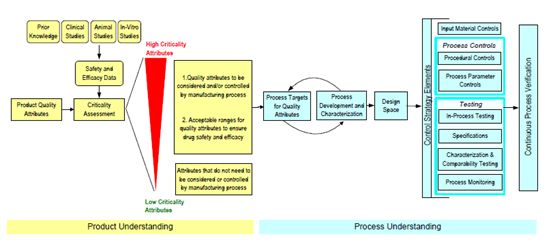
产品开发始于使用目标产品配置文件识别抗体的期望质量属性及其性能属性。该分子旨在最大限度地提高临床安全性和有效性,以达到所需的性能。从目标产品配置文件中,根据潜在关键质量属性的关键性,使用新颖的电子表格工具创建并排序潜在的关键质量属性的初始列表,该电子表格工具也考虑相关的控制工具。利用新的评估工具来评估详细描述的特定属性的关键性。这提供了一个机会来演示如何利用来自多个来源的知识,包括具有类似分子的先前知识以及来自体外,非临床和临床数据的经验,用于评估质量属性的关键性。为了这个案例研究的目的,四个质量属性进行了详细的审查,并在整个案例研究中检查,以确定设计空间和制定具体的控制策略。
使用基于风险的方法来评估制造过程的每个单元操作,以识别可能对产品质量和过程性能造成风险的过程参数和属性。
风险评估工具没有详细描述,因为它们是由
ICH
发布的
ICH Q9
指南和相关材料描述的。
通过使用平台流程和其他单克隆抗体的经验获得的先前知识为风险评估提供了初步基础。
随后的风险评估包含了整个
A-Mab
开发生命周期中获得的累积知识。
如图
1.2
所示,在
A-Mab
开发过程中,进行了多轮风险评估,以指导过程特征描述和优化研究。
这些研究是使用缩小模型进行的,这些模型被证明是全面的制造工艺性能的代表性和预测性。
来自
DoE
研究的结果提供了对输入过程参数和输出质量属性之间的关系的理解。
此外,临床制造经验增加了对各种操作规模的过程性能和过程控制的理解。
在上游和下游过程的相应部分中给出了每个单元操作的过程参数表征的详细描述。
只有与产品质量相关的工艺参数被用来定义设计空间的限制。
第
5
章介绍配方设计,配料,过滤和填充步骤,再次关注有限的关键质量属性。药物产品使用稍微不同的方法。对于单克隆制剂和制造工艺的广泛的先前知识使得可以将产品及其工艺视为基本的平台工艺。
通过风险评估和有针对性的实验,可以重复使用为其他产品开发的设计空间和可接受的范围。该部分还显示了使用无量纲分析来显示规模独立性。
此外,还包括故障树分析的一个例子,以证明其支持
QbD













