哈喽!大家好,好久没有和大家见面了,今天和大家分享的文献是2022年4月发表在Nature Communications的一篇关于研究肠道微生物的文章。文章通过对发病人群深度分析,将心力衰竭与三甲基-5-氨基戊酸 (TMAVA)相联系,通过分析肠道菌群与三甲基-5-氨基戊酸产生的关系以及三甲基-5-氨基戊酸在心肌肥大方面的影响,将整篇文章串联起来。结构非常清晰,值得大家学习。

心力衰竭 (HF) 是一个全球性问题,全世界估计有 3800 万患者患有这种诊断。 心肌肥大是 HF 临床过程中的早期里程碑,也是随后心脏发病率和死亡率的重要危险因素。 加强对心脏肥大病理生物学的理解和开发预防心脏肥大和衰竭的方法势在必行。
心脏是一个依赖脂肪酸(FA)和葡萄糖氧化的能量需求器官。长链 FA 贡献了成人心脏在正常生理条件下运作所需能量的 70%。衰竭的心脏通常显示参与 FA 代谢的关键酶的转录受损。因此,心脏转而利用葡萄糖作为主要燃料。然而,这种底物利用转变是适应性的还是适应不良的仍然存在争议。
在这项研究中,研究者使用前瞻性 HF 队列观察到较高 TMAVA 水平与不良临床结果风险逐渐增加相关。用 TMAVA 处理的小鼠在高脂饮食 (HFD) 中表现出加重的心脏肥大和功能障碍。从机制上讲,肉碱的生物合成和摄取被 TMAVA 抑制,导致 FFA 氧化抑制和心肌脂质积累和毒性。TMAVA 处理也改变了线粒体的超微结构和功能。BBOX 缺陷小鼠表现出类似的心脏肥大表型,这表明 TMAVA 通过 BBOX 途径发挥作用。最后,外源性肉碱补充剂可逆转 TMAVA 诱导的心脏肥大。TMAVA 可能是与肠道微生物群相关的心脏肥大的潜在治疗靶点。
1、较高的 TMAVA 水平与较高的 HF 风险相关
通过这一小节,研究者将肠道微生物群与心力衰竭的关系构筑起来,验证得出结论,口服给予TML可以在肠道微生物的作用下产生TMAVA,而队列分析表明TMAVA与心力衰竭发病风险增加有关。
【证明TMAVA 水平与较高的 HF 风险相关】
①对包含 1647 名患者的队列进行 84 个月的随访中,387 名患者发生心源性死亡和移植。当根据 TMAVA 水平将队列分为四个亚群(Q1 ≤ 0.300;Q2 = 0.300-0.472;Q3 = 0.472-0.742;Q4 > 0.742),Q4亚群患者发生心源性死亡的风险与Q1亚群相比显著升高,风险比为 1.76。
②Kaplan-Meier 分析还显示与 TMAVA 水平相关的死亡风险显著增加(图 1a)。此外,即使在调整传统心脏风险因素(年龄、性别、吸烟、SBP、糖尿病、HDL 和 LDL)后,TMAVA 水平(Q4)升高也是 7 年心脏死亡和移植风险的独立预测因子(图 1b)。
【证明肠道微生物可以通过TML产生TMAVA】
①研究者发现肠道微生物群是内源性 TMAVA 生成所必需的。TMAVA 可以通过肠道微生物群与赖氨酸 2-单加氧酶 (DavB) 和 5-氨基戊酰胺酶 (DavA) 酶从 TML 产生(图 1c)。无菌小鼠在血浆、粪便和尿液中显示出微量的 TMAVA 含量(图 1d)。
②当纯化的 DavB 和 DavA 蛋白与 TML 一起孵育时,TMAVA 在体外产生时间依赖性(图 1e)。此外,当来自传统饲养小鼠的粪便与不同浓度的 TML 共同孵育时,TMAVA 水平也以时间和浓度依赖性方式增加(图 1f),而无菌粪便不能产生 TMAVA(补充图 1b)。d9-TML 的灌胃时间依赖性地增加了小鼠中 d9-TMAVA 的血浆水平(图 1g),这表明TML与TMAVA存在直接的前体/产物关系。
【证明口服给予TML是产生TMAVA的必要手段】
之前的一项研究报告称,TMAO可以从TML产生。本文的作者发现d9-TMAO的血浆水平在TML强饲后仅略有上升。相比之下,d9-TMAVA的峰值水平明显高于d9-TMAO(图1g),并且当d9-TML被灌胃到无菌小鼠或常规小鼠腹膜内注射时,d9-TMAVA产生受损。这些结果直接表明,口服TML可以优先作为TMAVA的前体。
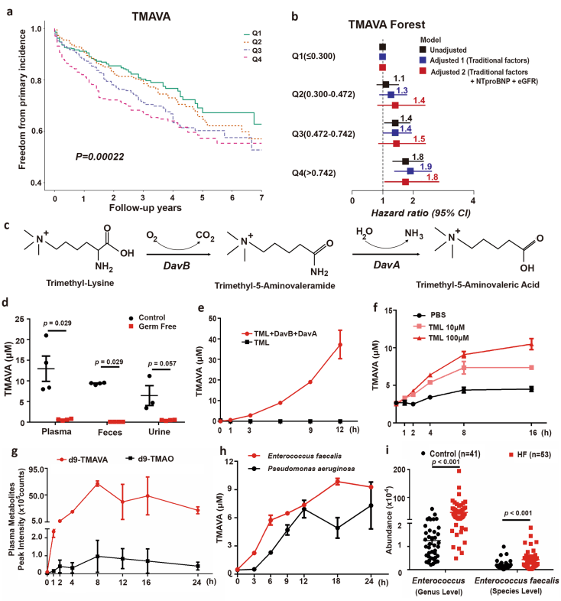
图1
2、TMAVA加重HFD饮食引起的心肌肥厚和功能障碍
通过这一小节,研究者充分证明TMAVA与心肌肥厚存在内在联系,将研究从人类队列研究引入动物实验中。
【证明TMAVA加重HFD饮食引起的心肌肥厚】
小鼠HFD饮食的同时使用或不使用TMAVA喂养12周。12周后,血浆TMAVA水平显著升高(9.52μM对113.5μM)。与未治疗的对照组相比,TMAVA治疗的小鼠的心脏重量增加(图2a-c),心肌细胞横截面积显著增加(图2d-f)。此外,肥厚标记基因,包括心房利钠肽和脑利钠肽(BNP)显著上调(图2g)。超声心动图评估显示,TMAVA处理的HFD小鼠舒张期左后壁厚度、收缩期左心室尺寸体积和左心室肿块进一步增加。TMAVA处理的小鼠的EF和分数缩短(FS)进一步降低(图2h-j)。因此,TMAVA处理的小鼠表现出显着降低的运动能力(图2k)。
【证明TMAVA处理导致心肌脂质积聚】
TMAVA与HFD联合处理12周后,与对照组相比,血浆甘油三酯(TG)和FFA水平显著增加(图2l,m)。冷冻心脏切片的油红O染色显示TMAVA处理组心脏中脂滴水平显著,但在对照心脏中没有(图2n)。TMAVA处理的HFD样本中心肌TG和FFA的水平分别比对照HFD心脏高30%和20%(图2o)。DG被认为是通过蛋白激酶C的作用导致的脂肪毒性诱导的胰岛素抵抗的致病代谢物,研究者发现TMAVA处理的小鼠中DG物质显著增加(图2q)。
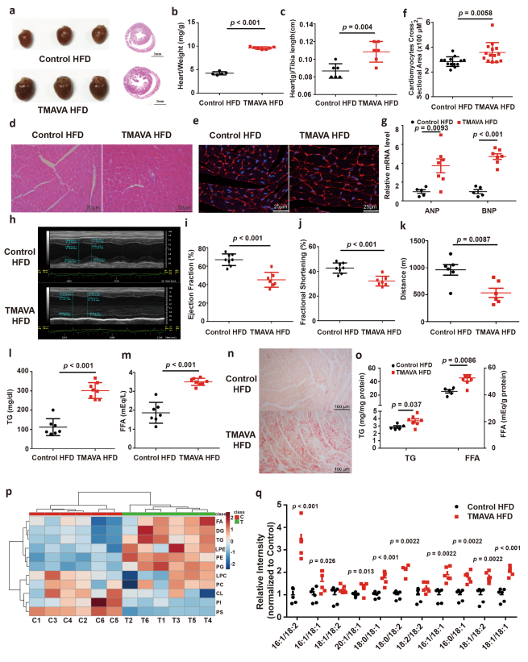
图2
3、TMAVA抑制肉碱代谢,损害心肌能量稳态
通过这一小节,研究者证明TMAVA会抑制心脏肉碱代谢,并且TMAVA严重损伤了心肌能量代谢。
【观察到现象TMAVA抑制肉碱代谢】
TMAVA治疗显著降低血浆和心脏肉碱(图3a)。与循环肉碱的减少一致,心脏中的所有酰基肉碱种类都显著减少,表明FAsβ-氧化的抑制状态(图3b)。
【证明TMAVA处理影响HFD条件下的心肌能量代谢】
线粒体FAO在TMAVA处理的小鼠中减少(图3d)。心肌细胞的超微结构分析表明,TMAVA处理的小鼠中线粒体肿胀,电子密度较低(图3e),脂滴积累增加(图3f)。来自TMAVA处理小鼠的心脏线粒体表现出呼吸链缺陷,使用棕榈酸作为底物的最大线粒体呼吸(MMR)减少,表明线粒体呼吸严重受损(图3g)。TMAVA处理的小鼠的心肌组织活性氧(ROS)水平升高(图3h,i)。
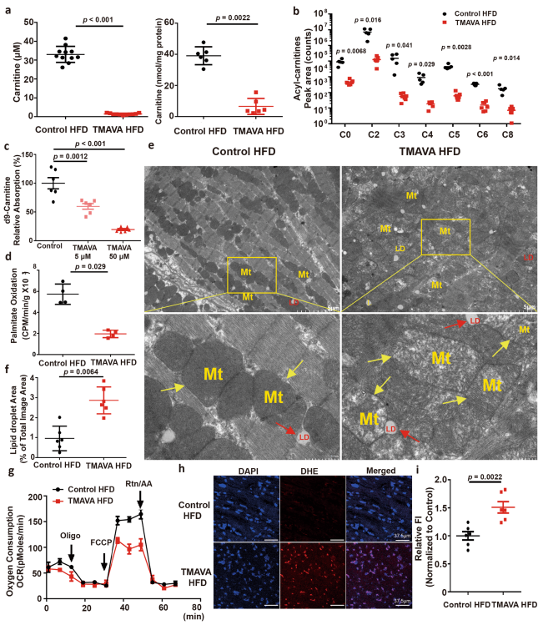
图3
通过第2、3小节,研究者充分的证明TMAVA加重诱发HFD饮食引起的心肌肥厚,并且阐明了TMAVA会抑制肉碱代谢,损害心肌能量稳态。这样,再联合第1小节的内容,研究者就证明了肠道微生物群衍生的 TMAVA通过抑制肉碱代谢,损害心肌能量稳态,引起HFD饮食小鼠心肌肥厚。
4、BBOX失活与TMAVA处理表型一致
TMAVA是如何抑制肉碱代谢的呢?在这一节中,研究者通过对肉碱代谢中关键酶的突变研究。肉碱是由γ-丁基甜菜碱(γ-BB)通过γ-丁基甜菜碱羟化酶(BBOX)进行羟化而内源性合成的(文中的重点,是作者下一步研究的关键)。为了提供基因证据证明BBOX是TMAVA诱导FAO损伤的分子靶点,研究者通过CRISPR–CAS9产生BBOX缺陷小鼠,去研究BBOX是TMAVA的分子靶标。
【BBOX基因敲除加重HFD饮食引起的心肌肥厚和功能障碍】
①与HFD对照组小鼠相比,BBOX基因敲除小鼠的心脏形态有所增加(图4a)。
②血清TG和FFA含量升高,H&E、WGA和油红O染色显示心肌细胞肥大(图4b和4c),这与TMAVA处理结果一致。BBOX基因敲除小鼠中的心肌TG和FFA水平较对照组分别高出40%和30%(图4d)。
③产生心脏脂肪毒性的DG在BBOX基因敲除小鼠中也增加(图4f)。
【BBOX基因敲除损害心肌能量稳态】
①从BBOX基因敲除小鼠分离的线粒体显示出呼吸链缺陷,以棕榈酸为底物的MMR降低,表明这些小鼠的线粒体呼吸严重受损(图4g)。
②BBOX基因敲除小鼠中心肌组织ROS水平升高(图4h,i)和参与氧化应激的心脏基因(NOX4,gp91phox,p22phox和p47phox)的mRNA水平也升高(图4j)。
③血浆氧化应激标志物8-异前列腺素在BBOX基因敲除小鼠中也增加(图4k)。EF和FS在敲除小鼠中进一步降低(图4l,m)。
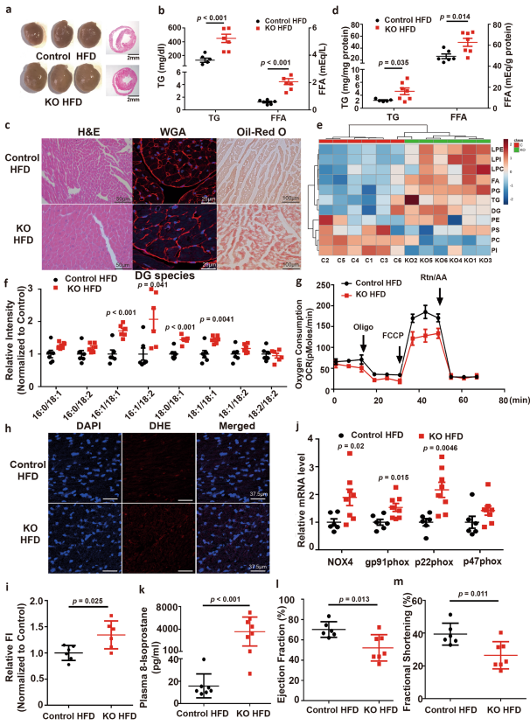
图4
5、外源性肉碱补充剂可逆转 TMAVA 诱导的心脏肥大
这一节是再次验证,即反复验证!为了检查补充肉碱是否可以逆转 TMAVA 诱导的心脏肥大,研究者用 TMAVA 治疗 WT 小鼠,在其饮用水中加入或不加入肉碱。
【外源性肉碱补充剂可逆转 TMAVA 引起的心肌肥厚】
①肉碱补充剂显着逆转了 TMAVA 诱导的心脏肉碱减少(图 5a)。TMAVA 在心脏肥大和脂质含量中的病理作用被肉碱补充显着消除,心脏重量/胫骨长度和 TG 水平证明了这一点(图 5b,c)。
②H&E、WGA 和油红 O 染色显示,在肉碱处理的小鼠中,心肌细胞肥大消失,中性脂质沉积减少(图 5d)。肉碱补充组中心肌 TG 和 FFA 的水平也降低了 20%(图 5e)。
【外源性肉碱补充剂可逆转 TMAVA 引起的功能障碍】
③肉碱处理的小鼠中线粒体FAO也增加(图5f)。与组织学观察一致,超声心动图评估显示,与仅 TMAVA 组相比,肉碱组的 EF 和 FS 也逆转(图 5g,h),因此,外源性肉碱补充剂可以逆转 TMAVA 诱导的心脏肥大。
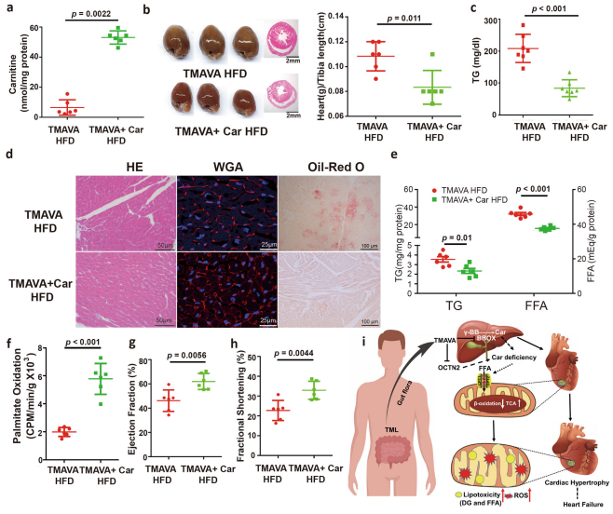
图5
肠道微生物群产生三甲基-5-氨基戊酸可减少脂肪酸氧化并加速心脏肥大许多研究发现肠道微生物群的改变被认为通过产生肠道衍生代谢物来影响各种疾病的发展。然而,特定代谢物及其对心脏肥大或心力衰竭进展的病理生理学贡献仍不清楚。本文的研究发现:
①通过肠道微生物群衍生自三甲基赖氨酸的三甲基-5-氨基戊酸 (TMAVA),在前瞻性心力衰竭队列(n = 1647)中随着心脏死亡和移植风险的逐渐增加而升高。
②TMAVA 处理加重了高脂饮食喂养小鼠的心脏肥大和功能障碍。
③TMAVA 处理改变了线粒体超微结构、呼吸和FAO,并抑制了肉碱代谢。
④γ-丁甜菜碱羟化酶 (BBOX) 缺乏的小鼠表现出相似的心脏肥大表型,表明 TMAVA 通过 BBOX 发挥作用。外源性肉碱补充剂逆转了 TMAVA 诱导的心脏肥大。
结论:这些数据表明,肠道微生物群衍生的 TMAVA 是通过抑制肉碱合成和随后的 FAO 导致心脏肥大发展的关键决定因素。
参考文献:https://www.nature.com/articles/s41467-022-29060-7














