靶向p53的小分子药物:突破与挑战
不同
TP53
状态的肿瘤需要非常不同的小分子靶向策略。
对于含有
TP53
错义突变的肿瘤,小分子药物开发主要侧重于恢复
mutp53
蛋白野生型构象和活性。
相反,对于保持
wtp53
的癌症,主要的策略将
p53
从其负调控因子的抑制中释放出来,从而释放出
p53
的全部活性。
靶向TP53错义突变
TP53错义突变在人类癌症中异常常见,约占所有TP53突变的70%。由此产生的结构或构象突变体被视为小分子的潜在靶点,可以恢复mutp53的正确折叠和功能。1999年,辉瑞公司筛选出了第一个具有mutp53再激活能力的化合物CP31398。从机理上,CP31398稳定了p53的野生型构象,并通过抑制其泛素化防止其降解。然而,后来的研究揭示了更复杂的作用,包括药物嵌入DNA引起的非特异性毒性和p53非依赖性上调促凋亡蛋白BAX。因此,CP31398未被纳入临床研究。尽管如此,这个药物标志着靶向mutp53的小分子时代的开始。
多年来,人们发现了许多mutp53的激活药物。包括MIRA-1,其含有可参与亲核加成反应的马来酰亚胺基团,以及STIMA-1,一种2-苯乙烯基喹唑啉-4(3H)-酮相关衍生物。尽管这两种化合物在体外和体内均表现出p53依赖性效应,但由于溶解度问题和对正常细胞的毒性,这两种药物均未进入临床试验。
在报道的mutp53激活小分子中,只有少数被纳入临床试验。第一个进入临床试验的是PRIMA-1 MET,它是PRIMA-1的甲基化衍生物,也称为APR-246。在体外和临床前研究中,APR-244表现出比PRIMA-1更好的活性,在急性髓细胞白血病(
AML
)细胞系和患者的原代细胞中增强了凋亡作用。目前正在进行APR-246的两个I/II期临床试验,与阿扎胞苷联合治疗携带p53突变的MDS或AML患者,均显示出实质性疗效。2020年1月,FDA授予APR-246治疗MDS的突破性疗法。最近,一项评估APR-246联合阿扎胞苷的II期试验宣布了令人鼓舞的结果。APR-246和阿扎胞苷的联合治疗实现了58%的1年无复发生存率(
RFS
),中位OS为19.3个月。目前正在进行或计划进行更多以APR-246为单药或联合用药的临床试验。
靶向wtp53的肿瘤
在保持wtp53表达的肿瘤中,最广泛采用的p53靶向治疗方法是抑制p53的降解。p53降解的机制涉及E3泛素连接酶MDM2对p53的泛素化,导致p53的蛋白酶体降解。MDM2介导的泛素化依赖于其与p53的直接结合,促使人们寻找抑制MDM2–p53结合的小分子,作为稳定p53并使其恢复效力的手段。
第一类抑制剂是Nutlins,可诱导wtp53癌细胞中的p53激活,但对mutp53细胞无影响。Nutlins的衍生物RG7112是临床试验中测试的第一个MDM2抑制剂。在难治性复发性AML和CML患者中,RG7112可触发wtp53激活,并提高许多p53靶基因的表达,在许多患者中观察到RG7112的抗白血病活性。然而,需要大剂量的RG7112才能达到疗效,导致不良事件发生,如胃肠道不耐受和血小板生成抑制。随后,RG7112被第三代衍生产品idasanutlin(
RG7388
)取代。目前,有几项临床试验正在测试idasanutlin对各种癌症的安全性和疗效。
除了Nutlins衍生物,许多其他干扰MDM2–p53结合的分子也在开发和测试中。例如,APG-115是一种口服的MDM2抑制剂,在AML临床前模型和放射治疗致敏的胃癌异种移植物中显示出强大的抗肿瘤作用。APG-115目前正在几个临床试验中进行评估(
如NCT02935907、NCT03611868、NCT04785196、NCT0037816
),单药或联合化疗和免疫检查点抑制剂。
AMG-232是另一种口服的MDM2抑制剂,显示可促进骨肉瘤细胞的wtp53功能和肿瘤消退。目前,已经启动了十多项AMG-232(
后更名为KRT-232
)的临床试验,包括JNK抑制剂失效后骨髓纤维化的III期试验以及其他癌症的早期试验。其他MDM2抑制剂,包括siremadlin和milademetan,也在临床试验中(
NCT03634228、NCT04116541
)。
靶向截短的p53
大约10%的TP53变异肿瘤携带无义突变,产生截短蛋白,通常很快降解。由于这些蛋白质的寿命很短,并且通常缺乏大部分p53蛋白序列,因此通过上述方法重新激活可能毫无意义。
因此,人们提出了两种替代方法来激活含有p53截短突变癌细胞中的p53信号通路。第一种方法是基于促进翻译通读的分子,使翻译机制绕过RNA终止密码子,产生全长p53蛋白。这些化合物包括氨基糖苷类抗生素及其衍生物,如G418和新一代合成衍生物NB124。用这些氨基糖苷治疗可挽救完整p53的合成,促进癌细胞凋亡。另一种替代方法是抑制无义介导的mRNA降解(
NMD
)过程。例如,NMD14靶向SMG7的结构口袋,SMG7是NMD机制的一个关键组成部分。类似的药物,如ataluren,已经进入囊性纤维化的III期临床试验。
靶向mutp53 GOF
尽管大多数基于p53的药物开发都是为了恢复癌细胞中野生型p53的活性,但也有人试图通过靶向mutp53快速降解来消除mutp53-GOF(
gain-of-function
)活性。鉴于HSP90热休克蛋白可以减弱mutp53的降解,研究表明,长时间抑制HSP90可以提高携带mutp53表达肿瘤小鼠的存活率。
-
04
-
基于p53的肿瘤免疫治疗创新
近年来,癌症免疫治疗取得了前所未有的成功,这也重新激发了人们对基于
p53
免疫治疗策略的兴趣,主要是提高免疫系统识别和根除含有不受调控的
p53
癌细胞的策略。
20世纪90年代,人们开始尝试旨在提高对含有过量p53的癌细胞免疫力的疫苗。一种合成长肽(
SLP
)疫苗由来自wtp53序列的十个重叠肽组成,其在转移性结直肠癌中引发了以CD4+T细胞为主的T细胞反应,不良反应相对较轻。然而,临床试验未能显示SLP疫苗相对于历史对照的益处。
此外,编码wtp53的改良痘苗病毒ankara(
MVA
)疫苗也在难治性胃肠道癌和卵巢癌患者的早期临床试验中进行了测试,在总共11名患者中,分别有6名和5名患者能诱导CD8+和CD4+T细胞反应。目前正在进行MVAp53疫苗和抗PD1抗体pembrolizumab的进一步临床试验(
NCT03113487,NCT02432963
)。
mRNA疫苗的成功也为p53 mRNA疫苗带来了新的希望。将自体TP53 mRNA转染的DC导入乳腺癌患者体内后,在18例高表达p53的肿瘤患者中,有13例在体外表现出p53特异性T细胞反应,这健康志愿者(
1/10
)和p53低表达乳腺癌患者(
2/18
)形成鲜明对比。
其他基于p53的免疫治疗方法也正在出现。T细胞受体模拟物(
TCRm
)抗体,也称为TCR样抗体,是一种潜在的靶向细胞内蛋白质的策略。这些抗体识别MHC在细胞表面显示的表位,类似于TCR识别,从而能够识别来自细胞内蛋白质的肽。
双特异性抗体是另一种非常有前途的癌症免疫治疗方法。最近开发了一种基于mutp53的双特异性抗体,可以识别来自p53(
R175H
)热点突变和TCR–CD3复合物的新抗原。通过与癌细胞上的p53(
R175H
)肽-HLA复合物以及T细胞上的TCR-CD3复合物高亲和力结合,这种双特异性抗体可以克服新抗原提呈的缺乏,并选择性地重定向T细胞以识别展示突变肽的癌细胞。
p53与肿瘤微环境
最近的研究显示p53与癌症免疫治疗之间存在更广泛的联系。癌细胞中的p53状态会影响TME的免疫状态。
癌细胞中的功能性wtp53倾向于支持癌症限制性TME,而wtp53的缺失则使平衡朝着支持癌症的TME倾斜。此外,作为GOF活性的一部分,一些错义mutp53蛋白可能会进一步限制免疫系统攻击癌细胞的能力。例如,wtp53可以通过上调miR-34a间接降低PD-L1的水平,并诱导自然杀伤(
NK
)细胞激活性配体UL16结合蛋白1(
ULBP1
)和ULBP2的表达,使癌细胞更容易受到细胞毒性T细胞和NK细胞的攻击。
此外,通过调节细胞因子表达,wtp53可以通过改变TIME的组成来发挥抗肿瘤作用。因此,肿瘤的TP53状态可能对与免疫治疗相关的患者用药非常重要。此外,恢复或增强癌细胞中p53功能的药物也可考虑与免疫治疗方案联合用药,以增加其成功的可能性。2022年7月,PMV制药公司宣布与默克公司合作进行PC14586与pembrolizumab的临床试验,以治疗携带p53(
Y220C
)突变的晚期实体瘤患者。
-
05
-
第一个被批准用于临床的基因治疗就是基于p53的。Gendicine是深圳赛百诺公司开发的一种重组人p53腺病毒,于2003年被中国食品药品监督管理局(
CFDA
)批准用于HNSCC。据报道,当与化疗或放疗结合时,Gendicine的响应率明显高于标准护理。其他基于腺病毒的p53基因治疗,包括advexin和SCH-58500,也在临床试验中显示出良好的结果。
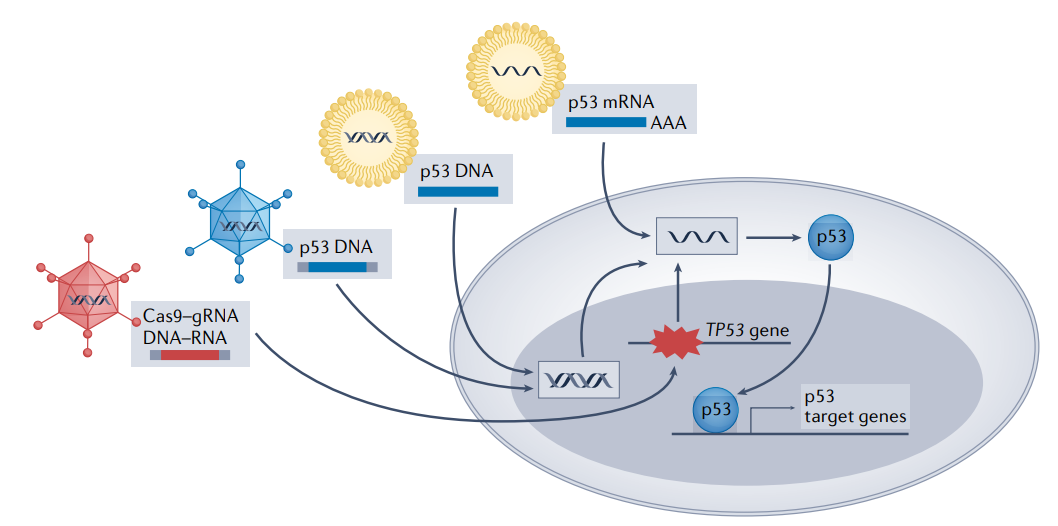
纳米颗粒也被探索用于p53基因治疗载体。与病毒不同,纳米颗粒具有低免疫原性,因此对抑制性抗体不敏感,从而延长其循环时间,同时减少免疫相关的副作用。此外,通过静脉注射,纳米颗粒比肿瘤内注射更适合治疗远处转移。SGT-53是一种由SynerGene Therapeutics开发的阳离子脂质体,携带wtp53编码的DNA,通过抗转铁蛋白单链抗体片段选择性地归巢肿瘤细胞。在对11名患有不同类型晚期实体瘤的患者进行的一期临床试验中, 11名患者中有7名在6周评估时病情稳定。
p53 mRNA纳米颗粒也在开发中。在最近的一项研究中,在HCC和NSCLC小鼠模型中,通过纳米颗粒递送p53 mRNA使p53缺失的肺癌细胞存活率显著降低,肿瘤大小显著减小。此外,与单独的治疗相比,p53 mRNA纳米颗粒与免疫治疗相结合可提高抗癌效果。
-
06
-
开发基于
p53
的治疗方法已经进行了近三十年,尽管目前还没有基于
p53
的癌症药物获批,但是基于
p53
基因在人类癌症中的中心地位,如果取得成功,则有可能彻底改变癌症治疗。
近年来,一系列所取得的进展逐渐摒弃了
p53
不可成药的观点,最近
KRAS
抑制剂的成功也给我们带来了鼓舞。
与
p53
一样,由于反复失败,
KRAS
也被许多人认为是不可成药的靶标。
相信随着新技术的不断进步以及对
p53
更加深入的研究,靶向
p53
的癌症治疗药物将很快应用于临床,从而使更多的患者受益。
参考文献:
1.Drugging p53 in cancer: one protein, many targets.Nat Rev Drug Discov. 2022 Oct 10 : 1–18.





