
以下内容仅限医疗卫生专业人士学术交流使用,如为非医疗卫生专业人士请主动退出浏览与阅读,否则由此产生的相关风险与后果应自行承担。
编者按:雄激素剥夺治疗(ADT)是前列腺癌的基石治疗,其主要目标是将血清睾酮降低并稳定维持于去势水平以下。睾酮与前列腺癌的发生发展、风险评估、治疗选择和疗效评价密切相关,亦是评价ADT疗效的关键指标,而睾酮检测的准确性和监测的科学性直接决定了接受ADT治疗的患者是否达到去势标准的评价结果。近期发表于UROL ONCOL-SEMIN ORI(IF:2.954)的一项研究对比了放射性免疫分析法(RIA)、化学发光免疫分析法(CLIA)、液相色谱-质谱联用法(MS)三种方法检测的睾酮值的差异[1],本期《肿瘤瞭望》特邀首都医科大学附属北京安贞医院泌尿外科张宁教授,与您分享睾酮合理监测和科学检测的前沿进展。
ADT作为前列腺癌的基石治疗方案,其基本目标是使血清睾酮达到去势水平,但仍然有2%-13%患者在接受ADT治疗时未达去势水平,还有约13%-35%药物去势患者的血清睾酮无法达到20 ng/dl以下[2]。去势标准、监测策略以及检测方式对评估和预测接受ADT治疗前列腺癌患者的疗效至关重要。
一、前列腺癌ADT治疗期间的睾酮水平与整体预后密切相关
前列腺癌ADT治疗的去势水平定义为<50 ng/dl已有30余年,当时的双同位素衍生物稀释技术灵敏度较低、准确性不高[3]。随着检测技术的发展,灵敏度逐渐提高,监测<20 ng/dl的睾酮水平变得可行,更多研究者开始关注将睾酮水平控制在更低的水平对患者结局和预后的影响。
一项纳入153例前列腺癌患者的单中心、前瞻性、单臂队列研究结果显示,相比于睾酮>20 ng/dl,睾酮<20 ng/dl的患者死亡风险降低81%,疾病进展风险也有降低趋势,而50 ng/dl阈值线与死亡风险和进展风险均无关[4]。
PR-7研究发现,在626例根治术后生化复发的前列腺癌患者中,接受持续ADT治疗期间第一年平均睾酮水平≤20 ng/dl的患者去势抵抗性前列腺癌(CRPC)进展和死亡风险最低[5],详见图1。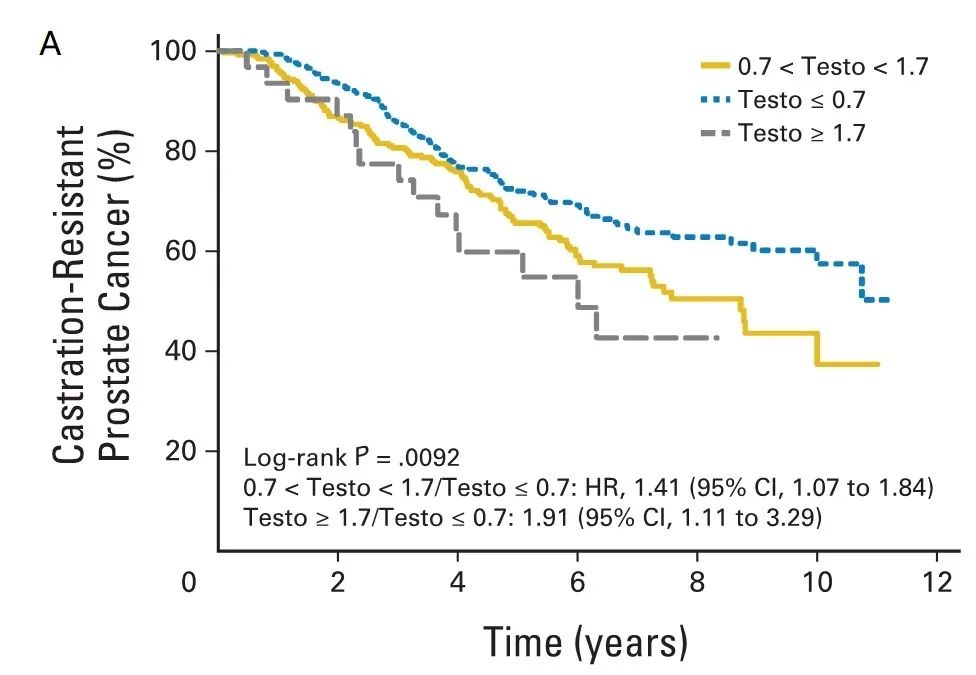
 图1. PR-7研究中睾酮水平分层与CRPC进展风险(A)和死亡风险(B)的相关性[5]
图1. PR-7研究中睾酮水平分层与CRPC进展风险(A)和死亡风险(B)的相关性[5]
一项纳入156例接受连续ADT治疗的前列腺癌患者的单中心、回顾性研究显示,治疗后6个月时睾酮水平<20 ng/dl的患者进展为CRPC的时间显著更长[6]。
对96例转移性前列腺癌患者的OS和PFS的单因素分析发现,接受ADT治疗期间的睾酮监测水平越低,患者的总生存率越高[7]。
越来越多的研究结果显示,患者接受ADT治疗期间的睾酮水平显著影响进展为CRPC的风险和患者生存率。2016年欧洲泌尿外科协会(EAU)前列腺癌指南率先提出睾酮<20 ng/dl可能是更恰当的去势水平界值,而加拿大泌尿外科协会直接推荐将睾酮<20 ng/dl作为ADT治疗去势的新标准[8]。国内外主流前列腺癌指南如EAU、NCCN及我国CUA仍将去势水平定义为<50 ng/dl[9-11],但提出深度降酮标准(<20 ng/dl)可作为临床更佳治疗预后和调整治疗的参考指标[12],深度降酮理念逐渐深入人心。
睾酮水平是决定前列腺癌患者是否达去势水平的唯一标准,并与患者的结局和预后密切相关,而睾酮的检测方法是否科学,直接决定了睾酮检测值的准确性。因此,睾酮水平的测定值是否准确,测定方法的灵敏度和准确度是否恰当就显得至关重要。
张宁教授对睾酮去势水平从50 ng/dl下降至20 ng/dl这一历史演变分享了自己的观点
上世纪受限于时代背景下的睾酮检测技术——放免法/化免法,由于仅能检测睾酮的代谢产物,无法精确反映单纯睾酮或游离睾酮的水平,因此将小于50 ng/dl作为睾酮去势标准。随着检测技术的进展以及临床需求对睾酮检测提出了更高要求,一方面需避免对前列腺癌患者造成不可逆的器官缺失,另一方面,去势药物的发展将睾酮水平降得越来越低,并且接受ADT治疗后的低睾酮水平,与患者至去势抵抗时间、生活质量和总生存期等预后指标更佳密切相关,20 ng/dl已成为部分国际指南的已有或推荐睾酮去势标准。
正是基于当前的精准检测方法以及严格的前瞻性随访,更多的证据证实前列腺癌患者接受ADT治疗后睾酮水平越低,生存获益更大。来自加拿大多伦多大学的Tiwari教授团队,在95例接受ADT治疗平均24.1个月的前列腺癌患者中首次比较了RIA、CLIA和MS三种常用检测方法测定的睾酮值的差异。根据每种方法的睾酮检测结果,将患者分为<20 ng/dl、20-50 ng/dl和>50 ng/dl 三组,每组的患者比例分别为:CLIA法,94.7%、2.1%和3.2%;MS法,93.7%、4.2%和2.1%,RIA法,80.0%、16.8%和3.2%。RIA法与另外两种方法相比,<20 ng/dl组的患者比例有显著差异(p<0.001)。采用3x3表分析不同方法对患者分组的一致性,CLIA 和MS的一致性为 95.7% ,加权的Fleiss Cohen kappa 值为0.838 (95% CI 0.656-1),MS和RIA以及RIA 和 CLIA之间分别为81.1% 和0.504 (95% CI 0.207-0.801) 及83.2% 和 0.582 (95% CI 0.336-0.828),详见表1。[1]表1. 不同检测方法对睾酮<20 ng/dl、20-50 ng/dl和>50 ng/dl患者分组的两两比较[1]
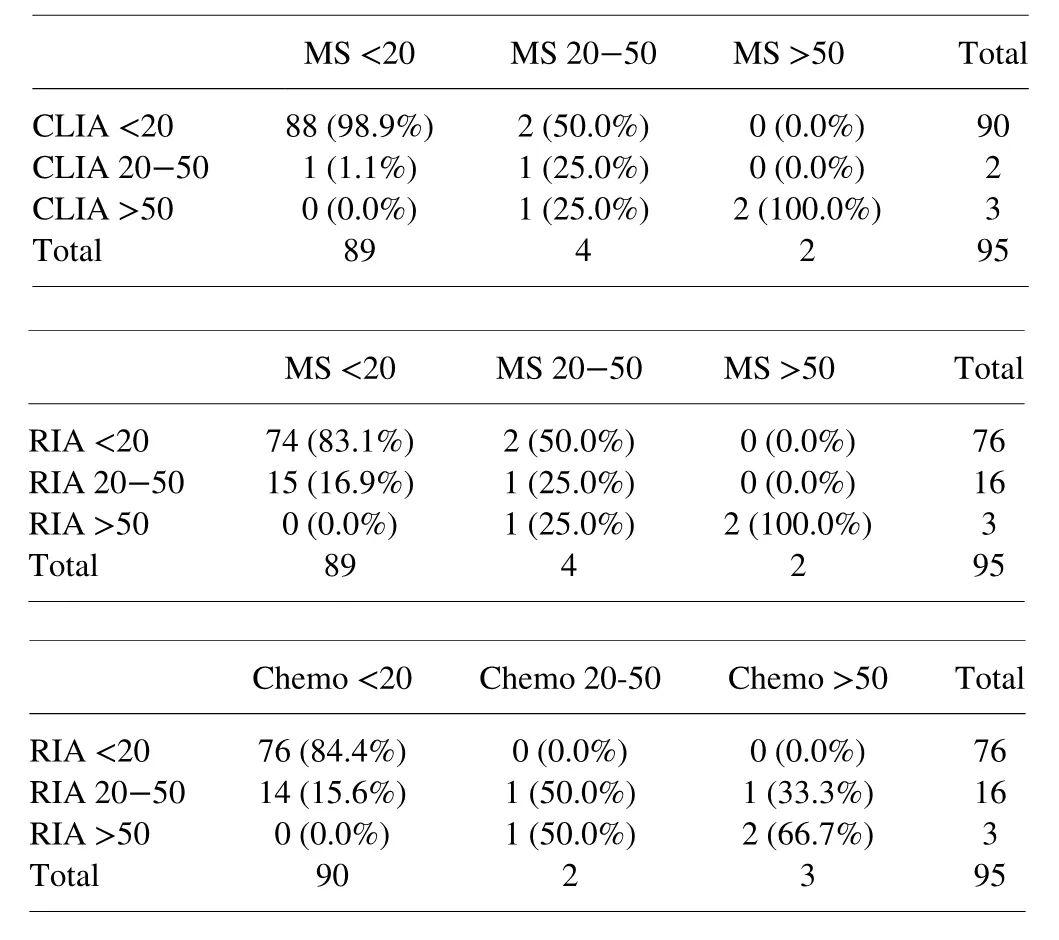
进一步的亚组分析显示,采用CLIA和RIA法检测睾酮值>20 ng/dl的24例患者以MS法检测时,16例睾酮值<20 ng/dl,即CLIA和RIA法高估了66.7%的患者的睾酮值,在全队列中睾酮值高估的比例为16.8%。而采用CLIA和RIA法检测睾酮值<20 ng/dl的90例患者以MS法检测时,4例睾酮值>20 ng/dl,即CLIA和RIA法低估了4.4%患者的睾酮值,在全队列中睾酮值低估的比例为4.2%。
该研究结果显示,与免疫分析法相比,MS法通常可检出较低水平的睾酮,特别当睾酮水平低于20 ng/dl时。CLIA和RIA检测方法会高估相当一部分以MS检测睾酮水平<20 ng/dl的患者,在临床上,这会导致实际达到去势标准(MS法<20 ng/dl)的接受ADT治疗的患者被认为未达去势标准(免疫法>20 ng/dl),从而遵照指南换为其他ADT药物治疗,带来不必要的经济负担或治疗副作用。
此结果与既往两项比较CLIA和MS法的研究结果一致,即CLIA高估了相当一部分样本的睾酮值,约一半以CLIA法检测>20 ng/dl的患者以MS法检测时<20 ng/dl[13,14]。这说明MS法更适用于在更低的睾酮水平区间精确检测,而RIA和CLIA易受其他与睾酮化学结构接近的类固醇激素(雄烯二酮、双氢睾酮和雄烯二醇)的影响而干扰低睾酮水平时的检测结果[15]。基于MS法在低睾酮区间的敏感性、精确性及稳定性,加拿大泌尿外科指南、美国内分泌协会推荐MS法用于低睾酮水平(<20 ng/dl)患者的测定[16]。《前列腺癌睾酮管理中国专家共识2021版》也指出,CLIA法较RIA法自动化程度高、试剂保质期长、且无放射性污染,临床实践中更为普及;MS法检测睾酮具有更好的敏感性、精确性及稳定性,值得在临床实践及相关科研工作中探索应用。共识还指出,患者应尽量在同一实验室并使用相同方法检测,临床研究中如需将多检测平台来源的睾酮检测结果进行数据统计分析,必须在检测之前进行标化校准[9]。
基于准确且适宜的检测方法,对前列腺癌患者治疗期间的睾酮进行合理的监测,并根据监测结果调整治疗策略,是前列腺癌全程管理中的重要环节。国内医疗机构大部分应用化免法或放免法;虽然质谱法(液相质谱和双相质谱)的精度更高,但受限于专业团队、专用试剂盒和高额费用,其在国内的普及率较低。如本研究的结果显示,应用质谱法检测可避免传统检测方法对去势水平的过高估计,从而减少患者不必要的治疗方式的更改,降低治疗策略制定时的过度评价,体现了质谱法的价值,相信在未来,质谱法将成为睾酮检测的发展方向。在临床实践中,我们需要重视不同睾酮检测方法对治疗方式造成的改变和影响。若检测方法不准确,就可能对患者造成不必要的治疗负担和副作用。国际国内权威指南均推荐在接受药物去势治疗期间对睾酮水平进行规律监测,但监测频率并不完全一致,详见表2。
表2. EAU、NCCN及CUA前列腺癌患者睾酮监测策略比较[9-12]
《前列腺癌睾酮管理中国专家共识(2021版)》对患者接受ADT治疗期间的监测策略做出了详细且明确的推荐,详见图2。
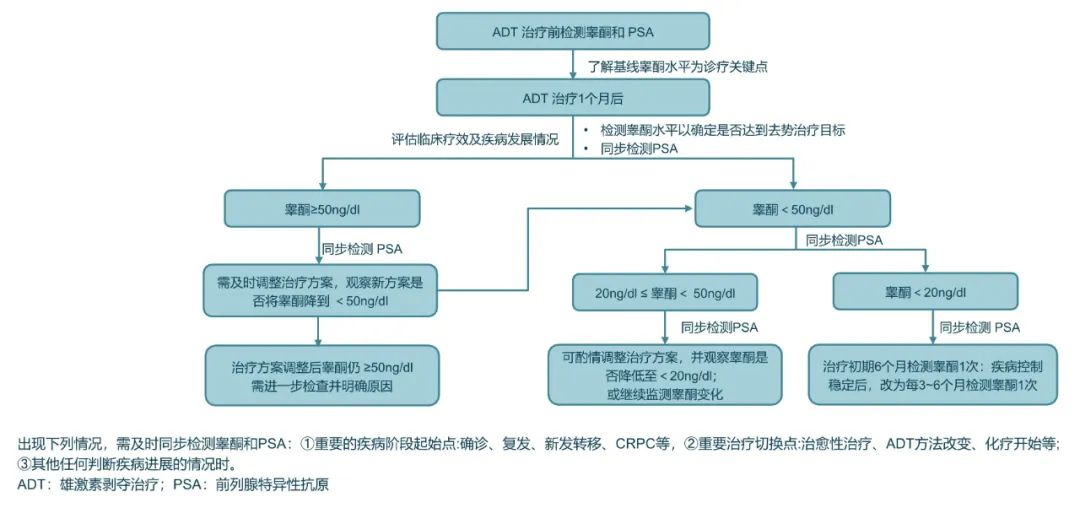
图2. ADT治疗期间的睾酮监测和管理规范化流程图[12]
张宁教授就睾酮检测和监测分享了自己的观点,并结合自身临床实践经验给出建议
①质谱法检测费用非常高,这限制了其在临床的广泛应用,而只是更多应用于研究方面。但犹如基因检测发展及临床应用的历史进程,未来随着经费、耗材和检测时间的下降,质谱法一定会逐渐推广到临床。
②树立并践行规范监测睾酮的理念。当前部分医院及医生在前列腺癌诊治过程中,仍以PSA检测为主,忽视睾酮检测的重要性。睾酮检测在前列腺癌的筛查、初诊时的基线水平、接受ADT治疗后的去势水平以及接受单纯局部治疗后的随访监测中均发挥重要提示作用。现在在我们科室,我要求科里医生对每位前列腺癌患者进行常规睾酮监测。
③睾酮水平不仅可作为男性雄激素缺乏后出现症状后调整治疗的信号,更可作为前列腺癌监测、随访中的重要指标,以评估前列腺癌的生长状态。尤其在转移性前列腺癌患者中,无论是激素敏感性还是去势抵抗性,ADT治疗都是背景和基础,而睾酮监测作为ADT治疗的评估手段就显得尤为重要。
④在睾酮监测的随访频率方面,当接受ADT或ADT联合新型内分泌治疗初始3-6个月稳定期,我建议每个月进行一次睾酮监测,当治疗持续半年以上病情稳定后,睾酮监测频率可延长至3个月到6个月。
⑤前列腺癌治疗过程中,若出现PSA或影像学进展,睾酮检测也同样重要。当出现睾酮逃逸时,更换新型内分泌治疗或ADT治疗方案就可能控制睾酮水平,从而进一步控制患者症状及疾病进展。
总体而言,睾酮的检测和监测,在前列腺癌的筛查、初诊、随访、进展和转归都起着非常重要的作用,需重视对待。
睾酮检测贯穿前列腺癌诊断、评估、治疗及预后评价多个过程,对于不同疾病阶段的前列腺癌患者均具有重要临床意义。而睾酮值是否达去势标准有助于临床医生判断患者接受ADT治疗的疗效及预后,并指导进一步的治疗策略。因此,在前列腺癌患者接受ADT治疗期间,临床医生应重视全程治疗中睾酮的合理监测,并注意不同测定方法导致的睾酮值的变异性,从而更好地进行睾酮监测并指导治疗。1. Raj Tiwari M.D., F.R.C.S.a., et al., Variability in testosterone measurement between radioimmunoassay (RIA), chemiluminescence assay (CLIA) and liquid chromatography-tandem mass spectrometry (MS) among prostate cancer patients on androgen deprivation therapy (ADT). Urologic Oncology: Seminars and Original Investigations, Elsevier, 2022, 40(5): 193. e15-193. e20.2. Reis and O. L., Variations of serum testosterone levels in prostate cancer patients under LH-releasing hormone therapy: an open question. Endocr Relat Cancer, 2012. 19(3): p. R93-8.3. Oefelein, M.G., et al., Reassessment of the definition of castrate levels of testosterone: implications for clinical decision making. Urology, 2000. 56(6): p. 1021-1024.4. Valentina, et al. Effects of Serum Testosterone Levels After 6 Months of Androgen Deprivation Therapy on the Outcome of Patients With Prostate Cancer. Clinical Genitourinary Cancer, 2013, 11(3): 325-330. e1.5. Klotz, L., et al., Nadir testosterone within first year of androgen-deprivation therapy (ADT) predicts for time to castration-resistant progression: a secondary analysis of the PR-7 trial of intermittent versus continuous ADT. Journal of Clinical Oncology, 2015. 33(10): p. 1151.6. Ding*, M., et al., MP22-04 INVESTIGATING THE IMPACT OF A LOWER TESTOSTERONE THRESHOLD ON CASTRATION-RESISTANT PROGRESSION IN PATIENTS ON CONTINUOUS ANDROGEN DEPRIVATION THERAPY. The Journal of Urology, 2019. 201(Supplement 4): p. e317-e318.7. Shiota, M., et al. The prognostic impact of serum testosterone during androgen-deprivation therapy in patients with metastatic prostate cancer and the SRD5A2 polymorphism. Prostate Cancer and Prostatic Diseases, 2016, 19(2): 191-196.8. Klotz, L., et al., Testosterone suppression in the treatment of recurrent or metastatic prostate cancer—A Canadian consensus statement. Canadian Urological Association Journal, 2018. 12(2): p. 30.9. Mottet, N., et al. EAU-EANM-ESTRO-ESUR-ISUP-SIOG Guidelines on Prostate Cancer. Arnhem: European Association of Urology, 2022. https://d56bochluxqnz.cloudfront.net/documents/full-guideline/EAU-EANM-ESTRO-ESUR-ISUP_SIOG-Guidelines-on-Prostate-Cancer-2022_2022-04-25-063938_yfos.pdf.10. NCCN prostate cancer guideline vesion 4. 2022. https://www.nccn.org/professionals/physician_gls/pdf/prostate.pdf.11. 黄健, 等. 中国泌尿外科和男科疾病诊断治疗指南[M],2019,科学出版社.12. 中华医学会泌尿外科学分会. 前列腺癌睾酮管理中国专家共识(2021版). 中华泌尿外科杂志, 2021. 42(4): p. 5.13. Morote, J., et al., Serum testosterone levels in prostate cancer patients undergoing luteinizing hormone-releasing hormone agonist therapy. Clinical Genitourinary Cancer, 2018. 16(2): p. e491-e496.14. Rouleau, M., et al., Discordance between testosterone measurement methods in castrated prostate cancer patients. Endocrine connections, 2019. 8(2): p. 132-140.15. Leppert, J.T., et al., The sensitivity of testosterone immunoassays and their role in monitoring antiandrogen therapy. Urologic Oncology Seminars & Original Investigations, 2006. 24(4): p. 277-278.16. William, R., et al., Utility, Limitations, and Pitfalls in Measuring Testosterone: An Endocrine Society Position Statement. Journal of Clinical Endocrinology & Metabolism, 2007(2): p. 405-13.本视频/资讯/文章是由益普生医学团队编辑/医疗卫生专业人士撰写提供,旨在用于医疗卫生专业人士间的学术交流,不支持以任何形式转发给非医疗卫生专业人士;如有违反,责任自负;转发给其他医疗卫生专业人士时,也请自觉保护知识产权。
本视频/资讯/文章的内容不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议。内容中出现任何药品并非为广告推广目的,医疗卫生专业人士如进行处方,请严格遵照该药品在中国批准使用的说明书。益普生不承担任何相关责任。
DIP-CN-010360 有效期至2023年10月20日
凡署名原创的文章版权属《肿瘤瞭望》所有,欢迎分享、转载。本文仅供医疗卫生专业人士了解最新医药资讯参考使用,不代表本平台观点。该等信息不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议,如果该信息被用于资讯以外的目的,本站及作者不承担相关责任。
























