中枢神经系统(CNS)损伤
(如中风、脊髓损伤等)因再生能力有限,传统细胞移植疗法面临移植细胞存活率低、功能整合差等挑战。尽管干细胞技术为神经修复带来希望,但移植后细胞易受炎症微环境影响而死亡,甚至加剧损伤。生物材料通过提供物理支撑、营养支持和免疫调控,有望改善细胞移植疗效,但其设计需兼顾生物相容性、功能导向性及临床转化可行性。
因此,如何
开发高效、安全的生物材料以协同细胞移植实现功能恢复
,成为神经组织工程领域亟待突破的难题。
鉴于此,来自
丹麦奥胡斯大学的Menglin Chen团队与上海交通大学的Di Sun团队
联合,系统综述了
生物材料与细胞共移植在神经组织工程中的应用进展
,探讨其增强神经营养效应、促进细胞整合及功能恢复的机制。相关研究以
“Designed Biomaterial-Enhanced Cell Transplantation for Neural Tissue Engineering”
为题发表在
《aggregate》
上。

以下是对本论文创新点的简要概述:
(1)多模态生物材料协同调控:
综述提出通过整合水凝胶、脱细胞基质及导电支架等材料特性,模拟天然神经微环境的力学与生化特征。例如,光交联透明质酸(HA)与脱细胞基质(dECM)复合水凝胶可显著促进海马神经元生长;导电MXene-GelMA支架则通过电刺激加速轴突再生。这类多模态设计为精准调控细胞行为提供了新思路。
(2)功能化材料突破递送瓶颈:
研究团队总结了功能化颗粒支架(如载药微凝胶)与光/电响应材料的前沿应用。例如,可注射石墨烯-氮化碳纳米纤维通过光刺激诱导神经突生长,而双药缓释水凝胶(如PTX+MH)则协同抑制炎症并促进再生。这些策略解决了传统疗法药物释放不可控、靶向性不足的痛点。
(3)免疫调控与再生协同策略:
综述强调通过生物材料调节宿主免疫反应以提升移植疗效。例如,FasL功能化水凝胶可抑制T细胞介导的移植排斥,而MSC与胶原支架共移植显著减少小胶质细胞活化。此类免疫兼容设计为慢性炎症环境下的神经修复提供了新方向。
本综述系统解析了生物材料在神经修复中的多维创新策略,为临床转化提供了理论支撑与技术路径。
1. 水凝胶与脱细胞基质的协同神经修复策略
生物材料在神经组织工程中的核心作用在于模拟天然神经微环境,为移植细胞提供物理支撑和生化信号。
水凝胶因其与中枢神经系统(CNS)相似的柔软力学特性,成为理想的支架材料。例如,透明质酸(HA)与脱细胞基质(dECM)复合水凝胶通过光交联技术形成动态网络,显著促进海马神经元轴突延伸和突触形成。研究显示,dECM浓度梯度调控(1-8 mg/mL)可优化神经元生长,其中5-8 mg/mL的dECM显著提升神经突长度和密度。此外,胶原-dECM复合支架通过整合细胞粘附因子和生长因子,增强移植细胞的存活与功能整合。这类多模态设计不仅模拟了CNS的力学特性,还通过动态降解匹配组织再生周期,为慢性损伤修复提供新思路。
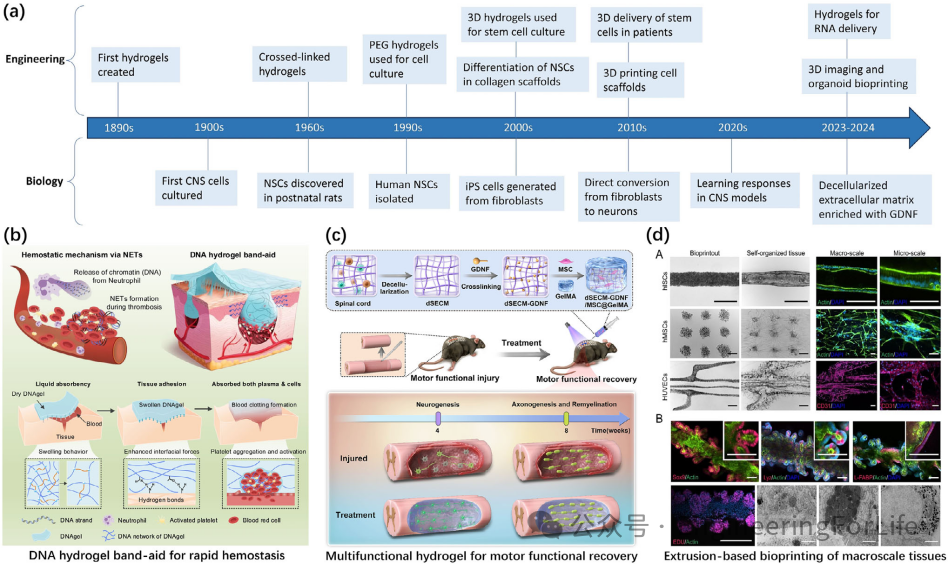
图1 多模态水凝胶与脱细胞基质协同促进神经修复示意图
2. 导电生物材料的神经电调控突破
神经组织的电敏感性要求生物材料具备导电性以增强电信号传递。
MXene-GelMA导电支架结合脱细胞脐带(DUC)的天然生物活性,显著促进神经元突触延伸和雪旺细胞迁移。MXene的二维层状结构赋予材料高导电性,而GelMA提供柔性支撑,模拟CNS微环境的力学特性。实验表明,DUC-MXene-GelMA导管植入脊髓损伤模型后,运动诱发电位显著增强,轴突再生速度提升约30%。此外,金纳米纱球(GYBs)与微凝胶复合的导电多孔水凝胶(CMH)通过调控电导率(0.1-10 S/m),实现神经细胞的定向分化和功能恢复。这类导电材料不仅促进局部电信号传递,还可通过外源电场刺激加速神经回路重建。
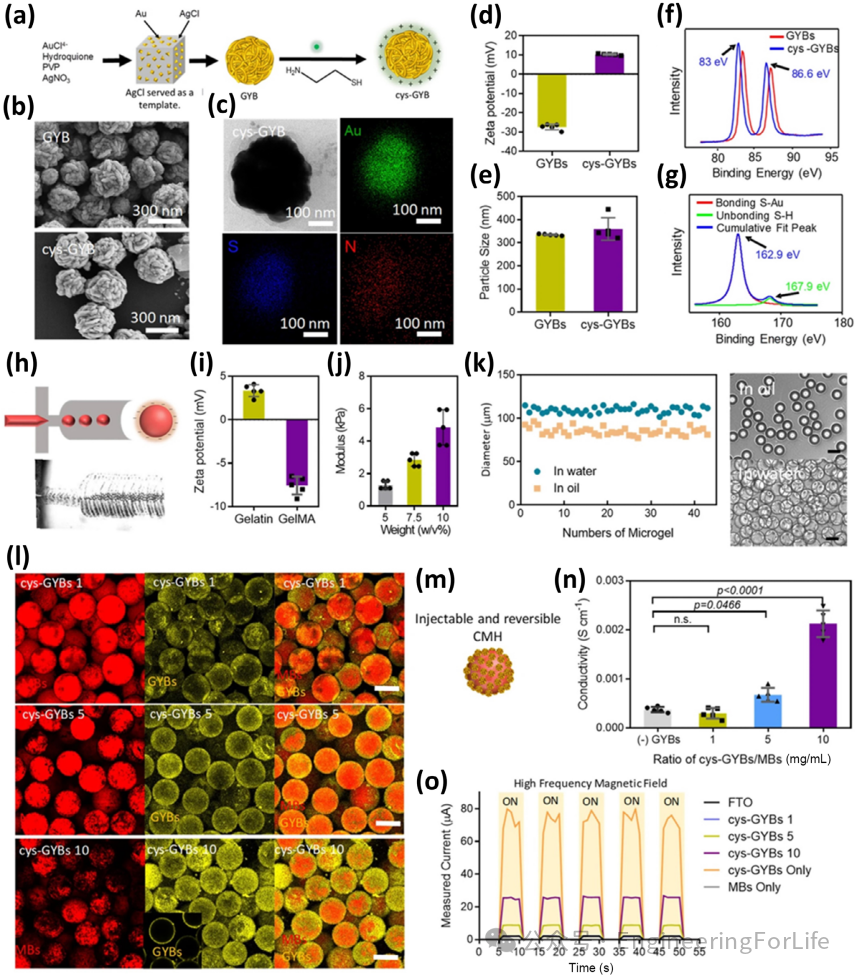
图2 MXene-GelMA导电支架与电调控神经再生示意图
3. 微凝胶定向血管化与药物控释系统
针对神经修复中血管生成不足的难题,可注射微凝胶支架(GHS)通过精确调控孔隙结构(20-200 μm)实现血管定向生长。
GelMA微凝胶结合显微穿刺(MP)技术,在损伤区域形成互联孔道,引导内皮细胞迁移和血管网络形成。实验显示,GHS植入中风模型后,血管密度提升2倍,且异常血管生成减少50%。此外,载药微凝胶(如PLA-PTX/MH双药系统)可实现8周缓释,同步抑制炎症并促进轴突再生。例如,载有脑源性神经营养因子(BDNF)的两亲性肽水凝胶,在脊髓损伤模型中维持神经营养因子活性,显著改善运动功能评分(BBB评分提升至10-11)。这类系统通过空间-时间可控的药物递送,优化了微环境调控与功能修复的协同效应。
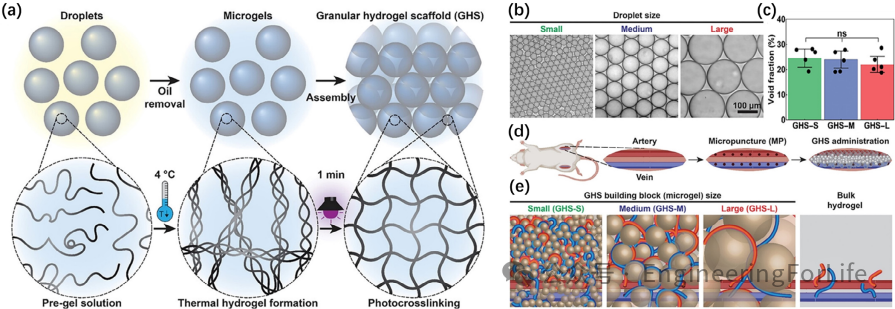
图3 可注射微凝胶定向血管化与双药缓释系统示意图
4. 光响应材料与神经光-电协同刺激
光催化材料(如g-C3N4/GO)与电活性支架的结合,为神经再生提供了非侵入式调控手段。
3D打印的PCL/明胶纤维表面负载g-C3N4纳米片,在可见光刺激下产生光电流,诱导PC12细胞神经突延伸长度增加近20倍。实验表明,光-电协同刺激可激活钙离子通道,促进神经元分化和突触成熟。此外,仿生光响应纤维(如pNE/rGO/g-C3N4复合纤维)通过调控光致电子转移,减少载流子复合,增强光催化效率。这类材料在帕金森病模型中显著改善多巴胺能神经元存活率(提升40%),并减少α-突触核蛋白异常聚集。光-电双模刺激为精准调控神经再生提供了创新工具。
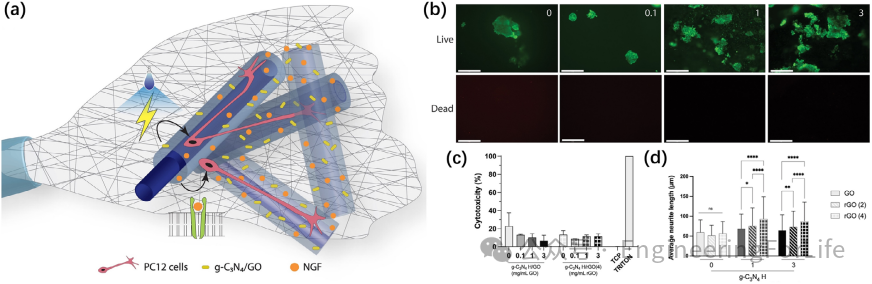
图4 光响应纳米纤维诱导神经突定向生长示意图
综上所述,
生物材料与细胞共移植技术
为中枢神经损伤修复开辟了全新路径,但其临床应用仍面临多重挑战。
未来需
进一步优化材料的动态响应性(
如降解速率匹配组织再生周期)
、标准化细胞-材料复合体系的生产流程,并深入探索材料介导的免疫调控机制。此外,结合人工智能与类器官技术,开发个性化生物支架有望实现精准修复。尽管当前研究以动物模型为主,但随3D打印、原位自组装等技术的成熟,生物材料驱动的神经再生疗法将加速迈向临床,为脑卒中、脊髓损伤等患者带来福音。
参考资料:
https://doi.org/10.1002/agt2.70022
来源:
EngineeringForLife
声明:仅代表作者个人观点,用于研究用途,作者水平有限,如有不科学之处,请在下方留言指正
!






