
大家好!今天我们来介绍一篇关于线粒体的综述,该文章发表在Cancer Research,题目为“Ribosome Biogenesis: A Central Player in Cancer Metastasis and Therapeutic Resistance”,核糖体的生物发生是一个多步骤过程,这一过程受到多个检查点和监测机制的严格控制,这些检查点和通路的扰动可能会导致核糖体生物发生的过度激活,而核糖体蛋白突变和异常核糖体会使患者产生预后不良。本文主要介绍了核糖体生物发生失调的各个方面,以及由此产生的核糖体对恶性肿瘤行为、治疗耐药性和临床结果的影响。了解这一过程的重要决定因素将有助于改进现有的治疗策略,使核糖体靶向治疗成为癌症患者的一种有前景的治疗方式。

核糖体是由核糖体RNA(rRNA)和核糖体蛋白组成的复杂集合,其功能是将信使核糖核酸(mRNA)中包含的遗传信息翻译成蛋白质,调控细胞生长、细胞分裂和分化等基本生物过程。细胞异常生长和增殖依赖于蛋白质合成和翻译的增加,这就需要过度激活的核糖体生物发生过程。在癌症中,信号通路失调、代谢重编程和非编码RNA的异常表达可促进RNA聚合酶I (RNA Pol I)转录活性,导致核糖体生物发生过度激活。癌细胞内含有一类特殊的核糖体可促进致癌基因的翻译程序、调节细胞功能并促进代谢重组。核糖体蛋白、rRNA加工和核糖体装配因子的会导致核糖体疾病,增加恶性肿瘤发生的风险。
近几十年来,有研究证据表明核糖体生物发生失调与肿瘤发生密切相关。例如,致癌转录因子c-Myc通过调控与核糖体生物发生相关的基因表达来促进蛋白质合成和翻译。虽然核糖体生物发生对肿瘤转移、治疗耐药和临床结果的影响机制尚不完全清楚,但本文通过整合最新的研究结果,提出了核糖体生物发生与肿瘤转移之间的关系以及潜在的治疗方法。
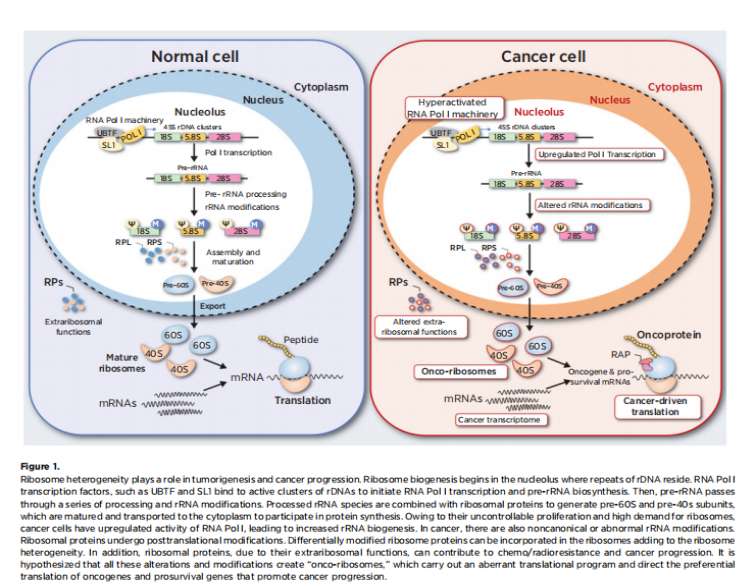
随着癌细胞中不规则数目和形状的核仁的鉴定,核糖体生物发生失调在癌症中的重要性得到初步显现。病理学家采用核仁组成区相关蛋白(AgNOR)染色来标记核仁,并逐步成为恶性细胞的标志,从而使人们认识到核仁的表型反映了核糖体的生物发生。通过抑制核糖体生物发生阻止细胞增殖,可以确定核糖体的生物发生和细胞周期进展之间是否发生相互作用。该研究表明,核糖体的生物发生可能在肿瘤转化中发挥重要作用,其中主要的抑癌基因视网膜母细胞瘤和p53通路的异常刺激了核仁功能,并导致核仁增大。
在多种血液系统恶性肿瘤和实体肿瘤中发生的核糖体蛋白突变进一步证实了核糖体异常与癌症密切相关,人类和动物细胞模型中的此类突变在核糖体组装、细胞增殖和恶性转化方面表现出缺陷和异常。随着对核糖体生物发生复杂性的研究的不断深入,人们发现癌症中核糖体生物发生的改变可能起始于核糖体DNA(rDNA)转录的诸多关键步骤,通过核糖体修饰共同引发肿瘤的发生和转移。
长期以来,核糖体一直被认为是具有恒定成分的复杂机器。有学者提出核糖体的组成可能有异质性,而这种异质性可以调节翻译和蛋白质合成速率,但这一观点受到了挑战。由于核糖体组成的复杂性,异质性可由其任何组分的变异引起,如rRNA修饰、rRNA变异、核糖体蛋白的化学计量比和旁系同源体、翻译后修饰以及核糖体相关蛋白。这些核糖体组成的变异有助于“特异核糖体”的产生,或者癌症中“癌核糖体”的产生。
核糖体异质性在肿瘤发生和进展中发挥着作用,主要是由于rRNA等位基因的组织特异性表达。rRNA修饰改变已成为引发肿瘤或促进癌症进展的驱动因素。核糖体的异质性组成赋予核糖体特殊功能,从而促进正常和病理情况下某些mRNA的优先翻译,核糖体在保持高保真度的同时高效翻译的能力对细胞的存活和增殖至关重要。
研究表明癌细胞的转移定植需要上皮细胞-间充质转化(EMT)来促使细胞逃离原发肿瘤并侵袭转移部位。EMT是指上皮细胞通过特定程序转化为具有间质表型细胞的生物学过程,是一种重要的形态变化,被认为是胚胎组织器官发生和形态发生的重要过程,在肿瘤转移中也起重要作用。对于代谢活跃的细胞来说,核糖体的生物发生是一个重要的过程,因此增加的核糖体生物发生可能是执行EMT程序所需的代谢可塑性的必要条件。EMT的表观遗传调控已得到证实,然而,最近的研究发现rDNA的表观遗传调控与EMT的相互作用可能引发肿瘤侵袭和转移。近年来,已有大量研究证实核糖体蛋白在肿瘤进展和转移中的重要作用。
综上所述,目前的研究不仅证明了rRNA转录调控的重要性,而且强调了表观遗传修饰和核糖体相关蛋白是通过操纵细胞程序类来促进转移潜能的重要因素。因此针对EMT期间诱导的核糖体生物发生的治疗可能是一种可行的治疗方法,不过这仍需要更深入的研究来揭示EMT和核糖体生物发生之间的复杂关系。
癌症患者经过治疗后体内癌细胞仍具有生存能力,并对化疗和放疗产生耐药性,导致临床预后不良。一些研究表明,在癌症模型中参与核糖体生物发生的核糖体蛋白在放射抵抗和化疗耐药中起着重要的作用。除核糖体蛋白外,参与核糖体生物发生的rRNA加工、rRNA修饰和组装蛋白可能在治疗耐药中也发挥重要作用。此外,核仁素,作为核糖体合成和RNA加工所必需的蛋白质,可以提高胶质瘤干细胞对药物替莫唑胺的敏感性,这部分是通过DNA修复调节实现的。靶向肿瘤和特异性核糖体生物发生的目标是为肿瘤细胞提供选择性治疗并最大限度地减少肿瘤治疗副作用。一些癌症化疗药物如顺铂,奥沙利铂,多柔比星和米托蒽醌被发现可以抑制rRNA的转录和加工。BMH-21是一种有效的小分子RNA Pol I抑制剂,它对不同的血液系统恶性肿瘤和实体肿瘤有治疗效果。相比之下,第二代RNA Pol I抑制剂分子PMR-116与CX-5461显示出更好的化学性质及疗效。此外,核周室(PNC)是一种与癌细胞转移行为相关的复杂细胞核结构,可作为生物标记物来筛选靶向核糖体生物发生的抑制剂。原发性肿瘤中PNC的存在与肿瘤的扩散能力和患者的不良预后相关,包括乳腺癌、结直肠癌和卵巢癌等。因此通过抑制RNA Pol I或PNC来阻滞核糖体生物发生为治疗耐药提供了一种新的途径。综上所述,由于核糖体生物发生是促进细胞生存和应激适应性反应的核心过程,部分研究已经探索了用靶向核糖体生物发生来干预放疗抵抗和化疗耐药的治疗策略。
核糖体蛋白突变在多种核糖体病和癌症中得到证实,这表明检测核糖体蛋白水平在预测肿瘤细胞的化疗和放射耐药性方面具有潜力。因此,核糖体蛋白的基因筛查在治疗初期癌症患者中的应用是很有意义的。肿瘤微环境的影响、肿瘤异质性和核糖体异质性都是尚未探索的新领域。肿瘤组织内缺氧和酸中毒等应激因素可产生异常激活的肿瘤区域,这可能对癌症进化为更积极和更耐药的表型产生选择压力。rRNA表观转录组学在肿瘤生长和转移中的研究进展显示出良好的前景,这些rRNA表观转录组修饰可能是重要的诊断标志物,负责这些标记的分子机制有望成为新的药物靶点。然而,由于核糖体生物发生在细胞生存中起着关键作用,在这一过程中的各类参与者可能具有潜在的功能冗余。此外,肿瘤细胞群的多样性导致了核糖体异质性的复杂性,因此靶向肿瘤中所有细胞的核糖体生物发生很难被定义。然而,作为一种联合治疗方法,抑制核糖体生物发生可能提供了一种合理的方式,使肿瘤细胞经过细胞毒性化疗后变得更加脆弱。总之,仍需要更多的研究来从机制上理解核糖体生物发生在肿瘤形成、进展、转移和治疗耐药中的意义。
参考文献:
Amr R Elhamamsy et al. Ribosome biogenesis: a central player in cancer metastasis and therapeutic resistance. Cancer Res. 2022 Mar 18; canres.4087.2021.doi: 10.1158/0008-5472.CAN-21-4087.

本推文由i生信整理整理解读,欢迎分享转发。如需转载,敬请联系小编(微信号:luoyingyuxi)
















