 目前,CGT即细胞基因治疗(Cell and Gene Therapy)在生物医药领域尤其是癌症及遗传病治疗领域极具发展前景。2021年2月,国家药监局《免疫细胞治疗产品临床试验技术指导原则(试行)》提出:免疫细胞治疗是利用患者自身或供者来源的免疫细胞,经过体外培养扩增、活化或基因修饰、基因编辑等操作,再回输到患者体内,激发或增强机体的免疫功能,从而达到控制疾病的治疗方法。据2020版《中国药典》记载:基因治疗制品通常由含有工程化基因构建体的载体或递送系统组成,其活性成分可为DNA、RNA、基因改造的病毒、细菌或细胞,通过将外源基因导入靶细胞或组织,替代、补偿、阻断、修正特定基因,以达到治疗疾病的目的。
目前,CGT即细胞基因治疗(Cell and Gene Therapy)在生物医药领域尤其是癌症及遗传病治疗领域极具发展前景。2021年2月,国家药监局《免疫细胞治疗产品临床试验技术指导原则(试行)》提出:免疫细胞治疗是利用患者自身或供者来源的免疫细胞,经过体外培养扩增、活化或基因修饰、基因编辑等操作,再回输到患者体内,激发或增强机体的免疫功能,从而达到控制疾病的治疗方法。据2020版《中国药典》记载:基因治疗制品通常由含有工程化基因构建体的载体或递送系统组成,其活性成分可为DNA、RNA、基因改造的病毒、细菌或细胞,通过将外源基因导入靶细胞或组织,替代、补偿、阻断、修正特定基因,以达到治疗疾病的目的。
CGT的出现给了人类弥补大自然编码生命体时产生随机错误的可能。随着细胞基因治疗技术创新迭代,从研发到商业化逐步发展,人类将掌握这一有力的治疗工具。按具体技术路线划分,细胞治疗主要包括干细胞疗法和细胞免疫疗法两大类,后者又可分为过继细胞疗法(ACT)、肿瘤疫苗等。ACT包括:嵌合抗原受体T细胞(CAR-T)疗法、T细胞受体嵌合型T细胞(TCR-T)疗法、嵌合抗原受体自然杀伤细胞(CAR-NK)疗法、肿瘤浸润淋巴细胞(TIL)疗法等。基因治疗则可分为溶瘤病毒(OV)疗法和基因疗法两大类,后者又可按照递送载体分为病毒载体和非病毒载体递送系统。本文挑选5种CGT技术介绍如下:
T细胞免疫疗法仍然是癌症治疗领域的研发热点,主要采用嵌合抗原受体(CAR)和T细胞受体(TCR)工程的T细胞。CAR是一种模块化合成受体,由四个主要成分组成:细胞外靶标抗原结合结构域、铰链区、跨膜结构域和一个/多个细胞内信号结构域。工程合成受体CAR的功能是重定向淋巴细胞(最常见的是T细胞),以识别和消除表达特定目标抗原的细胞。CAR与细胞表面表达的靶抗原的结合独立于主要组织相容性复合体(MHC)受体,导致T细胞激活和抗肿瘤反应[1]。
目前全球已有7种CAR-T药物获批上市,近千项CAR-T药物临床(前)实验进行中。CAR-T细胞疗法在癌症治疗中具有革命性,可以产生显著有效和持久的临床反应[2]。但同时CAR-T细胞治疗也具有局限性:抗原逃逸,靶向肿瘤外效应,CAR-T细胞的运输和肿瘤的浸润,免疫抑制微环境,CAR-T细胞相关毒性等都会限制CAR-T疗法对肿瘤的治疗效果。CD19和BCMA是CAR-T细胞治疗中最常见的靶点,多个潜在靶点已被发现可用于CAR-T法治疗血液系统恶性肿瘤,如T和B细胞白血病/淋巴瘤、HL、AML和MM。CAR-T细胞已彻底改变血液瘤的治疗方法,然而障碍仍然存在。而在实体肿瘤中,让CAR-T细胞运输并浸润肿瘤更是一个重大挑战[3]。
表1. 全球(申请)上市CAR-T药物(来源:药渡网,统计截止至2023.2.16)

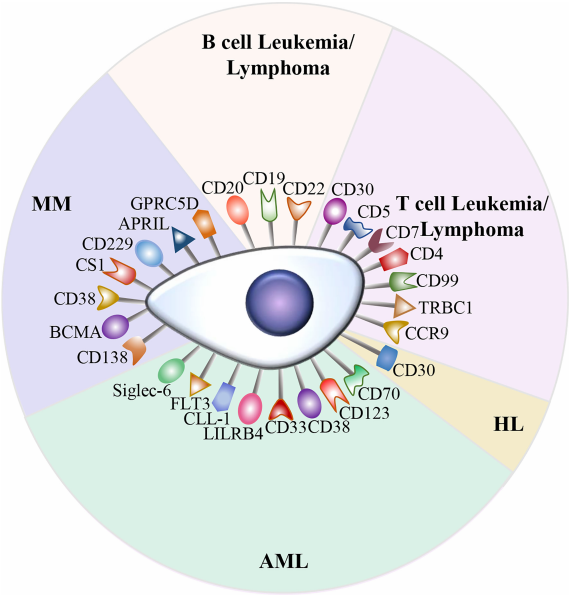
图1. CAR-T治疗血液系统恶性肿瘤的潜在治疗靶点[3]
为了将T细胞重新导向肿瘤细胞,人们利用基因工程技术,使得T细胞可以在体外工程中表达具有癌抗原特异性TCR。CAR识别细胞表面天然折叠的蛋白质,与之不同的是,TCR可以识别来自所有细胞室的蛋白质的HLA呈现的多肽,不受靶细胞表面抗原表达的限制。由此产生的TCR-T细胞能够特异性识别肿瘤相关抗原并有效地消除肿瘤细胞。
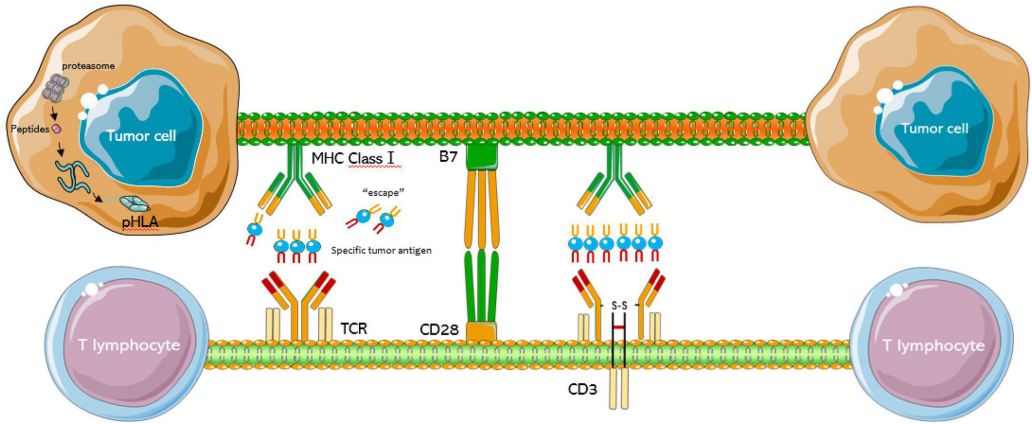
图2. TCR-T细胞结构示意图[4]
MHCⅠ类是癌细胞的细胞内抗原肽,供T细胞受体识别,并被CD28和B7包围[4]。传统的T细胞通过其TCR识别MHC呈递的抗原,TCR是一种由α链和β链组成的二硫键连接的异源二聚体。为了形成一个功能受体,TCR α/β异质二聚体进一步与CD3 ε/γ/δ/ξ亚基形成复合物。TCR识别由MHC分子(pMHC)呈现在细胞表面的酶裂解肽。在人类中,抗原呈递的MHC等位基因大致分为HLA Ⅰ类(A、B或C)或HLA Ⅱ类(DR、DP或DQ),它们分别主要呈现胞质或细胞外衍生肽[5]。
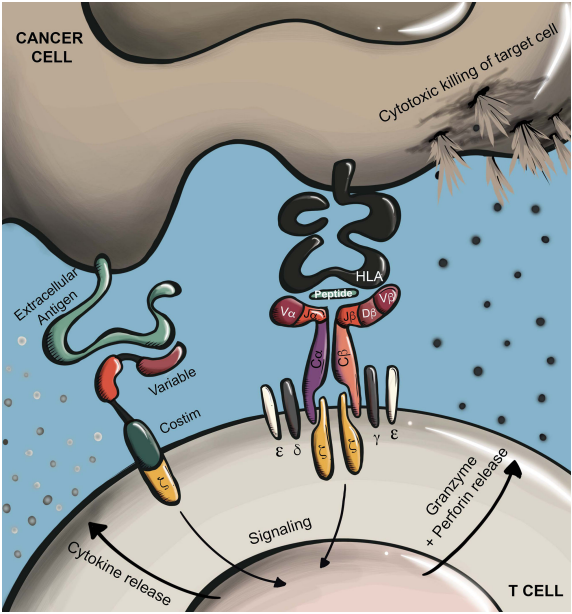
图3. 通过CAR/TCR进行的抗原识别[5]
CAR-T细胞治疗已经在恶性血液肿瘤方面有了重要突破,但其在实体瘤中的作用仍不理想。而TCR-T细胞可以识别在细胞表面和细胞内腔室中表达的抗原,凭此优势,TCR-T细胞治疗在实体瘤的临床试验中显示出令人鼓舞的潜力[6]。
CAR自然杀伤(NK)细胞是先天免疫系统中的一组细胞毒性淋巴细胞,可以对非自身细胞作出快速反应。与识别MHC上呈现抗原的T细胞不同,NK细胞可以在没有MHC的情况下直接识别靶细胞。与CAR-T细胞相比,CAR-NK细胞有几个优势:
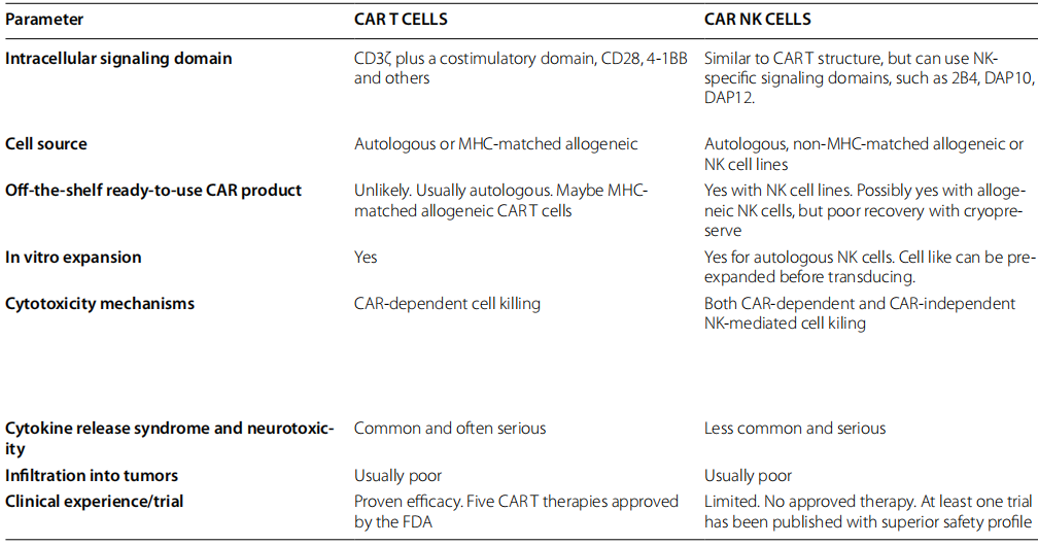
首先,是免疫细胞的来源。这也是CAR NK治疗的主要优势,一个“现成的”CAR NK细胞可以通过大规模生产生产,并随时注入患者。而CAR-T治疗需要使用自体T细胞,许多患者的外周血T细胞计数较低,无法保证及时治疗。其次,是CRS和神经毒性。有研究表明,CAR-NK细胞治疗的患者中,没有一例发生CRS或神经毒性[7]。CAR-T细胞激活导致炎症细胞因子的释放,如肿瘤坏死因子、IL-1β、IL-2和IL-6等[8],从而导致CRS和神经毒性。而CAR-NK细胞释放不同种类的细胞因子,如粒细胞-巨噬细胞集落刺激因子(GM-CSF)[9]。第三,除了通过CAR通路外,NK细胞还有多种机制来靶向和消除癌细胞。如NK细胞是抗体依赖性细胞介导的细胞毒性的关键介质,通过在NK细胞上表达的CD16,可以识别与肿瘤细胞结合的IgG的Fc部分,并杀死癌细胞;NK细胞可以通过参与和/或脱离细胞表面的激活和抑制性杀手Ig样受体(KIRs)而被激活来杀死癌细胞等。第四,NK细胞的寿命有限。NK细胞的平均寿命约为2周,意味着在发生靶向肿瘤毒性的情况下,它可以随着CAR-NK细胞的消失而自我限制。然而,这也产生了一把双刃剑,反复输注CAR-NK细胞可能需要延长缓解。
如上所述,可以考虑NK细胞作为过继细胞治疗的替代方法。虽然CAR-NK细胞治疗相对于CAR-T细胞治疗的优势很明显,但几乎所有与CAR-T治疗相关的局限性也适用于CAR-NK细胞,此外还有其他限制。重新编程具有记忆细胞特性和在体内长期存活的CAR-NK细胞,以进行持续的免疫监测和预防癌症复发正是目前的积极探索领域[10]。
表2. CAR-T、CAR-NK细胞的比较[10]
癌症免疫治疗的理论基础是明确证明免疫系统在限制癌症发生和发展中起着重要作用。ACT是一种癌症免疫治疗形式,可利用患者自身的免疫细胞来寻找和消除肿瘤细胞,然而,供体免疫细胞也可以在某些情况下使用。
在最初发现移植物抗肿瘤反应由T细胞介导后,T细胞癌症免疫治疗受到了极大关注。从切除的肿瘤材料中收集肿瘤浸润淋巴细胞,患者自身(自体)T细胞也可用于ACT,即TIL-ACT。TIL可以在体外增强和扩增,并作为治疗剂送回患者。目前,全球越来越多的临床中心实施了TIL-ACT,这种疗法在转移性黑色素瘤患者中显示出了令人印象深刻的效果。除黑色素瘤外,TIL治疗已被证明对宫颈癌患者具有令人印象深刻的临床益处,并且在结直肠癌、胆管癌、非小细胞肺癌和乳腺癌中也显示了初步疗效[11]。
对于TIL-ACT疗法,建议选择被病毒感染的肿瘤患者和对ICB治疗获得耐药性的患者作为候选人群。具有高突变负担的肿瘤可能对未被选择的TIL的ACT有反应,而免疫原性较差的肿瘤可能受益于:1.特异性肿瘤新抗原的识别,2.针对这些新抗原的专门TIL-ACT产物的生成[12]。
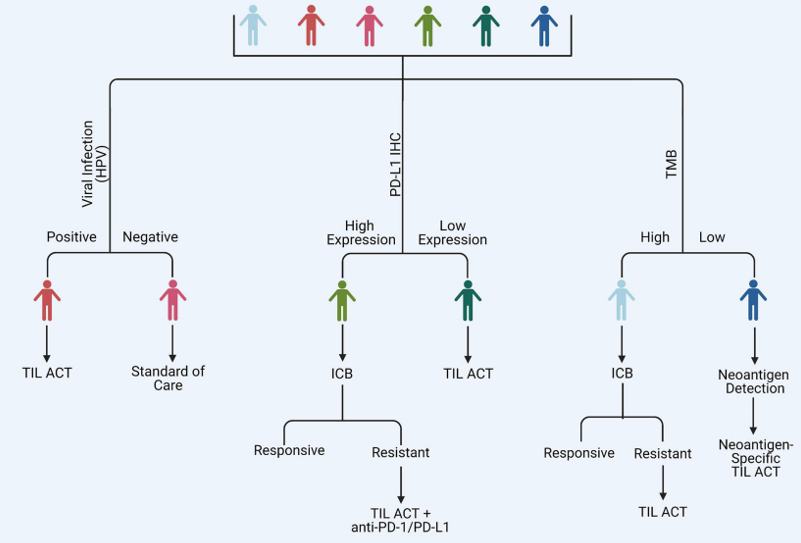
图4. 选择TIL ACT给药患者的潜在策略[12]
TIL治疗在实体肿瘤的治疗中具有一些独特的优势,但仍面临着一系列的挑战。肿瘤免疫抑制微环境仍然是TIL治疗的主要障碍。此外,在有效的肿瘤反应性T细胞的分离和扩展方面仍有相当大的改进空间,替代联合治疗仍需探索[11]。
溶瘤病毒(OV)是一类新兴的癌症治疗药物,近年来一直处于癌症生物治疗的前沿。这是一种会感染和溶解癌细胞但不感染正常细胞的病毒,腺病毒是当下研究最广泛的病毒类型。OV可以自然发生,也可以在实验室中通过修饰自然病毒而产生[13]。其优点如下:可以在肿瘤细胞中选择性复制;传递多个真核转基因有效载荷;诱导免疫原性细胞死亡;促进抗肿瘤免疫;与其他癌症治疗药物不产生交叉耐药,具有可耐受安全性[14]。
迄今为止,全球已批准四种OVs和一种非溶瘤病毒用于治疗癌症,但Talmogene laherparepvec(T-VEC)仍是唯一得到广泛批准的治疗方法。在癌症治疗中,患者的安全性是最重要的,而使用OV似乎是这方面最有前途的。但由于癌症组织的异质性和癌细胞的复杂性,单一类型的OV不足以摧毁所有的癌细胞。一些癌细胞和未转化的支持细胞可能对某些OV具有耐药性,这表明单一类型的病毒治疗药物可能不是对所有类型的癌症都有效。因此,筛选确定最适合患者系统并激活免疫系统对抗肿瘤细胞的病毒和递送方法,是OV治疗中最具挑战性的部分[15]。由于消除肿瘤细胞的机制与其他抗癌疗法明显不同,所以OV是与大多数其他治疗方式相结合的合理选择。
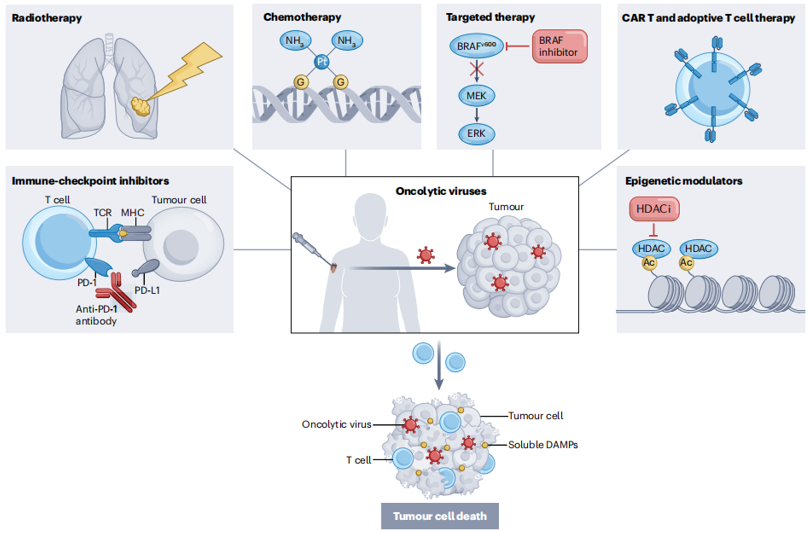
图5. 临床开发中潜在的OV联合策略
迈杰医学为精准医疗提供生物标志物的发现和验证、新药临床试验病人的分子检测和入组筛选、检测方法开发及伴随诊断试剂盒商业化等一体化解决方案,解决创新药物研发痛点及用药痛点。凭借核酸、蛋白、细胞等转化医学全平台可为CGT药物临床实验提供生物标志物检测,如药代动力学、药效学、免疫原性、外源基因整合位点等检测。
图6. CAR-T、TCR-T、CAR-NK、TIL、溶瘤病毒经验全涵盖
迈杰医学已积累了丰富的CGT 临床项目检测服务经验,包括IIT试验,临床前期及I期临床项目40+项。

图7. 细胞治疗临床检测解决方案

图8. 基因治疗临床检测解决方案
当前,CGT已成为最具发展潜力的全球性前沿医药领域之一,在治疗遗传病和恶性肿瘤方面独具优势。尽管存在挑战,但新的策略和潜在的解决方案正在继续演变,并可能为更有效和更安全的治疗提供一条道路。随着细胞基因治疗产品陆续获批上市,“一次性给药,长久性缓解”治疗癌症、血液系统疾病、神经系统疾病和遗传疾病的美好愿景也有望在将来实现。
[1] Sadelain, M., Brentjens, R. & Rivière, I. The basic principles of chimeric antigen receptor design. Cancer Discov. 3, 388–398 (2013).
[2] June, C. H., O’Connor, R. S., Kawalekar, O. U., Ghassemi, S. & Milone, M. C. C. A.R. T cell immunotherapy for human cancer. Science. 359, 1361–1365 (2018).
[3] Sterner RC, Sterner RM. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer J. 2021 Apr 6;11(4):69.
[4] Liu Y, Yan X, Zhang F, Zhang X, Tang F, Han Z, Li Y. TCR-T Immunotherapy: The Challenges and Solutions. Front Oncol. 2022 Jan 25;11:794183.
[5] Shafer P, Kelly LM, Hoyos V. Cancer Therapy With TCR-Engineered T Cells: Current Strategies, Challenges, and Prospects. Front Immunol. 2022 Mar 3;13:835762.
[6] Zhang Y, Liu Z, Wei W, Li Y. TCR engineered T cells for solid tumor immunotherapy. Exp Hematol Oncol. 2022 Jun 20;11(1):38.
[7] Liu E, Marin D, Banerjee P, Macapinlac HA, Thompson P, Basar R, et al. Use of CAR-Transduced Natural Killer Cells in CD19-Positive Lymphoid Tumors. N Engl J Med. 2020;382(6):545–53.
[8] Lee DW, Santomasso BD, Locke FL, Ghobadi A, Turtle CJ, Brudno JN, et al. ASTCT Consensus Grading for Cytokine Release Syndrome and Neurologic Toxicity Associated with Immune Efector Cells. Biol Blood Marrow Transplant. 2019;25(4):625–38.
[9] Klingemann H. Are natural killer cells superior CAR drivers? OncoImmunology. 2014;3(4):e28147.
[10] Pan K, Farrukh H, Chittepu VCSR, Xu H, Pan CX, Zhu Z. CAR race to cancer immunotherapy: from CAR T, CAR NK to CAR macrophage therapy. J Exp Clin Cancer Res. 2022 Mar 31;41(1):119.
[11] Zhao Y, Deng J, Rao S, Guo S, Shen J, Du F, Wu X, Chen Y, Li M, Chen M, Li X, Li W, Gu L, Sun Y, Zhang Z, Wen Q, Xiao Z, Li J. Tumor Infiltrating Lymphocyte (TIL) Therapy for Solid Tumor Treatment: Progressions and Challenges. Cancers (Basel). 2022 Aug 27;14(17):4160.
[12] Kumar A, Watkins R, Vilgelm AE. Cell Therapy With TILs: Training and Taming T Cells to Fight Cancer. Front Immunol. 2021 Jun 1;12:690499.
[13] Hemminki O, Dos Santos JM, Hemminki A. Oncolytic viruses for cancer immunotherapy. J Hematol Oncol. 2020 Jun 29;13(1):84.
[14] Shalhout SZ, Miller DM, Emerick KS, Kaufman HL. Therapy with oncolytic viruses: progress and challenges. Nat Rev Clin Oncol. 2023 Jan 11.
[15] Mondal M, Guo J, He P, Zhou D. Recent advances of oncolytic virus in cancer therapy. Hum Vaccin Immunother. 2020 Oct 2;16(10):2389-2402.




















