T细胞过继转移是一项关键的抗癌技术。想要这类疗法真正用于患者疾病治疗,需要在靶点鉴定、受体设计、T细胞分化、基因工程、细胞生产、政策监管等多个方面取得进展。这类免疫疗法是免疫学、遗传学、合成生物学、干细胞生物学和一系列生产技术的融合。
5月24日,来自纪念斯隆-凯特琳癌症中心和Fred Hutchinson 癌症研究中心的3位科学家在Nature杂志上发表了题为“Therapeutic T cell engineering”的癌症T细胞免疫疗法综述文章。作者们在摘要中表示,基因工程T细胞是一种强大的新型疗法,为癌症患者带来了希望。其中,靶向CD19的CAR-T疗法被证明对治疗B细胞恶性肿瘤具有显著的功效。
按原理来说,工程T细胞疗法适用于多种癌症,但这种更广泛的应用需要进一步的研究来鉴定合适的靶抗原,克服免疫抑制肿瘤微环境,降低毒性以及防止抗原逃逸(antigen escape)。近期,T细胞筛选、基因工程以及细胞生产等方面的研究进展为扩大T细胞疗法的应用范畴奠定了基础。
综述正文部分,作者们分多个模块探讨了T细胞特异性“重定向”、CAR-疗法应用方向、新靶点鉴定、克服肿瘤免疫微环境、工程T细胞生产等方面问题。
以下小编摘编其中部分内容供大家参考:
1
Redirecting the specificity of T cells
第一部分内容主要介绍了重定向T细胞特异性的两种方法:改造T细胞受体(T cell receptor,TCR)(图1a)和设计人工受体(如嵌合抗原受体,即CAR)。
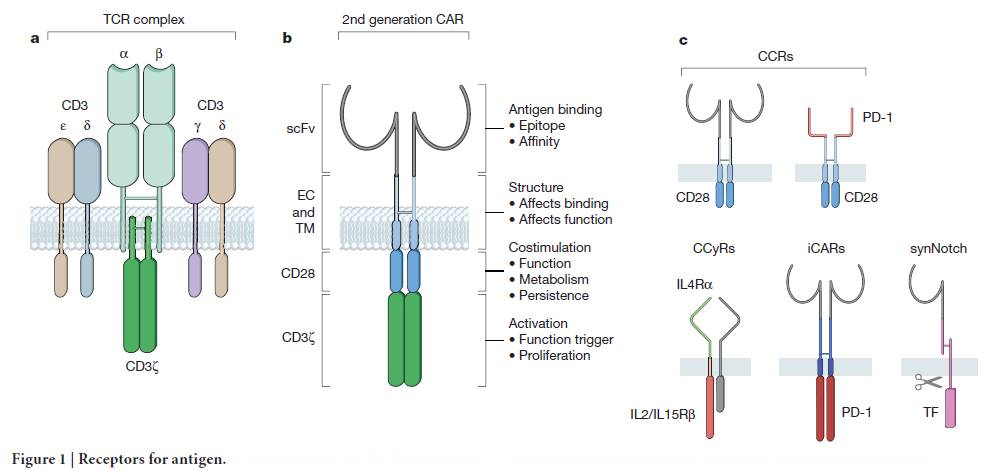
图1(图片来源:Nature)
2
Building up the potency of engineered T cells
第二部分内容主要介绍了第二代CAR的设计和应用(图1b)。同时,该部分内容指出,对T细胞的遗传改造不仅仅局限于通过表达CAR或者TCR重塑其特异性,还可以通过引入其它基因塑造工程T细胞的靶向性和功能性。用于与CARs联合,从而增强T细胞有效性和安全性的分子包括一系列的合成受体,如嵌合共刺激受体、Notch-based受体、抗原特异性抑制受体等(图1c)。
3
Clinical proof-of-concept: the CD19 paradigm
第三部分内容汇总了靶向CD19的CAR-T疗法的部分临床进展(表1),同时强调需要进一步研究如何应对这类疗法的毒性。
相关消息:今年,诺华和Kite Pharma均有一款靶向CD19的CAR-T疗法获FDA颁发的优先审批资格。这让CAR-T疗法离上市又近了一步。具体来说,诺华的CTL-019获得优先审批的适应症是儿童和年轻成人复发和难治性B细胞急性淋巴性白血病;Kite的axicabtagene ciloleucel (KTE-C19) 获得优先审批的适应症是复发或难治性侵袭性非霍奇金淋巴瘤。
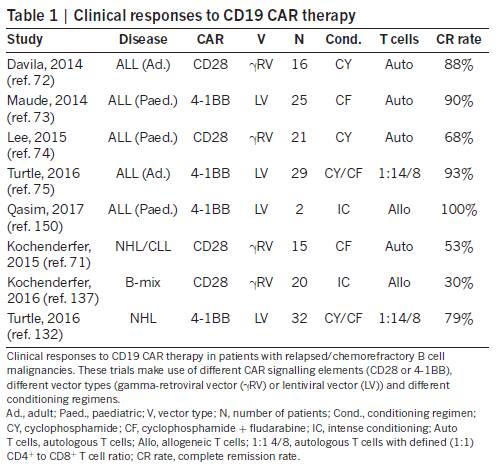
表格来源:Nature
4
Where to apply CAR therapy
第四部分内容介绍称,CAR-T疗法是细胞治疗领域的一个里程碑,也是革命性癌症免疫治疗领域的两大重要治疗手段之一(
另一个是靶向PD-1等检查点分子的抑制剂
)。研究证实,肿瘤携带低突变负荷的患者往往对检查点阻断疗法响应较低。而在一种这类疾病中(急性淋巴细胞白血病),CAR-T疗法证明了它的功效(图2)。作者们称,CAR-T疗法可能对治疗低突变癌症和检查点阻断疗法治疗无效的癌症特别有价值。
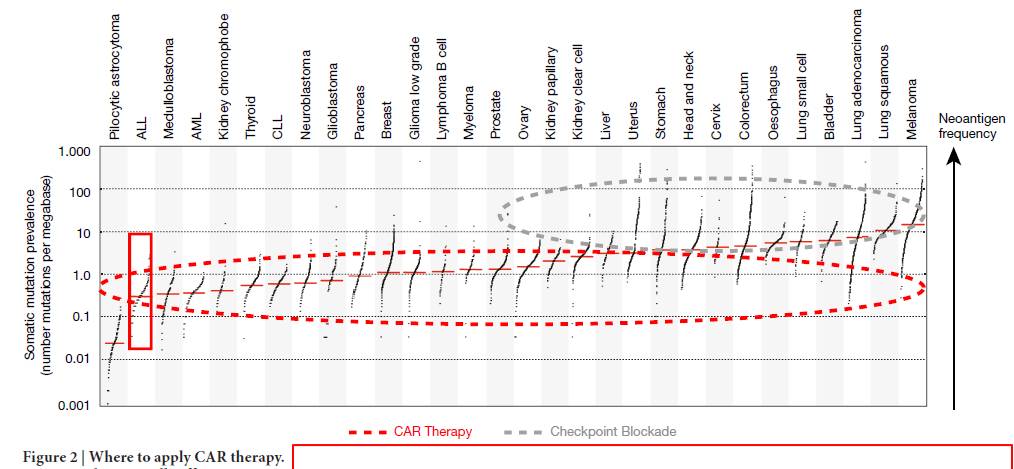
图2(图片来源:Nature)
5
Identification of new targets for engineered T cells
第五部分内容介绍了一些新靶点相关的研究进展,包括CD22、BCMA、EGFRvIII、carbonic anhydrase IX、carcinoembryonic antigen、IL13Rα-2等。同时,该部分内容强调了“组合抗原识别”策略(图1c)。此外,作者们表示,想要找到合适的CAR-T疗法目标抗原需要对肿瘤和所有正常组织的抗原表达进行深入分析,并在相关的模型系统中进行测试,以确定其疗效和肿瘤选择性。
6
Adapting CARs to overcome tumour microenvironments
实体瘤的微环境由多种细胞组成,具有免疫抑制作用,是所有免疫疗法的障碍。在该部分内容中,作者们汇总了一些新研究提出的用于帮助工程T细胞克服微环境障碍的途径(图3),包括联合治疗,以及设计更有效的T细胞来应对这种免疫抑制。





