
化学原研药在专利到期之后,受到仿制药的冲击,在市场销售会迎来陡然的下降,称为“专利悬崖”。 相比于生物类似物高投入、高技术壁垒、高耗时,化学仿制药在仿制方面优势非常明显,成本上更为低廉,国外需要200-300万美元,国内成本还有所下降;耗时较短,仅为生物类似物的一半左右。
然而过去多年时间里,国内迥异于国外仿制药市场,化学原研药在专利到期之后,国内市场价格依旧居高不下,占用巨量医保资金。出现这种畸形市场的根本原因就是本土的仿制药缺乏一致性评价的背书,导致仿制药质量参差不齐,存在低价恶性竞争。招标方面原研药和仿制药以分组形式进行,原研药受到仿制药冲击较小,而仿制药以低价形式进行招标,也极大遏制了国内药物市场的发展,让疗效相当的仿制药无法和原研药同场竞技。
由于之前药物分类政策不太健全,导致每年仿制药申报数量过度,在较大市场空间的药物仿制上存在过度重复、粗犷、恶性竞争的现象,极大影响了本土药物市场的进展。随着相应政策法规的健全,国内药物市场对于药物的临床疗效越发重视,推行“一致性评价”政策成为大势所趋,市场所向。
图1 每年仿制药申请数量
数据显示,2016年仿制药递交申请数量迎来了急剧下滑,仅为2015年的三分之一,究其原因,主要是由于2016年开展仿制药质量与疗效一致性评价纲领性文件的颁布,这足以表现出一致性评价政策对于国内仿制药市场变革的重大影响。
自一致性评价政策颁布和实施起,截止到2018年6月份,CDE公布了四批仿制药名单。
(1)2017年12月份颁布了第一批仿制药质量和疗效一致性评价品种目录,一共17个。
(2)2018年2月份颁布了第二批仿制药质量和疗效一致性评价品种目录,一共5个。
(3)2018年4月份颁布了第三批仿制药质量和疗效一致性评价品种目录,一共7个。
(4)2018年5月份颁布了第四批仿制药质量和疗效一致性评价品种目录,一共12个。
早在2012年和2013年,国务院和国家食品药品监督管理局陆续公布了相关政策,将一致性评价纳入到战略发展层面。不过受制于当时行业的发展,整体创新氛围和市场粗犷的发展,效果甚微。
直到2015年之后,国务院、卫计委、食药监局、发改委等多个国家级部门开始密集着手医药研发相关政策,临床试验数据核查,药品上市许可持有人制度,加快创新药审评审批,鼓励优质创新药品与国际接轨,不遗余力推行一致性评价的实施,更加注重药物临床疗效……旨在全方面打破之前国内药物市场存在的困境。
2016年3月5日,国务院办公厅发布《关于开展仿制药质量和疗效一致性评价的意见》(以下简称《意见》),成为中国医药企业正式开展仿制药质量与疗效一致性评价的纲领性文件。接下来,CFDA不断完善一致性评价细则,发布参比制剂目录、确定BE机构、开展相关培训、征求各方意见、政策上有所倾斜。本土药企在一致性评价浪潮中,权衡利弊,有所取舍,产能更加集中,积极响应国家和市场的号召,争取在2018年年底大限完成核心产品的一致性评价。
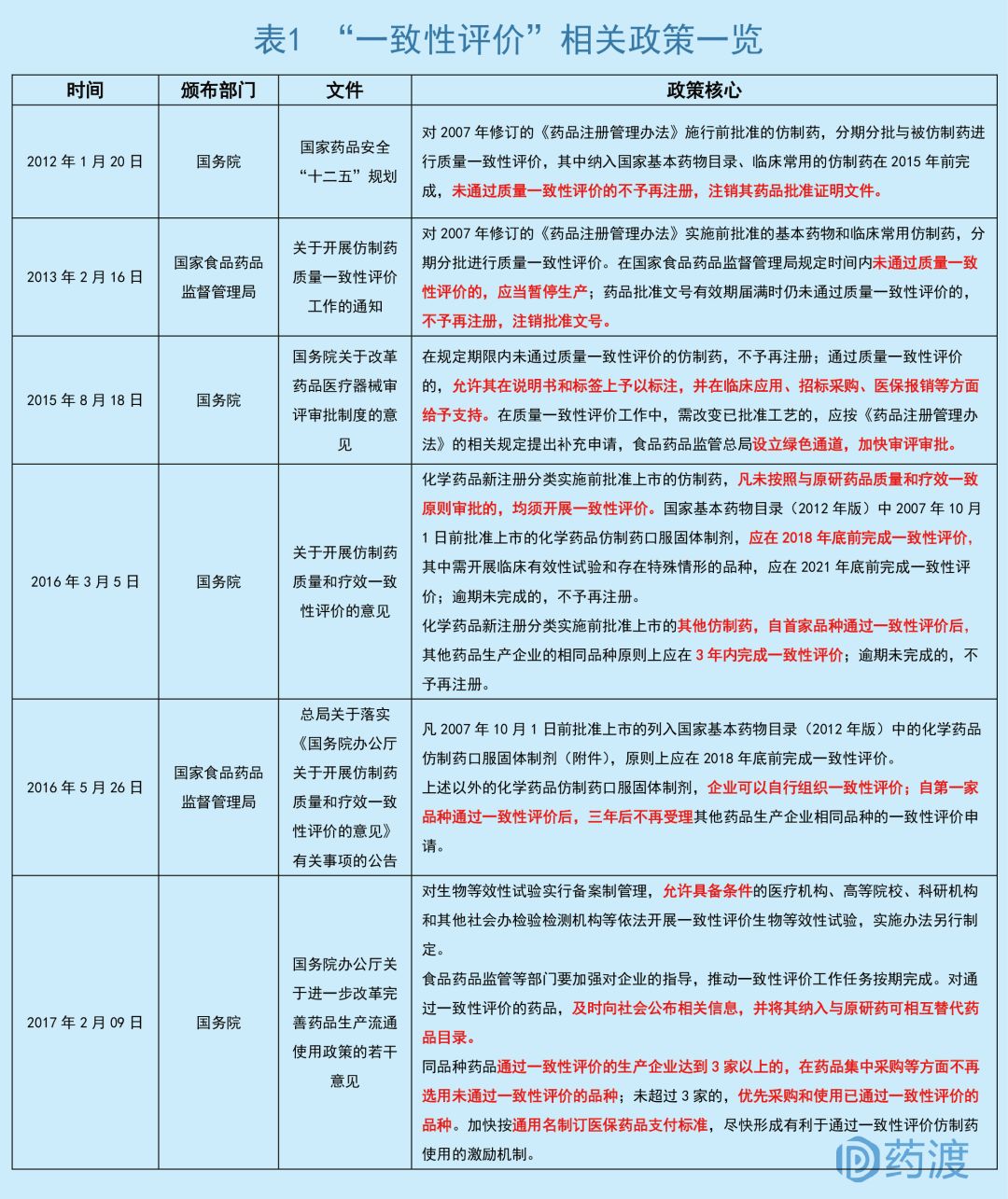
对于2007年10月1日前批准上市的化学药品仿制药口服固体制剂“289目录”之外的药品,企业自行组织一致性评价工作后可以享受三年市场的真空期,CDE不再受理其他公司的一致性评价申请。同时,食品药品监管总局为一致性评价设立绿色通道,加快审评审批,并对通过一致性评价的仿制药物在临床应用、招标采购、医保报销等方面都给予支持,完善整个仿制药的生态圈建设。
伴随着2015年之后国务院和国家食品药品监督管理局在仿制药相关政策的颁布,通过一致性评价在市场销售方面的优势也越发凸显。
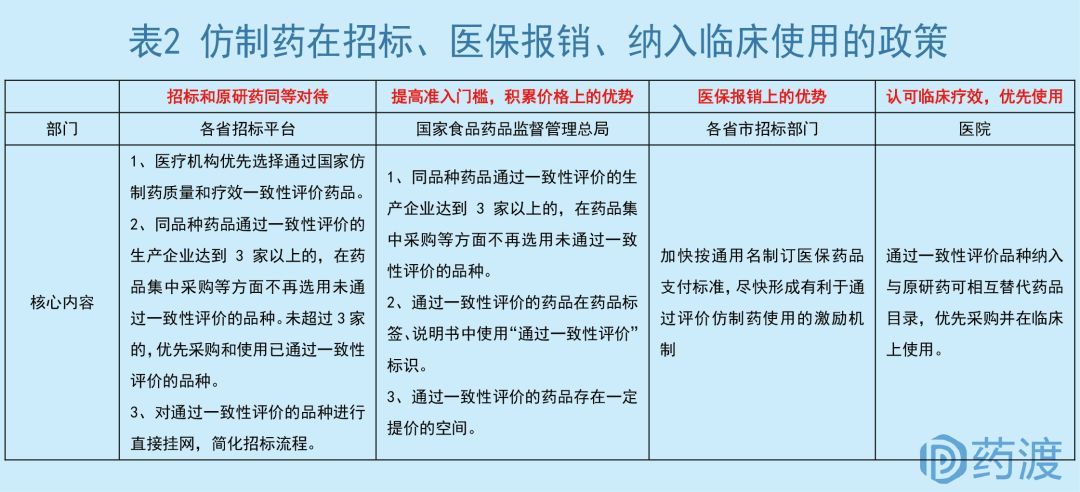
17年2月公布的《国务院办公厅关于进一步改革完善药品生产流通使用政策的若干意见》明确提出,同品种药品通过一致性评价的生产企业达到 3 家以上的,在药品集中采购等方面不再选用未通过一致性评价的品种。未超过3家的,优先采购和使用已通过一致性评价的品种。未能通过一致性评价的产品将逐渐退出公立医疗机构市场的争夺,通过一致性评价的药物市场空间潜力更大。
同时,CFDA鼓励医院招标优先选择通过国家仿制药质量和疗效一致性评价药品,对已通过一致性评价的本土药企大开绿灯。
某些省市,对通过一致性评价的品种进行直接挂网,无需等待新一轮的招标周期,简化招标采购门槛,将议价权交给医院和企业。
从最新招标规则来看,通过一致性评价的仿制药将持续向原研药发起冲击。从广东、江苏、青海、广西、河南等多地在新一轮招标政策中,将通过评价的仿制品种与原研品种“同等对待”,慢慢打破了以往原研药单独分组、定价体系不合理的局面。
在以往的药品招标中,除了妇儿科用药、急抢救用药、基础输液、低价药、谈判药品和精麻药品以外,其它药品招标仍然以“双信封”制度为主,采取的是低价者中标的规则,原研药和仿制药分组进行。对于一些竞争较为激烈的品种而言,常常出现国内有疗效较好的仿制药不得降价换量,导致本土仿制药核心竞争力不足和专利到期原研药长期占据大量医疗资源的窘境。
而仿制药在通过一致性评价之后,这种状况有所改观,通过一致性评价的仿制药甚至能够和原研药处于同一水平线。在药品招标中,通过一致性评价的品种能够避开未通过一致性评价的普通品种,改变了原研药单独分组的局面,使仿制药能以较为理想的价格中标。如上海市要求通过一致性评价品种议价结果一般不得高于原研药或参比制剂价格的70%,国产仿制与原研药的价格往往相差甚远,这使得通过一致性评价的药品存在一定提价空间。















