BioArt按
:
血管新生在哺乳动物器官发育、组织修复和再生过程中发挥关键作用,而且与多个高发疾病如心梗、休克、肿瘤以及视网膜病变的发生和发展关系密切。血管新生主要受到血管内皮的VEGF 的调控,然而,人们对VEGF影响基因表达的转录和表观遗传机制知之甚少。
8月29日,上海交通大学系统生物医学研究院
张冰
研究员课题组在
Nature Communications
杂志上在线发表了题为“VEGF amplifies transcription through ETS1 acetylation to enable angiogenesis”的研究论文,
揭示了VEGF通过内皮细胞关键转录因子ETS1乙酰化调控RNAPII的停滞-释放促进血管新生这一新机制。
阐明上述机制为细胞外环境因素可以直接影响和控制RNAPII这个核心转录分子机器提供新的证据。

论文解读:
血管新生(Angiogenesis)是从已有血管网形成新生血管的过程【1】。由已过世的哈佛大学教授Judah Folkman于1971年在研究肿瘤血管过程中提出的【2】。经过近几十年的研究发现血管新生在哺乳动物器官发育、组织修复和再生过程中发挥关键作用,而且与多个高发疾病如心梗、休克、肿瘤以及视网膜病变的发生和发展关系密切。抗过度血管新生已成为治疗癌症和退行性视网膜病变的主要策略。与之相反,如何在组织修复和再生过程中促进血管新生,提高再生组织的存活率,也成为组织再生研究的主要目标【3,4】。
血管新生主要受到血管内皮的VEGF (vascular endothelial growth factor)的调控。抗VEGF的药物如著名的贝伐单抗(Avastin)成为治疗癌症和视网膜黄斑病变的主要药物【5,6】。VEGF通过细胞膜表面受体VEGFR2 (VEGF receptor 2)调控细胞质内MEK-ERK和AKT信号通路,影响内皮细胞(endothelial cell,EC)的基因转录并导致血管生成。然而,人们对VEGF影响基因表达的转录和表观遗传机制知之甚少。
张冰
课题组致力于研究血管新生的核内调控机制,并与美国哈佛大学医学院
William T. Pu
课题组合作于2016年在
Genome Biology
发表文章报道了VEGF可以通过促进RNAPII的停滞释放(RNAPII Pausing Release)调节下游基因的转录【7】。但具体是什么机制将VEGF的细胞外信号传递到染色体上继而调节RNAPII的转录功能还不清楚。
该课题组通过对之前发现的血管内皮“动态H3K27ac位点”(Dynamic H3K27ac)的DNA基序(DNA motif)分析,发现
内皮关键转录因子ETS1在动态H3K27ac位点有明显的富集
【8】。 ETS1 是血管内皮中起主要转录作用的ETS转录因子家族成员之一, 能重新激活沉寂血管内皮细胞进入血管新生状态【9】。研究人员通过ETS1 ChiP-Seq结果发现,ETS1占据几乎内皮所有基因转录的激活区域包括增强子和启动子。RNA-seq数据显示ETS1更倾向于占据表达基因的启动子区域,而且其信号强度与RNAPII和基因表达水平在全基因范围内呈正相关。
过表达ETS1可以显著降低RNAPII停滞水平,促进RNAPII停滞释放。相反,敲低ETS1则促进RNAPII的停滞。
RNAPII停滞和释放是近年来才发现的调控RNAPII转录效率的重要节点,促进RNAPII停滞释放可以显著提高RNA的转录效率
【10】。ETS1的过表达在促进RNAPII停滞释放的同时,也可以升高整个细胞内mRNA水平。这与先前
Richard Young
和
David Lenvens
课题组在
Cell
杂志上报道的C-myc功能相似,作为一个泛型转录增强子 (Universal Transcriptional Amplifier) 全基因组范围内促进RNA的转录【11,12】。与之不同的是ETS1并不能促进mRNA以外的其他RNA包括rRNA的表达。
在这项研究中,研究人员发现
ETS1促进RNAPII停滞释放主要是通过与RNAPII转录停滞释放促进因子BRD4结合,并招募其到表达基因的启动子区域实现的
。VEGF对ETS1-BRD4结合具有调节作用。VEGF可以通过ERK磷酸化ETS1,招募乙酰化转移酶CBP乙酰化ETS1,进而增强ETS1和BRD4结合,促进RNAPII的转录活性。这个信号传递通路对于早期基因的激活具有重要的作用。研究人员同时还发现VEGF的另一种作用方式来促进RNAPII的停滞释放,即在刺激的晚期增强ETS1与染色体DNA的结合,而这种增多的染色体ETS1则对VEGF下游晚期基因的开放发挥着重要作用。
阐明上述机制为细胞外环境因素可以直接影响和控制RNAPII这个核心转录分子机器提供新的证据。
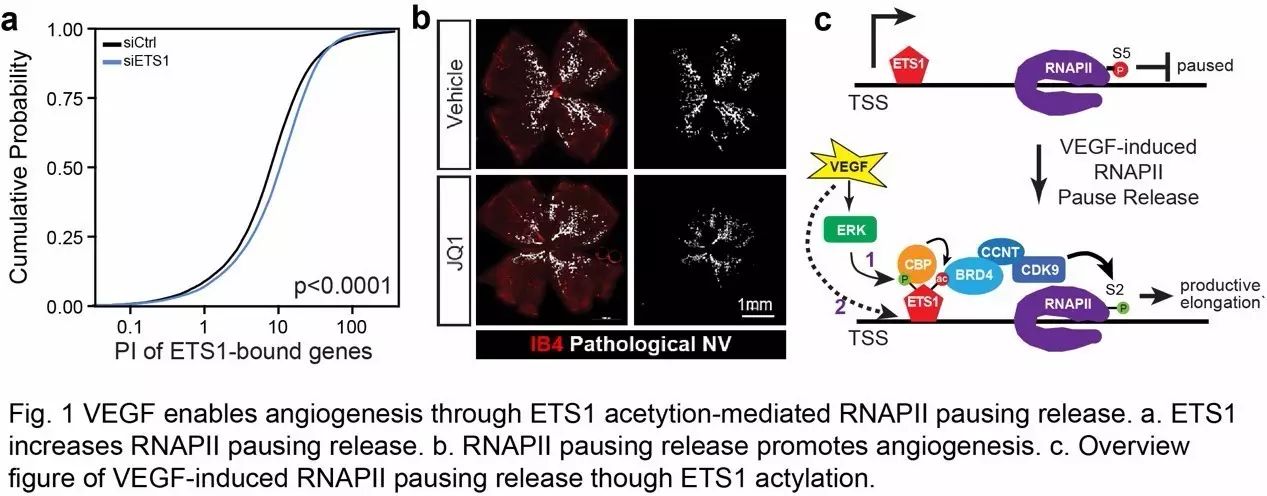
该项研究还进一步阐明VEGF促进的RNAPII转录停滞释放对于血管内皮的增殖、迁移以及缺氧诱导的视网膜血管过度增生都有重要的调节作用,阻断ETS1-BRD4相互作用以及RNAPII停滞释放显著降低了血管新生的能力。
这也是第一次系统阐述了RNAPII 停滞释放在血管新生过程中的作用,从而为血管新生机制研究以及临床治疗开辟新的研究方向。
据悉,该论文以上海交通大学系统生物医学研究院的硕士研究生
陈嘉焕
、助理研究员
傅怡
和哈佛医学院的
Daniel S. Day
为共同第一作者,哈佛医学院的
William T. Pu
和
张冰
研究员为共同通讯作者,上海交通大学系统生物医学研究院为第一作者单位。该项目得到国家自然科学基金、“青年千人”计划和美国心脏病协会 Scientist Development Grant的经费支持。
参考文献
1.
Carmeliet, P. Angiogenesis in life, disease and medicine.
Nature
438, 932-936 (2005).
2.
Folkman, J. Tumor angiogenesis: therapeutic implications.
N Engl J Med
285, 1182-1186 (1971).
3.
Carmeliet, P. Angiogenesis in health and disease.
Nat Med
9, 653-660 (2003).
4.
Carmeliet, P. & Jain, R. K. Angiogenesis in cancer and other diseases.
Nature
407, 249-257 (2000).
5.
Carmeliet, P. VEGF as a key mediator of angiogenesis in cancer.
Oncology
69 Suppl 3, 4-10 (2005).
6.
Nagy, J. A., Dvorak, A. M. & Dvorak, H. F. VEGF-A and the induction of pathological angiogenesis.
Annu Rev Pathol
2, 251-275 (2007).
7.
Day, D. S. et al. Comprehensive analysis of promoter-proximal RNA polymerase II pausing across mammalian cell types.
Genome Biol
17, 120 (2016).
8.
Zhang, B. et al. A dynamic H3K27ac signature identifies VEGFA-stimulated endothelial enhancers and requires EP300 activity.
Genome Res
23, 917-927 (2013).
9.
Dittmer, J. The biology of the Ets1 proto-oncogene.
Mol Cancer
2, 29 (2003).
10.
Adelman, K. & Lis, J. T. Promoter-proximal pausing of RNA polymerase II: emerging roles in metazoans.
Nat Rev Genet
13, 720-731 (2012).
11.
Nie, Z. et al. c-Myc is a universal amplifier of expressed genes in lymphocytes and embryonic stem cells.
Cell
151, 68-79 (2012).
12.
Lin, C. Y. et al. Transcriptional amplification in tumor cells with elevated c-Myc.
Cell
151, 56-67 (2012).

张冰
,上海交通大学系统生物医学研究院研究员,博导。心血管发育及疾病分子机制实验室主任。入选2016年中组部“青年千人”。2006年毕业于山东大学医学院生化与分子生物学系,2006-2009年美国佐治亚大学生化与分子生物学系博士后, 2010年美国哈佛大学附属波士顿儿童医院研究助理, 2011-2015年美国哈佛大学医学院讲师,波士顿儿童医院助理研究员,2015年任上海交通大学系统生物学院研究员。在
Genome Research,JCI,Circulation Research,Genome Biology,PNAS,Blood,Cell Research,Genome Biology
等期刊发表论文20多篇。主持包括美国Scientist Development Grant,国家自然基金重大研发计划和面上项目等多项课题。现任北美血管生物学,美国心脏病协会,中国细胞生物学会会员。


BioArt,一心
关注生命科学,只为
分享更多有种、有趣、有料的信息。
关注请长按上方二维码。投稿、合作、转载授权事宜请联系微信ID:
fullbellies
或邮箱:
[email protected]
。





