对正常人来说,白细胞负责制造抗体对抗病原体或外来入侵者。胰腺中的胰岛β细胞负责生成胰岛素。有一种名叫B细胞或B淋巴细胞的白细胞,能激活自身反应性T细胞(T淋巴细胞),而T淋巴细胞会破坏胰腺β细胞,导致T1D。
受损的β细胞无法完成将葡萄糖运送至细胞的任务,使葡萄糖积聚在血液之中,如果不及时注射胰岛素,便会损伤神经、血管和体内器官。
因此,糖尿病研究界的其中一个共识是,
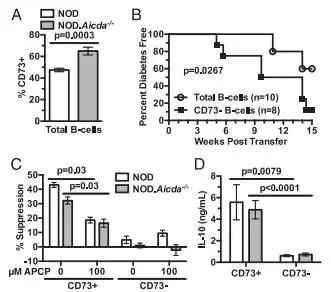
如果可以阻止起抗原呈递作用的B细胞,便有可能有效地阻止T1D的发生。但是长久以来,人们都无法阻止因B淋巴细胞导致的T1D的β细胞的不断死亡。
“我们的方法是针对白细胞内合适数量的B细胞,让它们抗胰岛β细胞的自身免疫的级联作用失活,随后阻断糖尿病的发病可能。”这项发表在《Journal of
Immunology》的卓越成果的通讯作者David Serreze教授说道。
研究人员使用了基因操纵手段来筛选潜在的能阻止B细胞启动糖尿病诱导程序的代谢靶标。他们证明对非肥胖型糖尿病(non-obese
diabetic,NOD)老鼠使用特定的通路(AID/RAD51)抑制后,大大降低了糖尿病的发展。
在抗体的生产过程中,B细胞开启了活化诱导胞嘧啶核苷脱氨酶(activation-induced cytidine
deaminase,AID),它像剪刀一样负责剪断B细胞的染色体。
由于AID基因是诱导重组/体细胞突变的类别开关,研究人员使用CRISPR/Cas9介导的基因消融手段,去除了NOD小鼠模型的AID基因后,发现T1D的发展受到了有效抑制。
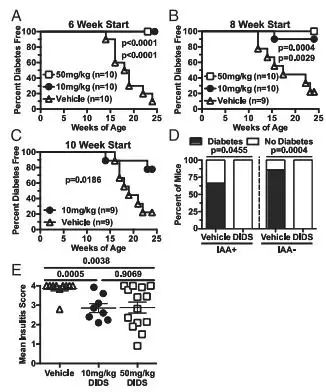
AID蛋白能诱导基因组DNA发生断裂,如果RAD51介导的同源重组不及时修复,便会导致B淋巴细胞的死亡。因此,研究人员使用RAD51抑制剂,4,4'-二异硫氰基-2,2'-二磺酸(4,4′-diisothiocyanatostilbene-2,
2′-disulfonic
acid)处理模型动物,发现同样也能显著抑制NOD小鼠的T1D发展。相同的效果,使原本需要通过基因编辑手段才能起效的方法,转化成可用于临床治疗的小分子靶向药物疗法。
Serreze 说:“为了对抗T1D,我们借鉴了肿瘤治疗学家Kevin
Mills(文章合作者,“Cyteir治疗”的创始人之一)已经研究的比较透彻的整条通路,来阻断自身反应性免疫细胞。但是,事情都有两面性,如果你想保持机体的抗肿瘤免疫反应,可能会希望保留这条通路的活跃。”
这条重要的通路将适用于所有与B细胞有关的自身免疫性疾病的治疗。
原文标题
Genetic and Small Molecule Disruption of the AID/RAD51 Axis Similarly Protects Nonobese Diabetic Mice from Type 1 Diabetes through Expansion of Regulatory B Lymphocytes






