文章探讨了睡眠驱动因素的特征以及睡眠减轻细胞稳态压力的机制。研究发现DNA损伤是睡眠的稳态驱动因素,神经元中的DNA损伤会引发睡眠并促进修复活动。Parp1通路可以感知细胞压力并促进睡眠和修复活动。研究还指出,不同物种的睡眠需求因物种而异,睡眠的时间、持续时间和质量受生物钟和体内平衡睡眠压力的影响。
研究发现神经元中的DNA损伤会引发睡眠并促进修复活动,尤其是在斑马鱼、小鼠和人类中的研究证实了这一点。
虽然所有研究过的具有神经网络的动物都需要睡眠,但每天的睡眠量因物种而异,例如猫头鹰猴睡17小时,而野生大象只睡2小时。
体内平衡因素被认为会随着睡眠前觉醒的持续时间和强度的增加而积累,影响睡眠的需求。
睡眠驱动因素的特征以及睡眠减轻细胞稳态压力的机制尚不清楚。在果蝇、斑马鱼、小鼠和人类中,清醒时 DNA 损伤水平增加,睡眠时减少。
近期,以色列巴伊兰大学Lior Appelbaum团队在
Molecular Cell
在线发表题为“
Parp1 promotes sleep, which enhances DNA repair in neurons
”的研究论文,该研究表明 6 小时的综合睡眠足以减少斑马鱼背侧皮层中的 DNA 损伤。
神经元活动和诱变剂诱导 DNA 损伤引发睡眠和 DNA 修复。
DNA 损伤反应 (DDR) 蛋白 Rad52 和 Ku80 的活性在睡眠期间增加,染色体动力学增强了 Rad52 活性。DDR 引发剂聚(ADP-核糖)聚合酶 1 (Parp1) 的活性在睡眠剥夺后增加。在幼虫斑马鱼和成年小鼠中,
Parp1 促进睡眠
。Parp1 活性的抑制减少了依赖睡眠的染色体动态和修复。
这些结果表明 DNA 损伤是睡眠的稳态驱动因素,而 Parp1 通路可以感知这种细胞压力并促进睡眠和修复活动。

睡眠伴随着对外部刺激的反应减弱,是一种脆弱的行为状态。
然而,睡眠在整个系统发育过程中都是进化保守的,所有研究过的具有神经网络的动物,包括水母、蠕虫、软体动物、果蝇、鱼类、爬行动物、鸟类、啮齿动物和人类,都需要睡眠。睡眠障碍会导致神经损伤,并与神经发育和神经退行性疾病和衰老有关。虽然睡眠对所有动物来说都是必不可少的,但每天的睡眠量因物种而异。成年人每天大约睡 7-8 小时,猫头鹰猴睡17 小时,而野生大象只睡 2 小时。
这些不同的睡眠需求提出了基本问题:什么决定了特定物种的充足睡眠,以及恢复性神经过程是什么?
睡眠的时间、持续时间和质量由生物钟和体内平衡睡眠压力之间的相互作用调节,后者在长时间清醒时增加。体内平衡因素被认为会随着睡眠前觉醒的持续时间和强度的增加而积累。
然而,驱动睡眠需求的细胞稳态机制以及稳态因素的特性尚不清楚。
广泛的研究提出了各种可能性,包括有毒代谢物的积累,细胞对能量、供应和大分子的需求增加,突触数量和强度的增加以及升高的神经损伤和细胞应激。
增强的觉醒和神经元活动会在小鼠和果蝇中诱导 DNA 双链断裂 (DSB)。
神经元中 DNA 损伤的修复比分裂细胞中的要慢,这表明损伤可以在清醒期间积累。事实上,DSB 在斑马鱼幼虫清醒时会在它们的神经元中积累。相比之下,睡眠会增加染色体动态,从而降低神经元 DNA 损伤的水平。同样,睡眠剥夺 (SD) 会增加 DNA 损伤并降低人类血细胞中 DNA 修复基因的表达。这些研究表明,睡眠促进核维持,即睡眠调节 DNA 损伤和修复之间的平衡。
然而,目前尚不清楚在睡眠期间 DNA 损伤的形成是否受到抑制,或者修复系统的活动是否受到更多刺激。
阐明与睡眠、DNA 损伤和修复相关的潜在机制具有挑战性。
在秀丽隐杆线虫中,CEP-1 促进了压力诱导的睡眠,CEP-1 是 DNA 损伤反应 (DDR) 通路的成员。
DDR 包括四个主要途径:同源重组 (HR)、非同源末端连接 (NHEJ)、碱基切除修复 (BER) 和核苷酸切除修复 (NER)。每个都涉及不同的修复蛋白组合,这些蛋白依次被募集到受损部位。
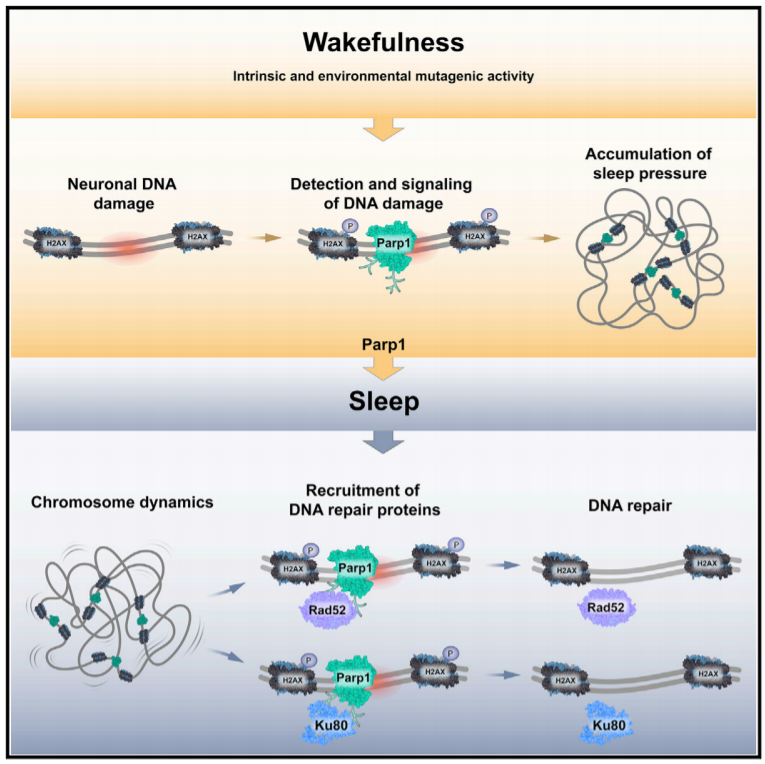
文章模式图(图源自
Molecular Cell
)
DDR 中的第一个事件是所有途径共有的,是聚(ADP-核糖)聚合酶-1(PARP-1)募集到损伤部位。
PARP-1 是 DNA 损伤的检测器,可促进下游 DDR 蛋白的积累。这些核蛋白可用作标记,以识别特定基因组位点中的修复并区分不同途径。例如,RAD52 和 RAD51 在 DSB 切除过程中是活跃的,这是 HR 中的关键步骤,但在 NHEJ 修复过程中则不然。KU70/KU80 异源二聚体结合 DNA 末端,然后在 NHEJ 途径中招募和激活其他因子。相比之下,APEX1 蛋白启动 BER 过程,而 DDB2 蛋白参与 NER 过程,这是暴露于紫外线(UV)辐射后激活的主要 DNA 修复机制。
阐明睡眠是否以及如何调节单个神经元中的 DDR 通路,可以提供有关其有益细胞功能的信息,并解释恢复性睡眠持续时间变化的原因。
该研究利用透明斑马鱼来识别细胞睡眠驱动因素,并了解睡眠在恢复活脊椎动物单个神经元核稳态中的作用。
斑马鱼是一种成熟的睡眠模型,其大脑的结构和功能,以及DNA 损伤和修复系统在哺乳动物中是保守的。
最近,全脑活动记录揭示了斑马鱼幼虫背侧大脑皮层 (DP) 的两个主要睡眠特征。这些状态,称为慢爆睡眠 (SBS) 和传播波睡眠 (PWS),分别与哺乳动物慢波睡眠 (SWS) 和快速眼动/矛盾睡眠 (REM/PS) 非常相似。
在睡眠、神经元活动和 DNA 损伤和修复的操纵下,行为监测和 DNA 修复蛋白动态聚类的实时成像相结合,该研究
揭示了神经元中的 DNA 损伤是睡眠的稳态驱动因素。此外,Parp1 可以诱导睡眠,从而促进染色体动力学以及 DDR 蛋白的募集和活动。
参考消息:
https://www.cell.com/molecular-cell/fulltext/S1097-2765(21)00933-3

—
END
—
内容为
【iNature】
公众号原创,
转载请写明来源于
【iNature】
微信加群
iNature汇集了4万名生命科学的研究人员及医生。我们组建了80个综合群(16个PI群及64个博士群),同时更具专业专门组建了相关专业群(植物,免疫,细胞,微生物,基因编辑,神经,化学,物理,心血管,肿瘤等群)。
温馨提示:进群请备注一下(格式如学校+专业+姓名,如果是PI/教授,请
注明是
PI/教授



















