为了确定
ELS
如何影响
PFC
的功能
,
本项研究
采用了
早期母
系
分离应激范式
(
early maternal separation stress paradigm
)
。
其做法是
在幼崽出生后的第
8
天
(P8)
,让
其
经历一次
24
小时的母亲
-
幼崽分离
,从而破坏了
幼鼠
早期的
社交联系。
有文献报道,
应
激可以
诱导
成年小鼠
PFC
中
的
树突棘缺失
,因此,作者研究了
ELS
是否在母系分离后不久
即可
导致
PFC
中第
2/3
层锥体神经元兴奋性突触的结构改变
。另外,
ELS
幼鼠背侧
PFC
中
第
2/3
层锥体神经元上的树突棘密度显著增加
,但
不影响
树突棘
的大小和形态
。
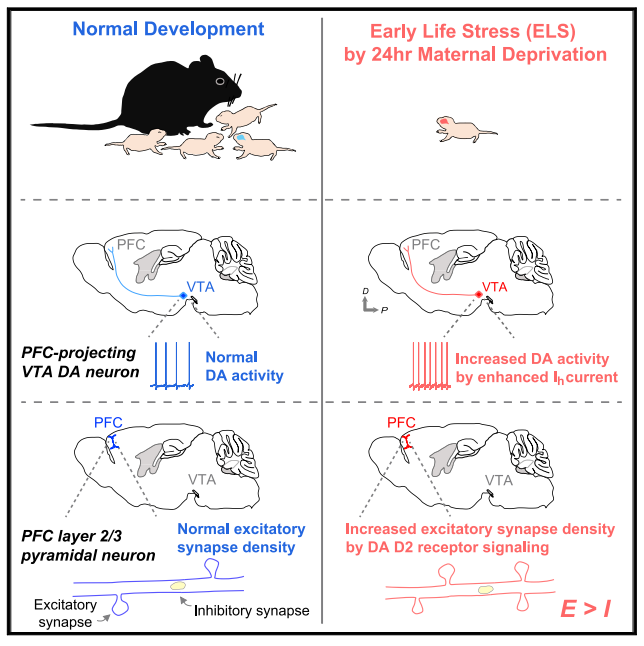
为了评估树突棘密度的改变是否反映了功能的改变,研究人员对P9-P10 ELS和对照幼鼠进行全细胞膜片钳实验。与结构变化一致,ELS暴露显著增加了微小兴奋性突触后电流
(mEPSCs)
的频率,但幅值没有改变,而ELS的微小抑制性突触后电流
(mIPSC)
频率和幅值均未发生改变。
这些结果表明,
ELS选择性地增加了PFC第2/3层锥体神经元的兴奋性突触密度
,且这一过程发生在出生后的早期发育中,提示
ELS暴露后前额叶突触兴奋抑制比增加
。
 单次ELS暴露增加了突触的兴奋抑制比
单次ELS暴露增加了突触的兴奋抑制比
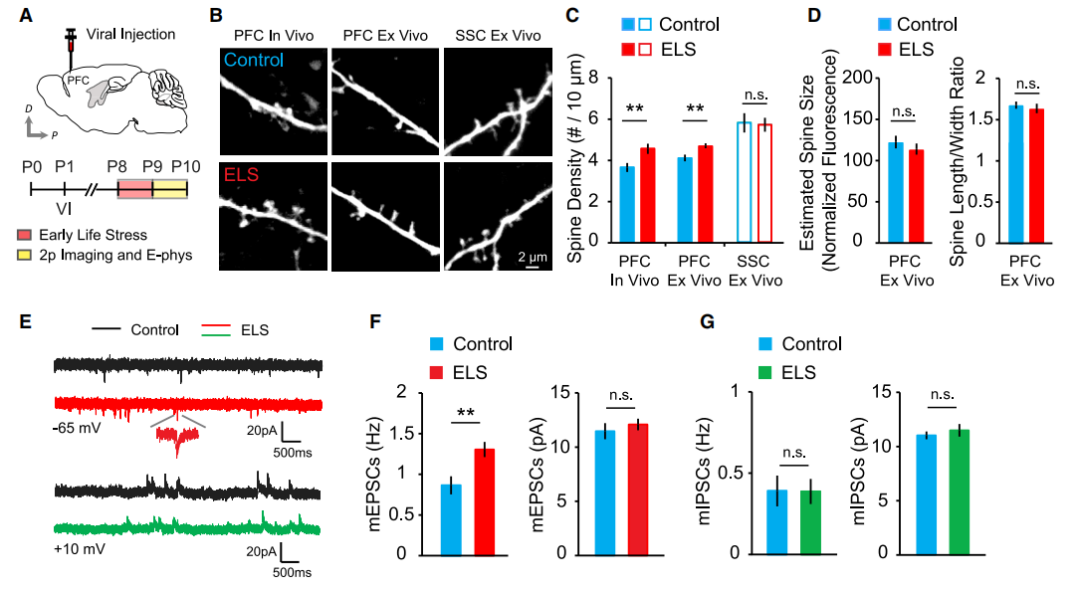
因为ELS诱导的突触变化在PFC中很明显,因此作者想知道PFC投射至VTA的DA神经元是否以及如何受到ELS的影响。因此,作者在P1小鼠的背侧PFC脑区注射了逆向标记的微球,特异性标记由PFC投射向VTA的神经元,进而通过膜片钳记录观察到ELS小鼠DA神经元表现出超兴奋性,但静息膜电位和尖峰阈值不受影响。
然而,作者发现
PFC投射到VTA的神经元表现出阳离子通道介导的电流(I
h
)上调
,这是VTA神经元的兴奋性驱动力。
这些发现表明,
ELS使得中额叶VTA中DA神经元的兴奋性I
h
电流增强,从而导致了这些细胞超兴奋性
。
 ELS
小鼠中额叶
VTA
的
DA
神经元表现出
固有
兴奋性增加
ELS
小鼠中额叶
VTA
的
DA
神经元表现出
固有
兴奋性增加
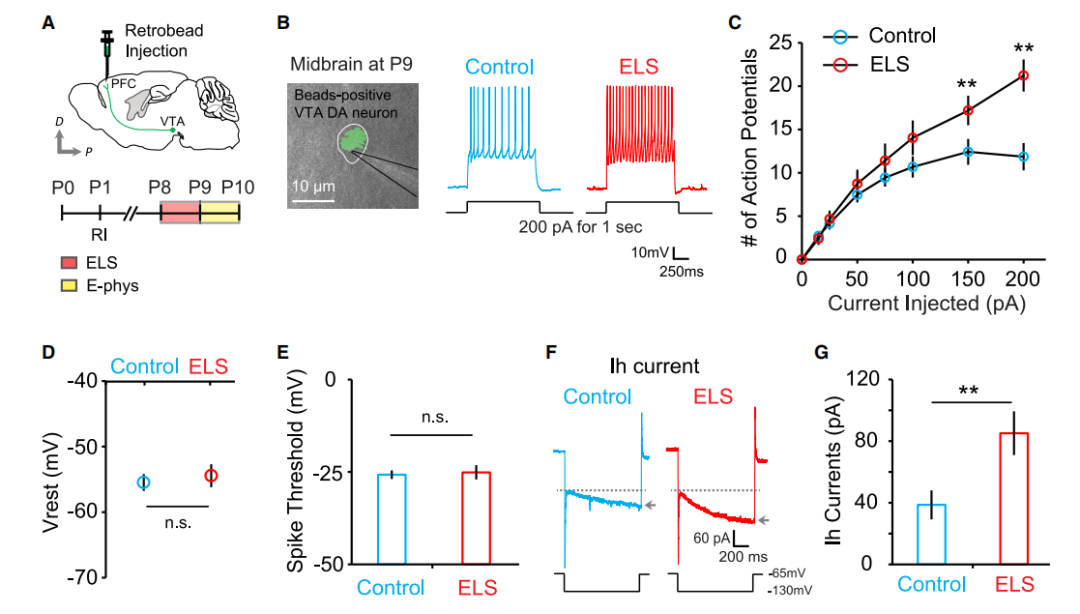
目前,单次暴露的早期生活应激是否会
长期
影响
PFC的突触变化和PFC投射的DA神经调节回路的活动,依然尚不清楚。结果发现,在P8的
单次ELS会导致PFC 2/3层锥体神经元兴奋性突触密度的长期增加
,而不是抑制性突触密度的长期增加,以及在P17-P21时通过双光子检测到,
VTA中DA神经元内在兴奋性的持续增加
。
此外,还观察到中额叶DA神经元的过度兴奋是由I
h
电流增强引起的,而静息膜电位和峰值阈值电位没有变化。这些结果表明,
急性ELS导致了VTA中DA神经元兴奋性的长期增强,潜在地增加了PFC中多巴胺的释放,并在PFC观察到兴奋性突触的显著增加
。
 ELS
诱导的
PFC
兴奋性突触密度增强和
PFC
投射
到
VTA
的
DA
神经元的活性增加是
持续性的
ELS
诱导的
PFC
兴奋性突触密度增强和
PFC
投射
到
VTA
的
DA
神经元的活性增加是
持续性的
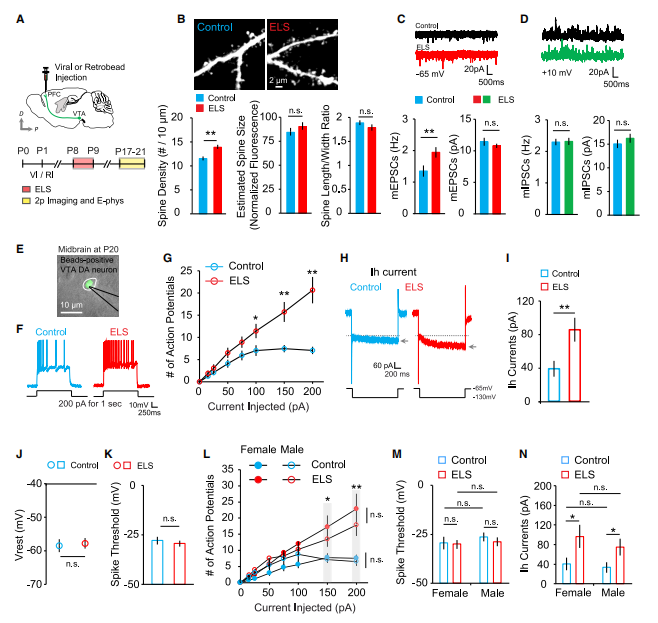
作者推测,PFC中的DA信号可能与ELS诱导的突触改变有关。为了检验这一假说,作者在P1幼崽局部注射神经毒素6-羟多巴胺
(6-OHDA)
来消除PFC中的DA能神经元。
研究发现,向小鼠PFC注射6-OHDA后树突棘密度明显下降,且mEPSC频率的显著降低。然而,在注射6-OHDA的ELS小鼠中没有观察到脊椎密度或mEPSC频率的进一步增强。这说明
内源性DA对出生后早期PFC的发育至关重要
。
因此,作者进一步研究了不同的DA受体信号如何选择性地促进了ELS诱导的PFC突触的异常发育。在ELS期间,作者将D1受体拮抗剂或D2受体拮抗剂直接微注射到PFC中,并在P9 P10时测量了药物注射ELS小鼠的mEPSCs。
其中,对D2受体的阻断完全消除了ELS介导的mEPSC频率的增强,而不影响mEPSC的幅值。综上说明,
通过增强中额叶DA神经元的活性,上调DA D2受体信号,促进了ELS后PFC中2/3层锥体神经元兴奋性突触的增加。