图片来源:nautil.us
作者 卡尔 · 齐默(Carl Zimmer)
翻译 许黎珊
审校 魏潇
当今社会,生物技术在经济领域中几乎无处不在,因此,我们很难确切地知道生物技术在整体经济中究竟占有多大的分量。现在的转基因生物,比如细菌和植物,已经能够生产药物、食品、燃料甚至服装面料。罗伯特 · 卡尔森(Robert Carlson)是生物科技公司 Biodesic 的负责人和投资公司生物经济资金(Bioeconomy Capital)的创始人。他最近仔细的算了笔帐,结果得出了一项惊人的结论——在 2012 年(这是他能获取到有效数据的最近的年份),美国单单在生物科技领域获得的财务收入就超过 3,240 亿美元。
卡尔森说:“生物技术对经济的贡献比我们常常谈论的矿产业和制造业还要多,我认为这出乎所有人的预料。”
生物技术的发展速度让人感到震惊的原因并不在于该产业的规模,而在于它还过于年轻。2 个世纪之前的第一次工业革命带来了生产业首次巨大的变革,与之相比,生物技术产业诞生至今只有 40 年。它的出现要归功于约翰斯 · 霍普金斯大学的微生物学家哈密尔顿 · 史密斯(Hamilton Smith)和他的同事,他们在 20 世纪 60 年代发现了可以切割 DNA 的限制性内切酶(Restriction enzymes)。史密斯向全世界展示了限制性内切酶的作用,于是,其他科学家就开始把这种酶当作“剪刀”,用于基因编辑。
卡尔森说:“一旦你可以开始用这些工具改变世界,新世界的大门也随之打开。”
限制性内切酶的应用是一个教科书级别的经典实例,它表明了基础研究最终如何对社会产生巨大的经济效益。史密斯在最开始研究限制性内切酶的时候,并没有心怀这么宏大的理想,他仅仅是想做些科学研究。这位现在已经 85 岁高龄的老人曾经说过:“科学研究实在太有趣了,对我来说,学无止境。”

哈密尔顿 · 史密斯(Hamilton Smith) 图片来源:wikipedia
在 1968 年,史密斯还只是约翰斯 · 霍普金斯大学里一名初出茅庐的讲师。当时,他对基因重组很感兴趣——基因重组指的是细胞能将 DNA 切割成片段,然后再将这些片段重新组合成新的 DNA 序列的过程。史密斯说:“当时,谁都知道基因重组,这太常见了,每个生物体都有一套基因重组的体系,但是,没有人知道基因重组的运作细节。”
因此,他选择了一种名为流感嗜血杆菌(Haemophilus influenza)的细菌,研究它如何进行基因重组。流感嗜血杆菌和其他细菌一样,可以直接摄取来自外界或者供体微生物的游离 DNA 片段,并以某种方式把这些 DNA 片段整合到自己的基因组中。
哈密尔顿 · 史密斯研究的是一种名为流感嗜血杆菌(如图所示)的细菌如何进行基因重组的过程。这种细菌可以摄取外源的游离DNA片段,并把它整合到自己的基因组中。
细菌通过这种转化方式获得呈现新遗传性状的基因,这赋予了细菌新的特性,比如对抗生素的耐药性。但是,流感嗜血杆菌的基因重组是一把“双刃剑”。入侵的病毒(比如噬菌体)能够“劫持”细菌内部的基因重组“装置”,把自己的 DNA 注入宿主内部,利用宿主的蛋白质编译系统来构建自己所需的蛋白质外壳,从而能够进行不断的自我复制。
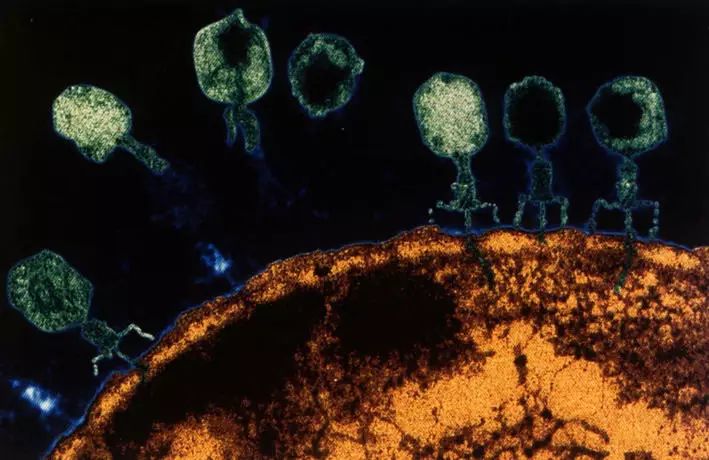
噬菌体正在感染细菌 图片来源:fglm.ch
为了弄清楚基因重组的过程,史密斯用放射性同位素标记法标记病毒——首先用磷的放射性同位素标记细菌的 DNA,然后再用病毒侵蚀细菌。这些病毒在细菌内部增殖,于是它们的基因也同样标记有放射性同位素。然后史密斯和他的同事用这些标记有放射性同位素的病毒感染另一批细菌。在感染时,由于病毒会将自己的遗传物质插入细菌的 DNA,所以他们预计这一批细菌的 DNA 同样会携带放射性同位素。
至少,这是他们预期会观察到的现象。然而,史密斯带领的研究生肯特 · 威尔科特斯(Kent Wilcox) 用放射性同位素标记的病毒感染细菌后,却没有在细菌的 DNA 中检测到放射性。
在威尔科特斯做实验的几年前,日内瓦大学的微生物学家沃纳 · 阿尔伯(Werner Arber)曾提出过一种假设:有一种酶可以通过切断病毒的 DNA,限制病毒增殖,并将这种酶命名为“限制性内切酶”。也正是基于阿尔伯的假设,威尔科特斯想出了一个合理的理由来解释实验为何失败,并告诉了史密斯——流感嗜血杆菌能摧毁病毒的 DNA。
阿尔伯认为如果限制性内切酶失控,这种酶就会不断切割细菌本身的 DNA,最终杀死细菌。他推测,流感嗜血杆菌可以通过用碳原子和氢原子来修饰 DNA ——这个过程称为 DNA 甲基化(DNA methylation),从而避免基因惨遭自己内部的限制性内切酶的“毒手”。他提到,限制性内切酶不能切割已经甲基化的 DNA,但它可以袭击来自病毒的未被甲基化的 DNA。
在威尔科克斯开展这个另人沮丧的实验的前一周,史密斯曾向他的实验室推荐了一篇证明阿尔伯假设成立的论文。论文作者是哈佛大学的学者马修 · 梅斯森(Matthew Meselson)和罗伯特 · 元(Robert Yuan),他们发现大肠杆菌中有一种能够切除外源 DNA 的蛋白质,换句话说,这种蛋白质就是限制性内切酶。威尔科特斯记住了这篇文章,他告诉史密斯他们可能是碰巧发现了另一种存在于流感嗜血杆菌中的限制性内切酶。
为了测试了这个想法,史密斯做了个巧妙的实验。他将病毒的 DNA 和流感嗜血杆菌的 DNA 分别置于两个试管中,然后往每一个试管里都加入细菌内部的蛋白质混合物。如果细菌确实产生了限制性内切酶,混合物中的酶就会把病毒的 DNA 切成碎片。
测序仪是几十年前被发明出的一种用来分析 DNA 序列的强大工具,直到今天仍在使用。不过,史密斯采用了一种更为简便的方法来辨别试管中 DNA 片段的长短:含有长链 DNA 的溶液比含有短链 DNA 的溶液更粘稠,所以史密斯用粘度计测量了两个试管中溶液的粘稠程度。结果正如他预料的那样,含有病毒 DNA 的溶液粘稠度很快就降低了,这就可以推断出病毒 DNA 被某些物质——很可能是流感嗜血杆菌内部的某些蛋白质——切成了小段。
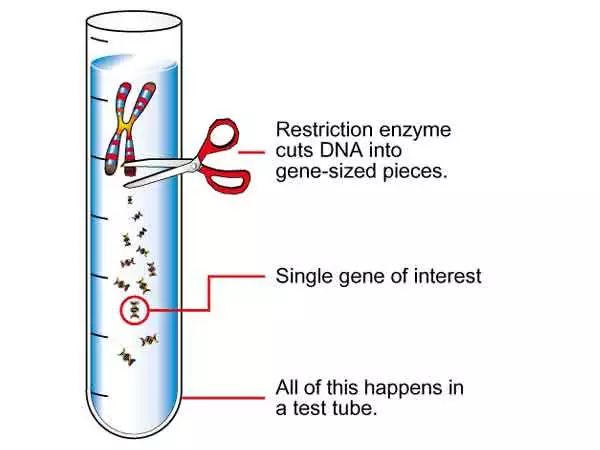
限制性内切酶切割遗传物质 图片来源:passel.unl.edu
“我立刻就知道这一定是限制性内切酶。”史密斯说道, “那真是个绝妙的时刻——只要五分钟,你就知道新发现诞生了。”
随后,史密斯和他的同事不断地重复着从细菌提取物中分离蛋白质的工作,在经历了几个月的枯燥乏味后,喜悦和满足终于降临:他们最终找到了限制性内切酶,还发现甲基化酶能够通过用碳原子和氢原子来保护细菌本身的 DNA,以免被限制性内切酶“大卸八块”。
史密斯和他的同事发表了他们如何发现限制性酶的研究细节,随后其他科学家也开始了相关研究。不过他们不仅研究了限制性内切酶的特性,还把这种酶当作“工具”。1972 年,斯坦福大学的生物学家保罗 · 伯格(Paul Berg)利用限制酶切割 SV40 病毒的 DNA,然后用另一种酶将其他病毒的 DNA“粘到”切割后的 DNA 片段末端,创造出了由两个物种的遗传物质组成的 DNA 片段。
许多科学家紧随着伯格的脚步,意识到他们可以用限制性内切酶将其他不同物种的基因插入到细菌的 DNA 中。这样一来,细菌就可以表达属于其他物种的蛋白质,变成活生生的“生物工厂”。
1978 年,史密斯接到了一个从斯德哥尔摩打来的电话,他被告知自己与沃纳 · 阿尔伯、约翰 · 霍普金斯大学的丹尼尔 · 纳思斯(Daniel Nathans)共同获得了当年的诺贝尔医学奖。丹尼尔 · 纳思斯是在史密斯后,进一步开展实验,研究限制性内切酶的微生物学家。史密斯承认,听到这个喜讯时,他高兴得有点发懵。
史密斯说:“消息来得太突然,我毫无防备。我一直认为摘得诺贝尔奖桂冠的人是那些能取得惊天动地的成就的天才,我觉得自己跟他们根本就不是一伙人。”

史密斯(左)接过诺贝尔奖章的一刻 图片来源:gettyimages.ie
但是,他的发现确实对生物技术产业产生了至关重要的影响。各种各样的生物制药公司不断涌现,致力于使用限制性内切酶改造 DNA。成立于 1976 年的基因泰克(Genentech)是第一个吃螃蟹的公司,它将这一技术用于商业——该公司的科学家使用限制性内切酶来构造携带人胰岛素基因的大肠杆菌菌株。在此之前,糖尿病患者只能购买从牛和猪的胰脏中提取的胰岛素——价格昂贵,制作困难。而基因泰克生产的胰岛素来自于巨大的金属发酵罐所培育的细菌,这大大降低了胰岛素制作成本。

基因泰克的生物发酵罐 图片来源:The New York Times
多年来,史密斯最初的成功为许多后来的科学家提供了基因编辑的工具,使他们受益匪浅。即使到今天,限制性内切酶仍是研究人员常用的切割转录基因的工具。卡尔森认为:“限制性内切酶仍然十分重要,如果你想把某一个具有特定序列的 DNA 与另一段 DNA 连到一起,那么你最常用的工具就是它。
随着史密斯见证了限制酶的用处变得越来越多,功能越来越强大,他终于逐渐挺直了腰板儿,克服了自己的“诺贝尔奖冒名顶替综合征”。
“看来我拿这个奖还是 OK 的,” 他终于对这一事实放宽了心。
原文链接:http://nautil.us/issue/44/luck/the-man-who-kicked-off-the-biotech-revolution
阅读更多
内容合作请联系
[email protected]
















