欧洲分子生物学实验室(EMBL)、巴黎高等物理化学学院(ESPCI)和国际艾滋病疫苗计划的科学家们发明了一种新的技术,可快速排查HIV表面蛋白,这项被发表在Cell子刊《Cell Chemical Biology》的报道将推进艾滋病疫苗的开发速度。
HIV患者群体中大约存在着1%的精英控制者(elite
controllers),这些超强患者无需接受抗病毒治疗也能存活。因为他们的免疫系统特异性地生产出了HIV抗体,抗体能识别病毒表面特征,并与之结合使病毒失去活性。HIV疫苗的目的便是代替免疫系统识别病毒表面特异蛋白,模仿精英控制者们的免疫反应。
目前广泛用于细胞表面蛋白研究的技术被称为荧光激活细胞分选术(luorescence-activated cell
sorting,FACS),有时也能用于病毒表面蛋白研究。
选取一个感兴趣的表面蛋白,然后用荧光抗体与细胞杂交,如果该细胞拥有这种蛋白就会报告荧光,反之不发荧光。然后根据荧光信号逐个地将携带某表面蛋白和不携带这种表面蛋白的细胞分选到不同的培养皿中以备进一步研究。
对细胞表面蛋白研究来说,FACS很好用。因为一只细胞外面可能包裹着上百个蛋白,所以荧光信号较强。对某些较大的病毒来说(比如埃博拉病毒),FACS也好用。但是,对有着较少表面蛋白的类似HIV的小型病毒,FACS的灵敏度就有些不够用了。
如今,欧洲分子生物学实验室(EMBL)、巴黎高等物理化学学院(ESPCI)和国际艾滋病疫苗计划的科学家们发明了一种新的技术,可快速排查HIV表面蛋白,这项被发表在Cell子刊《Cell
Chemical Biology》的报道将推进艾滋病疫苗的开发速度。
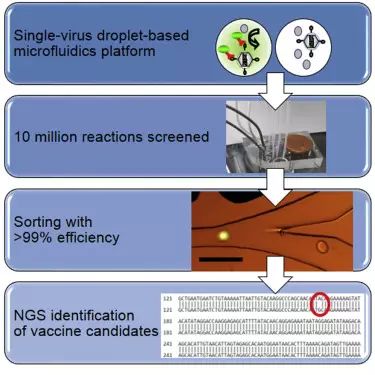
根据表面蛋白与特异性抗体的结合情况,该系统每秒可检测数百个病毒。与传统的FACS不同,该技术使用的病毒蛋白结合抗体是偶联了碱性磷酸酶(AP)的非荧光型抗体,当用化学药物处理病毒-抗体混合物后,与抗体结合的病毒便会发出强烈的荧光。因此,可提供更高精度的表面蛋白排查。
另外,这是一个微流体系统,包括一个手掌大小的由微观网渠组成的微流体芯片,少量的液体从芯片的沟渠中流过,每个渠道仅几十个微米宽,每次检测仅需30/1000000微升的样品液滴。整个系统完全密封,保障了使用过程的安全。





