——某些突变负荷高的非小细胞肺腺癌患者,使用免疫药物无效,原来是它在捣鬼!
肿瘤免疫治疗近年来发展迅猛、热点频出,给肿瘤的治疗带来了很多新的希望,免疫治疗受到大家高度关注的同时,针对免疫治疗效果的预测指标也在不断更新。
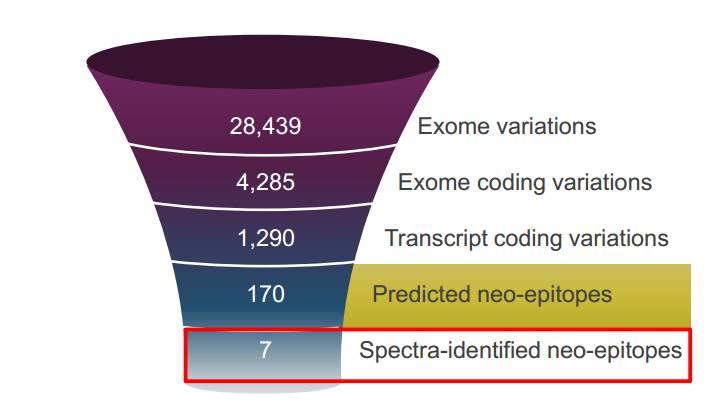
肿瘤突变负荷(TMB)是最近研究非常多的预测biomarker,TMB一般以非同义突变(导致氨基酸改变的核苷酸变异)总数量或每1Mb(1兆碱基)的突变数量来表示。然而,其中只有10%左右的非同义突变可以产生与MHC(主要组织相容性复合物)高亲和力结合的突变肽段。而能够与MHC高亲和力结合的肽段又能够被肿瘤患者体内的T细胞识别的更加少。这
提示除了肿瘤突变数量多,能产生被免疫系统识别的新抗原可能更加是关键。
近日,Science一篇文章调查了1500多名接受了免疫检查点抑制剂治疗的晚期癌症患者的基因型,
揭示了肿瘤突变的“质量”——HLA基因型
,
对免疫治疗疗效的预测也非常重要。文章标题为“Patient HLA class I genotype influences cancer response to checkpoint blockade immunotherapy”。近日,Science一篇文章调查了1500多名接受了免疫检查点抑制剂治疗的晚期癌症患者的基因型,
揭示了肿瘤突变的“质量”——HLA基因型
,
对免疫治疗疗效的预测也非常重要。文章标题为“Patient HLA class I genotype influences cancer response to checkpoint blockade immunotherapy”。
来自MSKCC 的Timothy Chan教授团队的研究结果表明,HLA的LOH(杂合子突变)是肿瘤免疫逃逸的主要机制之一,可能原因是HLA的多样性减少,导致部分新抗原不能呈递到细胞表面,引起毒性T细胞反应,从而形成原发性耐药或免疫药物无响应的情况。这项研究表明,HLA的表型对免疫药物疗效影响甚大,总的来说,HLA的多样性越多,能呈递新抗原的种类就越多,免疫药物的疗效就越好。
在这项研究中,研究者调查了两组癌症治疗队列,每组都接受了免疫检查点抑制剂治疗。其中一组覆盖369人,入组患者为接受抗CTLA-4或抗PD-1治疗的晚期黑色素瘤或晚期非小细胞肺癌患者;另一组为1166人的不分癌种队列,也包括了黑色素瘤和非小细胞肺癌,治疗方案为接受抗CTLA-4、抗PD-1/PD-L1治疗,或是ICIs + ICIs的联合治疗。患者的HLA I基因型通过DNA测序方法或者蛋白质检测方法鉴定。
主要研究结果见下图:
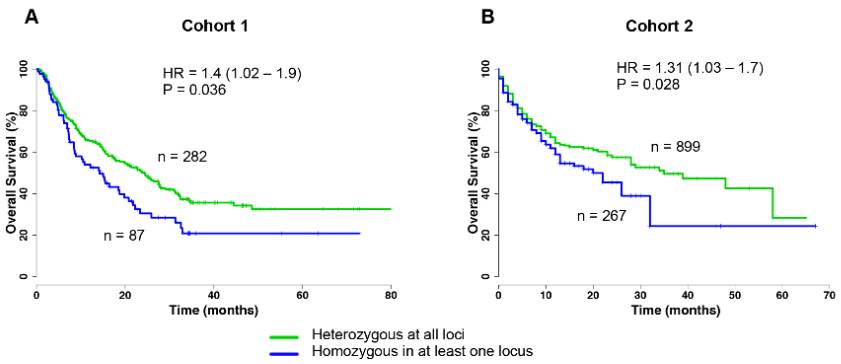
图1 队列1和队列2中HLA不同多样性导致总体生存率差异
绿色曲线代表HLA基因座全部为杂合子的患者生存率,蓝色曲线代表HLA基因座至少有一个是纯合子的患者生存率。从两组临床试验结果表明,HLA基因座全部为杂合子的患者生存率更高,P值均小于0.05。说明HLA多样性越高,患者生存率越高。
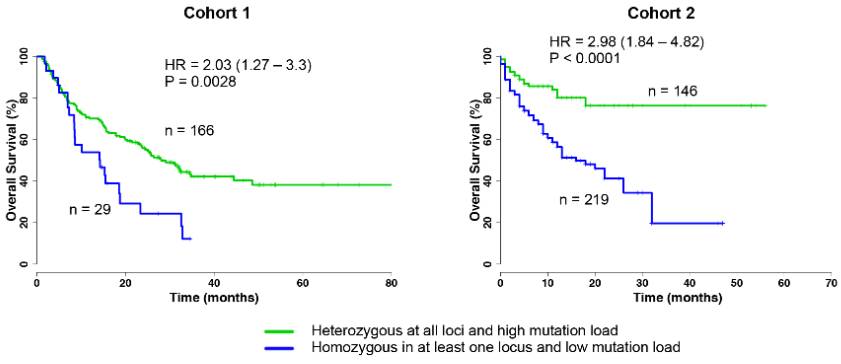
图2 队列1和队列2中不同HLA多样性+TMB指标表现出来的总体生存率差异
绿色曲线代表HLA基因座全部为杂合子且突变负荷高的患者生存率,蓝色曲线代表HLA基因座至少有一个是纯合子且突变负荷低的患者生存率。从两组临床试验结果表明,HLA基因座全部为杂合子且突变负荷高的患者生存率更高,P值均小于0.005,差异非常显著。说明HLA多样性越高,肿瘤突变负荷越高,患者生存率越高。
与图1临床结果对比,可以发现多项指标综合评估患者药物获益概率更精准。
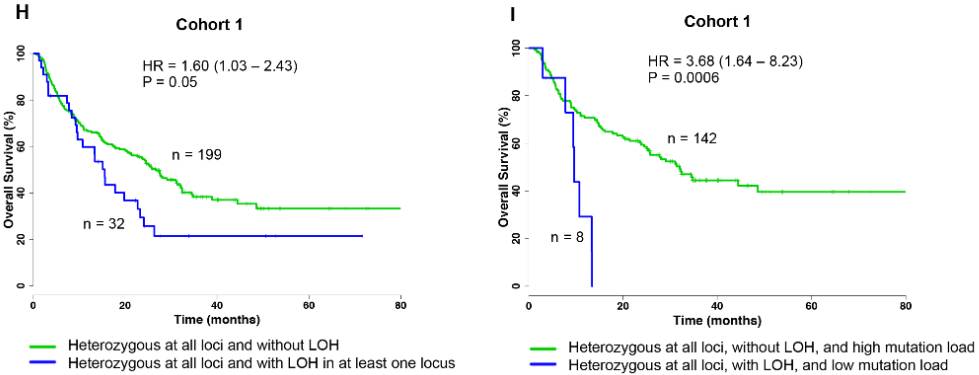
图3 左:队列1中全杂合子+LOH(-)对比全杂合子+ 至少一个位点LOH(+)表现出来的总体生存率差异;右:全杂合子+LOH(-)+TMB-H对比全杂合子+至少一个位点LOH(+)+TMB-L表现出来的总体生存率差异
左图,绿色曲线代表
HLA基因座全部为杂合子且无杂合子缺失
的患者生存率,蓝色曲线代表
HLA基因座全部为杂合子且至少有一个基因座杂合子缺失
的患者生存率。临床试验结果表明,HLA基因座全部为杂合子且无基因座杂合子缺失的患者生存率更高。说明HLA基因座杂合子缺失降低了患者生存率,削弱了免疫药物的疗效。
右图,绿色曲线代表
HLA基因座全部为杂合子、无杂合子缺失及突变负荷高
的患者生存率,蓝色曲线代表
HLA基因座全部为杂合子、至少有一个基因座杂合子缺失及突变负荷低
的患者生存率。临床试验结果表明,HLA基因座全部为杂合子、无基因座杂合子缺失及突变负荷高的患者生存率更高。说明HLA基因座杂合子缺失及肿瘤突变负荷低均不利于免疫药物起效。与
左图相比,右图临床结果更显著,提示多项指标综合评估患者药物获益概率更精准。
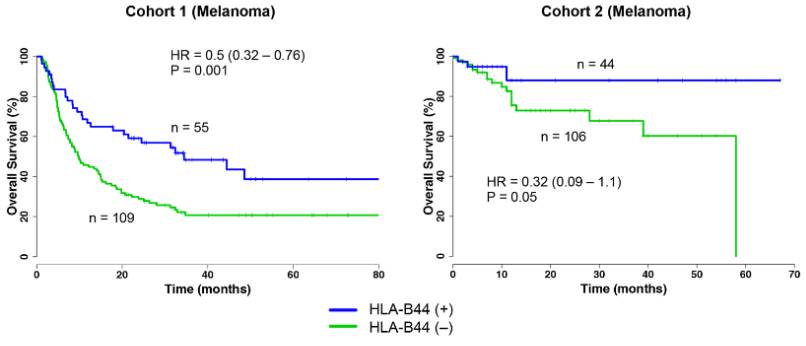
图4 队列1和队列2中HLA-B44阳性及阴性患者总体生存率对比
HLA-B44是一种HLA的超亚型,能够交叉呈递其他亚型HLA呈递的新抗原,故变相增加了HLA的多样性。如上图所示,两组临床试验结果表明,HLA-B44阳性的患者生存率均优于HLA-B44阴性的患者。说明HLA-B44阳性促进了免疫药物的疗效。
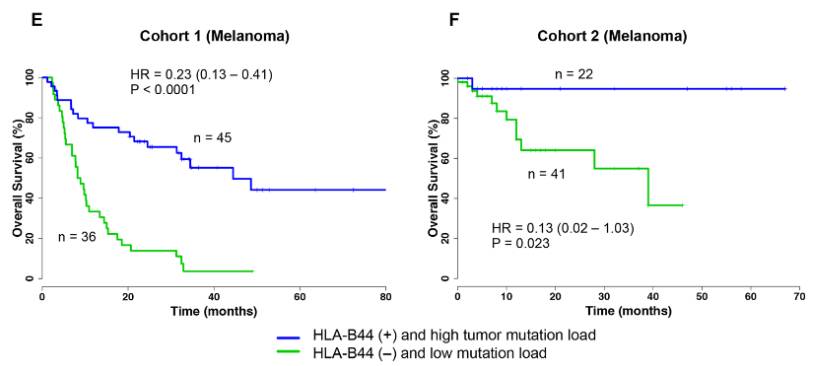
图5 HLA-B44(+) +TMB-H 对比HLA-B44(-) +TMB-L表现出来的总体生存率差异
如上图所示,HLA-B44阳性患者且突变水平高的患者生存率明显优于HLA-B44阴性且突变水平低的患者。推测HLA-B44能呈递更多种类的新抗原,进而有促进免疫药物的疗效。对比图4临床试验结果,
提示多项指标综合评估患者药物获益概率更精准。
研究者表示,这些研究对预测免疫检查点抑制剂药物的用药用药响应和设计基因新生抗原(neoantigen)的个性化肿瘤疫苗具有重要意义,同时还建议未来在设计免疫治疗临床试验时应该将HLA-I基因分型也考虑进去。



















