
研报点评
投资市场热点更迭,每个热点都存在投资逻辑,作为投资者很难辨别真伪。【独角兽研究】会不定期对热点行业进行独家点评,通过产业链深入研究将这些热点行业存在的风险及真正的成长性挖掘给广大读者。
一、体外诊断行业简介
体外诊断(in vitro Diagnosis,IVD),是指在人体之外,通过对人体的样品(血液、体液、组织等)进行检测而获取临床诊断信息的产品和服务。体外诊断产品主要由诊断设备和诊断试剂构成。根据我国国家食品药品监督管理总局(CFDA)的《医疗器械分类规则》标准,诊断设备属于临床检验仪器设备类。诊断试剂是指按医疗器械管理的体外诊断试剂,包括在疾病的预测、预防、诊断、治疗监测、预后观察和健康状态评价的过程中,用于人体样本体外检测的试剂、试剂盒、校准品、质控品等产品。诊断试剂可以单独使用,也可以与仪器、器具、设备或者系统组合使用。
体外诊断产品广泛应用于临床的各个阶段,贯穿于初步诊断、治疗方案选择、有效性评价、确诊治愈等疾病治疗全过程。目前,临床诊断信息的80%左右来自体外诊断,被称为“医生的眼睛”。
体外诊断试剂的分类方法比较多,根据检测原理或者检测方法,体外诊断试剂可以分为生化诊断、免疫诊断、分子诊断、床边诊断、血液检测、细胞检测、微生物检测、尿液检测、凝血类诊断、流式细胞诊断等多种类型。目前,生化、免疫和分子诊断试剂为我国诊断试剂主要的三大类品种。
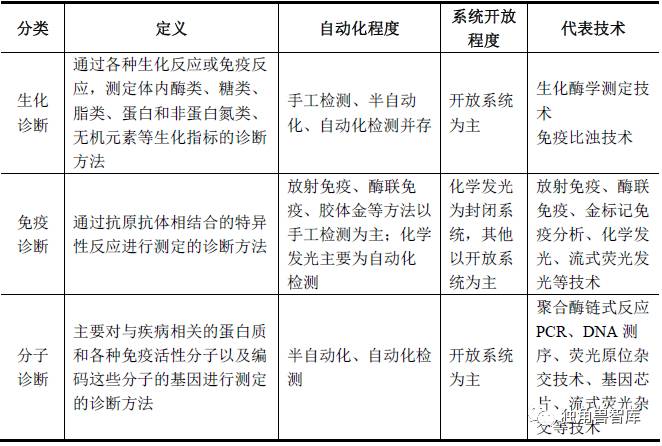
二、行业监管机制
1、行业主管部门
国家食品药品监督管理总局(CFDA)是我国体外诊断行业的行政主管部门。CFDA 下设药品注册司、药品安全监管司和医疗器械注册司、医疗器械监管司及其直属机构,他们的基本职能包括体外诊断行业的监管、国家和行业标准的发布与实施、产品市场准入、生产企业资格、产品广告宣传、产品临床试验及产品注册审批等。
中国食品药品检定研究院(国家食品药品监督管理局医疗器械标准管理中心)是国家食品药品监督管理总局的直属事业单位,是国家检验药品生物制品质量的法定机构和最高技术仲裁机构。其下辖的医疗器械检定所医疗器械检定所主要承担医疗器械注册检验、监督检验、委托检验和进口检验工作;承担全国医疗器械检验检测复验和技术检定的相关组织工作;承担相关医疗器械标准制修订及其实验室验证等工作;承担医疗器械标准物质研究和标定工作;开展与医疗器械检验检测方法、质量标准、技术规范等相关新方法、新技术研究等。
2、行业监管体制
除国家法定用于血源筛查的体外诊断试剂、采用放射性核素标记的体外诊断试剂按照药品管理之外,其他体外诊断产品按医疗器械管理。我国对医疗器械监督管理采取分类管理方式,对不同类别的医疗器械生产经营企业采用不同的许可(备案)管理,对不同类别的产品采用不同的产品注册(备案)制度。
(1)医疗器械分类管理制度和产品注册(备案)制度
根据《医疗器械监督管理条例》(国务院令第650 号),国家对医疗器械按照风险程度实行分类管理;根据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5 号),根据产品风险程度由低到高,体外诊断试剂分为第一类、第二类、第三类产品。经审查符合规定批准注册的产品,由食品药品监督管理部门核发《医疗器械注册证》,体外诊断试剂的《医疗器械注册证》有效期为5 年,有效期届满前6 个月内,申请重新注册。
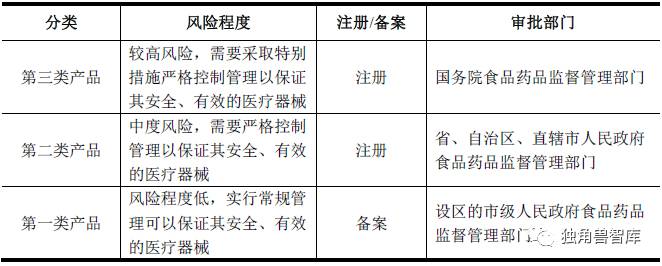
(2)医疗器械生产许可(备案)制度
根据《医疗器械监督管理条例》,从事医疗器械生产活动,需具备与规范生产相适应的场地、环境、生产设备、专业技术人员、质量检验和管理、售后服务等条件。
根据企业所生产的医疗器械类别不同,国家食品药品监督管理总局对医疗器械生产企业执行许可(备案)制度。食品药品监督管理部门对符合规定条件的生产企业,准予许可并发给医疗器械生产许可证。医疗器械生产许可证有效期为5年,有效期届满需要延续的,依照有关行政许可的法律规定办理延续手续。
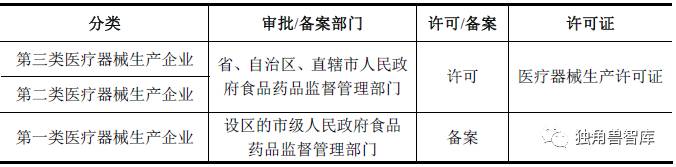
(3)医疗器械经营许可(备案)制度
根据《医疗器械监督管理条例》,应当有与经营规模和经营范围相适应的经营场所和贮存条件,以及与经营的医疗器械相适应的质量管理制度和质量管理机构或者人员。医疗器械经营企业、使用单位购进医疗器械,应当查验供货者的资质和医疗器械的合格证明文件;不得经营、使用未依法注册、无合格证明文件以及过期、失效、淘汰的医疗器械。
根据企业所经营的医疗器械类别不同,国家食品药品监督管理总局对医疗器械经营企业执行许可(备案)制度。食品药品监督管理部门对符合规定条件的经营企业,准予许可并发给医疗器械经营许可证。医疗器械经营许可证有效期为5年,有效期届满需要延续的,依照有关行政许可的法律规定办理延续手续。
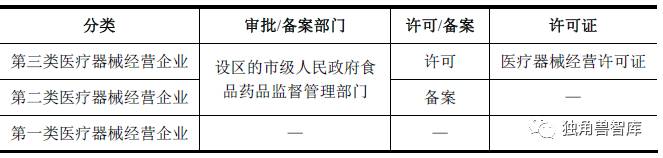
三、全球体外诊断行业概况
商业化的临床诊断试剂是伴随着医学检验学的发展而产生,同时临床诊断试剂的产业化发展又极大地推动新的科学技术在医学检验学、基础医学和药物学等学科的发展应用。在过去的二三十年里,体外诊断产业从实验生物学时期过渡到分子生物学时期,体外诊断技术在微生物学、免疫学、细胞学、分子生物学、遗传学、生物化学等领域取得了长足的进步,使得体外诊断不仅灵敏度、特异性有了极大的提高,而且应用范围迅速扩大,操作门槛逐步降低。
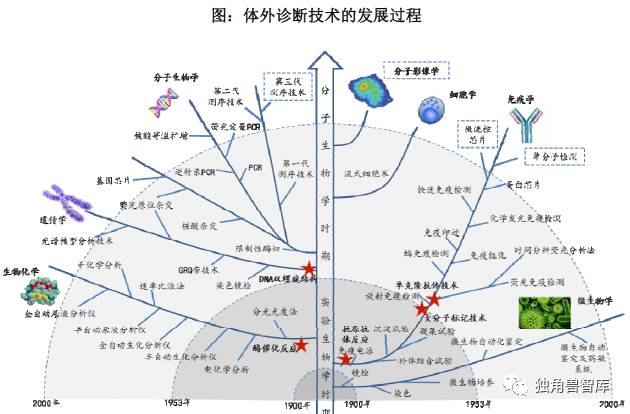
资料来源:《中国体外诊断技术的发展与创新》
随着人口老龄化、保险覆盖率及支出不断增加、收入增长等因素的驱动,体外诊断试剂产业已成为当今世界上最活跃、发展最快的行业之一,在疾病预防、诊断和愈后的判断、治疗药物的筛选检测、健康状况的评价以及遗传性预测等领域正发挥着愈来愈大的作用。根据美国联合市场研究(Allied Market Research)机构发布的报告显示,2013 年全球IVD 市场规模为533.20 亿美元;预计到2020年,全球IVD 市场将达746.50亿美元,年复合增长率为5.34%。
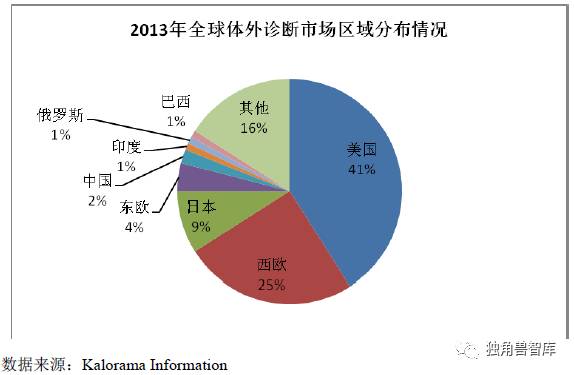
从地区分布看,发达国家收入及保障水平高于发展中国家,是全球主要的体外诊断市场,其中美国、西欧和日本为全球前三大体外诊断市场,市场份额分别为41%、25%、9%。但发达国家市场相对成熟,发展较为平稳,预计未来增速在2%-3%;而中国、印度等发展中国家,人均体外诊断支出水平仍较低,随着经济生活水平提高,体外诊断处于较快发展,预计市场需求增速约为10%,是全球体外诊断发展主要推动力。
四、中国体外诊断行业概况
1、总体市场概况
中国体外诊断行业起步于上世纪80 年代,从早期的无序竞争到近几年国家对行业的整顿,目前市场趋于稳定,行业集中度逐渐提高,需求持续增长,行业进入了高速发展的时期。
中国医药工业信息中心发布的《中国健康产业蓝皮书》(2015 版)显示,2014年我国医疗器械市场总量达到2,760 亿元,根据市场规模占比来看,前三位的依次是医学影像学设备、体外诊断及检验产品(包括基因测序行业)、高值医学耗材及植入物,市场占比分别为19%、16%以及13%。IVD 行业已成为医疗器械市场的重要构成部分。
2014年,我国体外诊断产品市场规模达到306 亿元;预计2019 年市场规模将达到723 亿元,年均复合增长率高达18.7%。对一些常见慢性疾病(如糖尿病等)的诊断普及、疾病筛查的推广以及未来基因测序的应用则是中国体外诊断产品市场增长的主要动力。
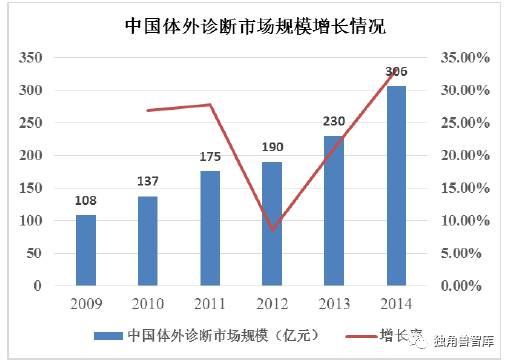
资料来源:Kalorama Information、McEvoy&Farmer、Huidian Research、《中国医药健康蓝皮书》(2015 版)
2、主要细分领域
在体外诊断产业发展的过程中,逐渐形成了较为全面的产业技术体系。根据诊断方式的原理和应用不同,体外诊断产品可分为临床生化、免疫化学、分子诊断、床边诊断、血液检测、细胞诊断、微生物检测、尿检等多种类型。其中,免疫化学产品占据了最大的市场,分子诊断和床边诊断产品的市场潜力巨大。2014年,临床生化、免疫化学、分子诊断、床边诊断、血液检测等产品各占据了19%、38%、15%、11%和4%的市场比例,具体如下图所示:

数据来源:中国医药工业信息中心《中国健康产业蓝皮书》(2015 版)
五、IVD细分领域之一:肿瘤标志物体外诊断市场概况
公司主导产品之一肿瘤标志物体外诊断产品采用先进的诊断技术,满足肿瘤标志物“高通量、多指标”联合检测的临床诊断需求,为癌症“早发现、早诊断、早治疗”提供了重要的技术手段。肿瘤标志物体外诊断市场是公司重要的应用领域之一,其市场发展对公司产品的销售具有较大的影响。
1、肿瘤标志物定义
肿瘤标志物(Tumor Marker,TM)是指可以预示肿瘤存在的一种化学、生物类物质,存在于人体血液、体液、细胞或组织中。它们或不存在于正常成人组织而仅见于胚胎组织,或在肿瘤组织中的含量大大超过在正常组织里的含量,它们的存在或量变可以提示肿瘤的性质,借以了解肿瘤的组织发生、细胞分化、细胞功能,以帮助肿瘤的诊断、分类、预后判断以及治疗指导。
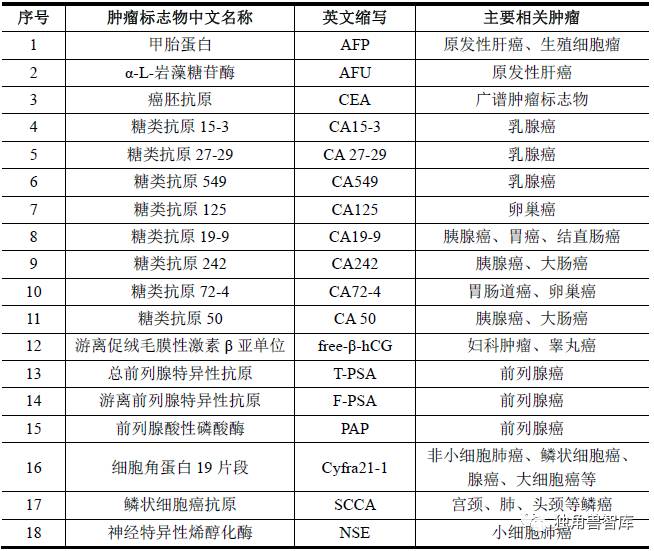
2、常见肿瘤标志物
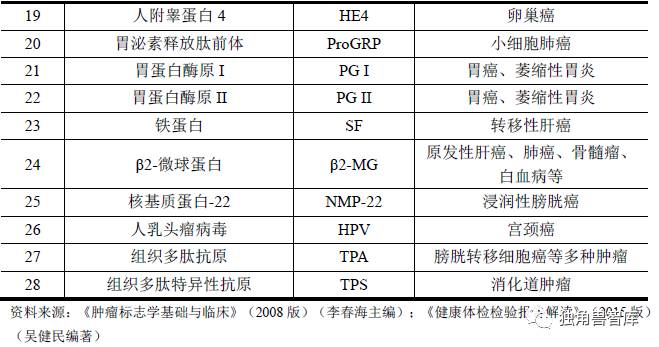
3、肿瘤标志物检测的必要性
近年来,全国癌症发病形势严峻,发病率与死亡率呈持续上升趋势。《2014中国肿瘤登记年报》显示,根据对全国肿瘤登记中心2010 年监测数据分析可得, 2010 年全国估计新发恶性肿瘤病例约309 万,死亡病例196 万。全国恶性肿瘤发病率为235.23/10 万(男性268.65/10 万,女性200.21/10 万),中国人口标化率(中标率)184.58/10 万。全国恶性肿瘤死亡率为148.81/10 万(男性186.37/10万,女性109.42/10 万),中标率113.92/10 万。其中,城市中标死亡率109.21/10万,农村中标死亡率119.00/10 万。按照平均寿命74 岁计算,人一生中患恶性肿瘤的几率是22%,肿瘤已经成为一种常见疾病。
肺癌、女性乳腺癌、胃癌、肝癌、食管癌、结直肠癌、宫颈癌是我国常见的恶性肿瘤。肺癌、肝癌、胃癌、食管癌、结直肠癌、女性乳腺癌、胰腺癌是主要的肿瘤死因。肺癌已经连续四年高居我国发病死亡率首位。
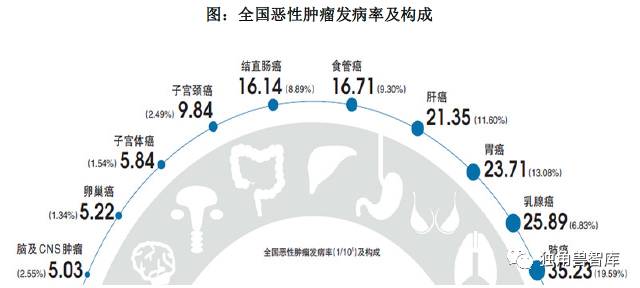
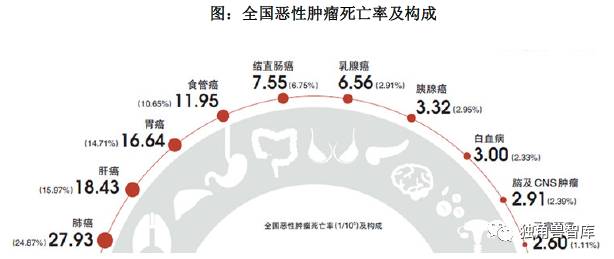
数据来源:《2014 中国肿瘤登记年报》
根据《2012 中国肿瘤登记年报》统计数据表明,我国近20 年来癌症呈现年轻化及发病率和死亡率“三线”走高的趋势,约每分钟就有6 人确诊为癌症。同时,癌症也呈现地域化特点,如胃癌集中在西北及沿海。从年龄段来看,在全国35 岁至39 岁年龄段,恶性肿瘤发病率为87.07/10 万,40 岁至44 岁年龄段几乎翻番,达到154.53/10 万。50 岁以上人群发病占全部发病的80%以上,60 岁以上癌症发病率超过1%,80 岁达到高峰。未来10 年,中国的癌症发病率与死亡率仍将继续攀升。预计到2020 年,中国每年的癌症死亡总数将达300 万左右,患病总数将达660 万,直接医疗费用就高达1 万亿元以上。因此,专家建议,40岁以上人群每年应进行一次体检。
由于人类目前对晚期肿瘤尚束手无策,及早发现与治疗仍然是目前治疗癌症最有效的手段,因此癌症的早期检测对于提高癌症患者生存率具有重大意义。传统的癌症诊断方法主要根据病史、症状、体征和各种辅助检查等宏观途径,而早期癌症患者一般无明显症状,难以检测。临床研究证实,肿瘤标志物的检测能比CT、核磁共振等物理检查手段更早地发现肿瘤,为临床治疗赢得宝贵时间。
目前在体外诊断的技术层面上,从酶联免疫测定、荧光免疫测定发展到发光免疫测定,已使肿瘤标志物的最低检出值灵敏度提高了近万倍。随着PCR 技术的进展,使得临床检测能从基因水平监测肿瘤标志物的变化。行业中部分技术领先企业,进一步运用分子生物学技术、自动化与信息技术、流式细胞技术及基因芯片等技术综合检测肿瘤标志物,使得肿瘤的体外诊断技术水平大幅度提升,并提高了其推广应用水平。
4、肿瘤标志物联合检测的意义
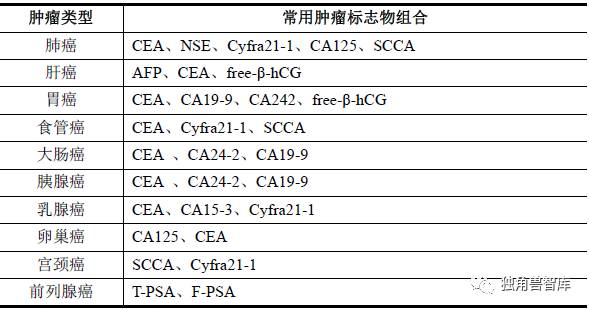
目前临床上检测的肿瘤标志物具有多源性,绝大多数不仅存在于恶性肿瘤中,也存在于良性肿瘤、胚胎组织、甚至正常组织中;同一种肿瘤或不同类型的肿瘤可有一种或几种肿瘤标志物异常,同一种肿瘤标志物可在不同的肿瘤中出现。因此,单一指标用于肿瘤的辅助诊断或高危人群筛查时,灵敏度及特异度均不够理想。中华医学会检验医学分会肿瘤标志专家委员会建议,为提高肿瘤标志物的辅助诊断价值和确定何种标志物可作为治疗后的随访监测指标,临床上可以合理选择几项灵敏度、特异性能互补的肿瘤标志物组成最佳组合,进行联合检测。
一般来说,肿瘤标志物的联合检测可提高对肿瘤诊断的准确率。
常用的几种肿瘤标志物组合如下:
六、IVD细分领域之二:宫颈癌体外诊断市场概况
公司主导产品之一人乳头瘤病毒(HPV)检测系列产品包括27 型HPV 分型、“2+12”型、“5+9”型等,可为不同客户提供HPV 核酸检测全面解决方案。其中“5+9”型HPV 分型检测试剂盒对引发中国90%宫颈癌的前五种感染型别HPV16/18/58/52/33 以及其他9 种型别进行分型检测,适用于中国妇女宫颈癌早期筛查。HPV 分型检测市场是公司重要的应用领域之一,其市场发展对公司产品的销售具有较大的影响。
1、关于人乳头瘤病毒HPV
人乳头瘤病毒(Humanpapillomavirus,简称HPV)是一种属于乳多空病毒科的乳头瘤空泡病毒A 属,是球形DNA 病毒,能引起人体皮肤黏膜的鳞状上皮增殖,表现为寻常疣、生殖器疣(尖锐湿疣)等症状。
HPV广泛存在于自然界,据统计70%~80%的女性在其一生中会有至少一次的HPV 感染。但大多数感染为自限性,超过90%的感染的女性会出现一种有效的免疫应答,在没有任何长期的健康干预时在6 到24 个月之间可以清除感染。根据HPV各型别致病力大小或致癌危险性大小不同可将HPV分为低危型和高危型两大类。高危型HPV 感染被视为几乎所有宫颈癌发生的必要条件,全球范围的研究结果显示,在99.7%的宫颈癌患者体内检测到高危型HPV DNA 的存在。低危型HPV 一般与尖锐湿疣或低度鳞状上皮内病变相关,极少引起宫颈癌。
2、宫颈癌早期筛查的重要性
宫颈癌又称子宫颈癌,是女性发病率第二高的癌症,仅次于乳腺癌。《2013年中国肿瘤登记年报》显示,根据对全国肿瘤登记中心2009 年监测数据分析可得,乳腺癌居女性恶性肿瘤第一位,每年新发病例约21 万;宫颈癌居第二位,每年新发病例约15 万,约有8 万妇女死于宫颈癌。参考中国医学科学院对2003-2007 年我国32 个肿瘤登记地区的宫颈癌统计数据,中国宫颈癌的发病率和死亡率处于相当高的水平,宫颈癌是肿瘤防治中需要重点关注的肿瘤。
研究统计表明,从HPV 感染到发展成为宫颈癌一般要经历数年到10 年左右的时间,提早检测高危型HPV 进而积极治疗将有助于清除女性生殖道的持续感染,防止其向宫颈癌演变,同时还可以早期发现宫颈癌,从而降低宫颈癌的发生率和死亡率。
根据世界卫生组织于2006 年出版的《子宫颈癌综合防治基本实践指南》建议,30 岁以上妇女和25 岁至30 岁的属于高危人群的妇女开展宫颈癌筛查,且25 至49 岁年龄段建议每3 年检测一次,50 岁以上年龄段每5 年检测一次。中国癌症研究基金会出版的《中国癌症筛查及早诊早治指南》中建议:在经济发达地区,筛查起始时间为25至30 岁,经济欠发达地区为35 至40 岁,高危人群应适当提前,终止时间为65岁。
我国第六次人口普查结果显示,15 岁以上的女性人数约为4.6 亿。由于我国至今没有全国范围内的宫颈癌筛查计划,加之城乡医疗卫生资源的差距,使得我国特别是贫困地区宫颈癌的发病率和死亡率相对较高,给患者及社会带来巨大的经济负担。宫颈癌筛查的人均检测费用大约为300 元,而宫颈癌的治疗费用却可高达10 万元。因此,针对符合条件的妇女定期进行宫颈癌筛查,可以最大限度的预防和提早发现癌前病变,降低宫颈癌的发病率,减少病人身体上的痛苦和家庭经济上的压力,提高妇女的生活质量并达到普及宫颈疾病相关知识的目的,具有极大的经济和社会效益。
3、中国宫颈癌筛查现状
由于子宫颈癌和乳腺癌是两大严重危害女性生命的健康杀手,我国政府高度重视两癌的预防筛查工作。从2009 年开始,国家对妇女“两癌”筛查出台了若干政策,部分重要政策如下表所示:
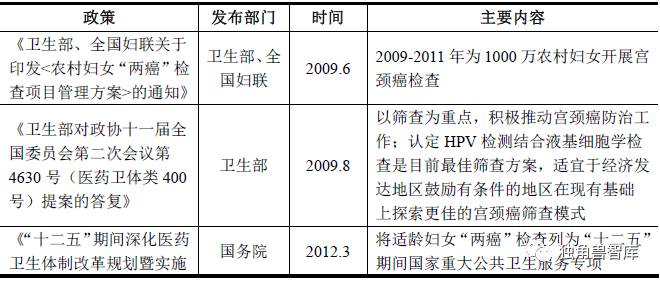
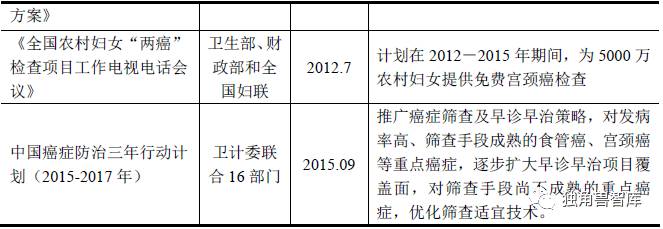
4、宫颈癌筛查技术介绍
目前国际上通用的宫颈癌及宫颈上皮内瘤变的诊断主要遵循“三阶梯式”诊断程序,即宫颈细胞学、阴道镜及组织病理学检查。宫颈细胞学检查是普遍应用的宫颈癌及宫颈上皮内瘤变的筛查方法,可发现早期病变。但受方法学所限,宫颈细胞学检查存在一定的漏诊及误诊率。
高危型HPV 筛查用于宫颈细胞学检查异常患者的分流及宫颈癌筛查,主要针对导致宫颈癌的病因进行检测,具有良好的风险预测性,且所有检测结果均由检测仪器判读,避免了各种人为主观因素对检测结果的影响,可有效地增加宫颈病变检出率,提高细胞学检测敏感性,并降低筛查频率。因此在筛查领域,HPV检测较细胞学检测有更低的假阴性率,同时对于HPV 阳性者,结合细胞学或阴道镜活检技术可以进一步提高检测特异性。2015 年,美国阴道镜检查与宫颈病理学会(ASCCP)发布的过渡期指南,HPV 检测可独立应用于宫颈癌的筛查中。
5、HPV全分型检测的临床意义
随着对宫颈癌病因研究的深入,世界卫生组织(WHO)及国际癌症研究总署(IRAC)确认的14 种高危型包括HPV16、18、31、33、35、39、45、51、52、56、58、59、66 及68。根据2015 年ASCCP 过渡期指南,其中16和18 两型HPV 的致癌性远高于其它型别。而根据西班牙Català癌症研究所(ICO)于2014年公布的中国HPV 感染型别的数据,16、18、58、52、33 这五个型别占据了宫颈高等级病变的前五位。因此,HPV 的全分型产品较不分型及部分分型能提供更多临床信息。具体全分型产品的意义如下:
于判断HPV 感染是否同一高危亚型的持续感染。同一亚型较不同亚型反复感染具有更高风险;
1、对于未明确诊断意义的不典型鳞状细胞(ASCUS)和鳞状上皮内低度病变(LSIL),HPV 分型检测是一种有效再分类方法;
2、用于手术后的追踪,确定是否将病灶清除干净;治疗后的随访,判断治疗前后HPV 感染的型别是否一致;
3、阴道镜检查的适应症:根据ASCCP,16 和18 型与其它型别的HPV 感染有着不同的处理流程,16 和18型风险更高需直接进行阴道镜检测;
4、指导HPV疫苗的研究及使用:目前开发的疫苗主要为二价和四价疫苗,主要针对高危16 和18 型,如已经感染这两种型别则不能再起到预防作用;
5、分型检测有助于鉴定不同亚型的多重感染。
七、IVD细分领域之三:优生优育体外诊断市场概况
公司产品“Y 染色体微缺失检测试剂盒”主要用于男性少精、无精常规检测(EAA/EMQN 推荐),可用于指导男性不育的诊治,为辅助生殖提供遗传参考。据世界卫生组织(WHO)统计,全球不育夫妇约占已婚夫妇的15%,由于男方原因引起的不育占50%。根据中国人口协会发布的数据显示,我国近年来不孕不育症存在着上升的趋势,适龄产妇的不孕不育患病率大幅增长。数据显示,国内不孕不育的平均发病率为12.5%~15%,也就是每8 对夫妻就有一对不孕不育;而中国不孕不育患者人数已超过5,000 万。在快速增长的不孕不育患者中, 25 岁至30 岁的人数居多。
男性不育患者中约有30%具有遗传学异常,这部分患者采用药物治疗是无效的。Y 染色体上的精子生成因子(azoospermia factor,AZF)位点微缺失是男性原发性不育的一个重要遗传因素。AZF 基因家族有AZFa、AZFb、AZFc 三个区域,其中任何一个区域的微缺失都能导致精子生成障碍。
欧洲生殖协会(EAA)和欧洲分子遗传实验质控组织(EMQN)2013 版指南推荐Y 染色体微缺失检测作为男性少精、无精常规检测项目以及辅助生殖必检项目。公司自主开发的“Y 染色体微缺失检测试剂盒”是国内同类产品中第一个获得医疗器械注册证的产品,并完全符合欧洲生殖协会(EAA)和欧洲分子遗传质控组织(EMQN)2013 版指导原则,适用于无精症、少精症、弱精症以及原因不明的不育患者的临床辅助诊断,具有广阔的市场空间。
八、IVD行业竞争格局
1、全球竞争格局及代表企业
经过多年发展,体外诊断在全球范围内已成为拥有数百亿美元庞大市场容量的成熟行业,市场集中度较高,并聚集了一批著名跨国企业集团。前十大公司占据全球近八成的市场份额,主要分布在北美、欧洲等体外诊断市场发展早、容量大的经济发达国家。EvaluateMedTech 统计数据显示,2012 年全球前十大体外诊断公司依次为:罗氏(Roche Diagnostics)、雅培(Abbott)、贝克曼库尔特(BeckmanCoulter,2011 年被丹纳赫收购)、西门子(Siemens Healthcare)、赛默飞(ThermoFisherScientific)、碧迪(Becton Dickinson)、美艾利尔(Alere)、希森美康(Sysmex)、强生(J&J)、生物梅里埃(BioMerieux)。这些企业集团下属体外诊断业务年销售收入均在10 亿美元以上,产品线丰富,不仅包括各类体外诊断试剂,还包括各类诊断仪器以及与之相关的医疗技术服务。上述公司的基本情况如下:
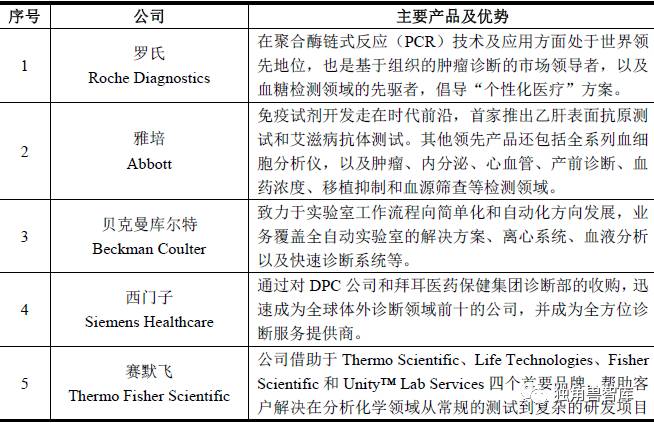

2、国内竞争格局及代表企业
体外诊断行业在我国属于新兴产业,与欧美国家相比起步晚,产业化发展相对滞后。根据中国体外诊断网的数据显示,我国体外诊断行业集中度较低,业内企业约300-400 家,其中年销售过亿元的企业只有数十家。近几年,国内企业抓住机遇,凭借产品性价比高和更为贴近本土市场的优势,不断扩大市场份额,逐渐打破以进口产品为主导的市场格局。随着研发投入的加大和产品质量水平的提升,我国体外诊断行业现已涌现一批实力较强的本土企业,集中在生化、免疫、分子诊断三大领域,并在某些产品领域逐渐具备与国际巨头竞争的实力,如下表所示:
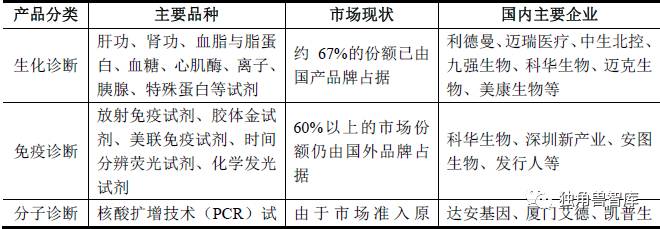

总体而言,国内企业市场割据竞争的格局较为明显,实力较强的综合性企业还较少,行业排名靠前的企业主要是在某一领域具备竞争优势。目前国内各领域领先企业正积极进行多元化发展,一是依托原有优势纷纷进入生化、免疫、分子诊断试剂等多个领域,以丰富试剂产品种类;二是开展上游核心原料以及配套诊断仪器的自主研发生产,以增强市场竞争实力;三是开始积极开拓国外市场,尤其是亚非拉等发展中国家市场。随着国内领先企业技术研发实力的提升和经营规模的壮大,预期行业市场集中度将进一步提高,国内领先企业与国外企业在高端市场的竞争能力也将快速提升。
3、行业内主要企业情况
公司肿瘤标志物系列产品的主要外资品牌,如罗氏、雅培等,国内企业在该领域起步较晚,规模普遍较小,主要市场参与者为深圳新产业、安图生物等公司;公司HPV 系列产品的主要竞争对手为国内企业,如凯普生物、亚能生物等。国内体外诊断行业主要企业还包括科华生物、达安基因、利德曼、艾德生物、九强生物、迈克生物、中生北控、美康生物、透景生命等企业,上述企业的基本情况如下:

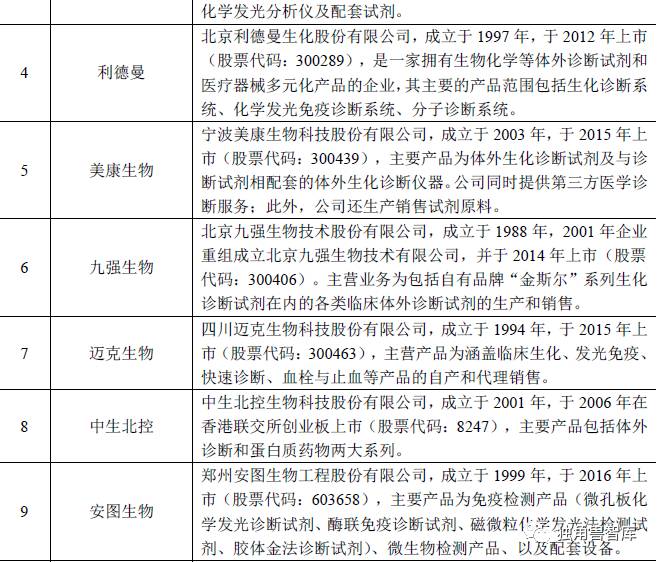

13 | 透景生命 | 上海透景生命科技股份有限公司,成立与2003年,主营业务为免疫诊断产品和分子诊断产品两大类。公司综合运用高通量流式荧光技术、化学发光免疫分析技术、多重多色荧光PCR技术等多个技术平台开发诊断试剂,形成了“以肿瘤全病程临床检测产品为主。 |



















