

近年来,医疗设备和实验诊断已成为卫生技术评估和药物经济学研究的重要内容之一。在不久前结束的第22届国际药物经济学和结果研究大会(ISPOR)上也开辟了专场对此进行讨论。
按照全球协调工作组的定义,医疗器械 (medical device) 是指作用于人体的仪器、设备、机械、器械、植入物、体外诊断产品或软件、材料或其他类似或相关的物品。可见,其内涵十分广泛,因此彼此之间的具体研究方法也不完全相同。
医疗器械的经济学评价与药物的经济学评价不同。药品需要进行Ⅰ期、Ⅱ期及Ⅲ期临床试验,且药品进入人体后会发生药代动力学变化,但医疗器械的研究不需要开展Ⅰ期、Ⅱ期及Ⅲ期临床试验,植入物会在体内长期存在,改变了患者的通路 (pathway),使用者(患者或医生)的技能 (skill) 和学习曲线 (learning curve) 的过程提供了收集真实世界数据的机会。医疗器械的评价不同于药物评价中常用的临床随机对照试验,而是更多地使用真实世界的研究方法。
早在2009年,Tayor就指出医疗器械和药品在效果评价方面有三个不同点:一是器械上市需要有许可证制度;二是医疗器械的治疗效果与操作者的熟练程度密切相关,操作者有一个学习的过程,俗称“学习曲线”,是器械和操作(使用)者交互作用的结果;三是器械有明显的渐进性的创新特点,因此医疗器械的更新速度快,带来了技术评估的复杂性(图1)。
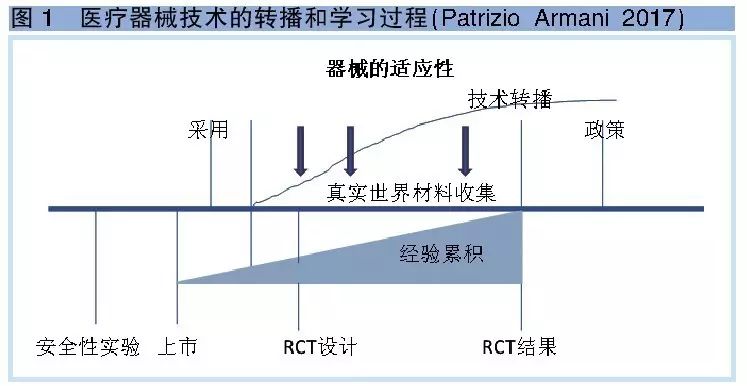
图1显示一个技术或一个医疗器械发明后,有一个技术传播的过程,逐渐被采纳应用。医疗器械自身也会在临床应用过程中不断地改进以适应临床需要。其次,临床医生在使用过程中会不断累积经验,提高使用的效果。
可以通过传统的成本效果分析方法研究医疗器械的功效(efficiency),但大量的机会是在上市后,在医院运用过程中进行真实世界效果 (effectiveness) 的评价。一个新技术的产生需要通过临床适应期、纳入疾病的诊疗指南、获得医保补偿,继而计划推广。不同时期的决策也是不一样的,如前期主要是临床决策,需要有循证依据证明这个新技术是值得推广的,并得到医疗保险的补偿。一个新技术在上市前,要先证明其安全性,如果只有单臂的临床试验,没有对比的技术,只有登记病例试验的资料,则不可能开展临床对照试验。在新的医疗器械进入市场后,可根据临床的使用和技术的转播,再开展相关的临床随机试验,如果疗效好,便应做出医保决策,列入报销范围。从政策制定者角度来看,真实世界的研究结果往往是最有用的。
医疗器械生产厂商的观点认为,真实世界研究数据的质量是最重要的。从个案角度来看,要以病人为中心;从人群角度来看要以效果为基础。临床随机试验往往不能得到真正效果的数据。其次,要将医疗器械的检查或应用列入到疾病临床诊疗的规范中,才能够获得真实世界的数据。最后,真实世界的数据要适合于多种相关利益者的评价,价格是由价值来反映的货币价值。那么,什么样的证据是最需要的呢?临床随机试验的优点是能够控制由于混杂因素引起的选择偏倚,缺点是内部或外部的效度较差。
Drummond 教授在2009年时提出从六个方面评价医疗器械的价值:
(1)要考虑医疗器械的不同性质及其在路径中的应用;
(2)证据的产生和功效、效果的评价时要明确是通过观察研究、随机对照试验,还是真实世界的研究方法来比较患者治疗后的健康结果;
(3)组织的改进,包括医疗器械的评价方法;
(4)医疗器械的应用技术和学习曲线过程对安全性和治疗效果有影响,如何在真实世界研究中定量成本,支持医疗器械最佳的应用价值是值得研究的;
(5)研究医疗器械产品的短期生命周期,是否采用风险分担的方法去适应路径和产品的快速创新;
(6)当医疗器械不断发生创新时,如何采用经济学模型及时研究与比较产品价格的快速变化。
医疗器械立法的需要不如药品那样严格,在进入市场时临床的定性或定量的资料经常是不充分的,或者证据的质量不高,致使决策者难以做出是否给予补偿的决定,使服务提供者在应用时也具有一定的危险性。Andrisani 提供了一组数据,在2007-2017年意大利的植入性心脏医疗器械市场中共有1889种产品,其中只有59%具有临床试验结果。以治疗二尖瓣反流的Mitraclip 为例,基于27例Ⅰ期临床试验(EVEREST-Ⅰ)在2006年得到美国FDA批准, 2009年得到了109例的随访试验结果,2011年才开展了第一个279例临床随机试验,结果并未证明优于其它常规方法。2009年进入意大利市场,到2014年进入使用高峰期。
另一个例子是治疗心房卵圆孔未闭的先天性心脏病的器械,2000年进行了Ⅰ期临床可行性试验,2005年法国HAS进行了第一个卫生技术评估,包括系列病例分析和回顾性病例分析,直到2010年才进行第一个临床随机对照试验 (CLOSURE I) ,结果证明该设备与常规治疗方法没有显著差异。直到2016年,才再次开展大规模的临床随机对照试验 (RESPECT)。可是,早在2013年,该产品已进入意大利市场,而且到2014-2015年,每年已有2500例患者进行了手术。
从这两个案例中可以看到,医疗器械的研究仍然需要临床随机对照试验来进行评价,临床随机试验是最佳的。那么,真实世界的研究又会起到什么作用呢?总的来说,如果受到时间、费用、伦理等因素的影响,不可能开展临床随机对照试验的话,医疗器械的真实世界的研究是最好的解决办法。
■编辑 慕欣















