
药明康德/报道
最近,匹兹堡大学(University of Pittsburgh)的研究人员发现了一个可充分释放免疫疗法药物抗癌潜力的线索。这项在《细胞》杂志上发表的工作显示,靶向调节性T细胞(Treg)可能是治疗癌症的有效方法。文章同时还揭示了目前免疫疗法药物的一种重要作用机制,并提供了使其变得更有效的思路。
Tregs的作用在于使我们的免疫系统保持微妙的平衡。“它们的行为就像一个调光开关,一方面足以发现和消除威胁的光亮,另一方面又避免让自身的细胞受到伤害,”文章通讯作者Dario Vignali教授说道:“在癌症中,Treg可能是有害的,因为它们让光线过暗,使得免疫系统难以检测到和杀死癌细胞。尽管通过药物清除Treg似乎是一种合乎逻辑的治疗方法,但这可能导致危及生命的自身免疫并发症,使其不可适用于癌症患者。因此,我们需要找到选择性靶向肿瘤中的Treg的方法,而不去影响到在肿瘤之外的Treg。”

▲文章通讯作者Dario Vignali教授(图片来源:匹兹堡大学)
几年前,Dario Vignali教授和他的同事们已经发现,在几乎所有浸润小鼠肿瘤的Treg上,都表达有Nrp1这一细胞表面蛋白,其对在恶劣的肿瘤微环境中Treg的功能维持、完整性和存活都是必需的。因此,Tregs上的Nrp1会抑制人体的天然抗肿瘤免疫反应,从而有利于肿瘤存活。重要的是,在小鼠体内的Tregs中阻断或敲除Nrp1仅会影响其在肿瘤中的功能,而不影响在正常组织中的作用,因此可清除肿瘤而不引起自身免疫性或炎症性疾病。
“我们在本研究中发现,在小鼠中,Tregs的Nrp1表达是其具有防止免疫系统清除肿瘤的能力的必要条件。有趣的是,当Tregs失去Nrp1时,它们不仅不能进行免疫抑制,反会成为抗肿瘤免疫反应的积极参与者,”Dario Vignali教授说:“我们还发现,在预后不佳的癌症患者体内,Treg中表达Nrp1的亚群比例明显偏高,从而提示这些发现可能也适用于人类。”

▲Treg的免疫抑制机制(图片来源:NIH)
研究小组构建了一种转基因小鼠黑色素瘤模型,其中Nrp1基因仅在一半的Treg细胞中被敲除,而在另一半中被保留。他们发现,与所有Tregs中均表达Nrp1的正常小鼠相比,该模型的肿瘤生长显著降低。
“不表达Nrp1的Tregs不仅‘降低光亮’的能力下降,还可以防止正常的Treg发挥免疫抑制功能,这样可以促使免疫系统发现并攻击肿瘤,”文章第一作者Abigail E. Overacre说。基因组和细胞分析显示,缺失Nrp1的Tregs会大量分泌干扰素-γ(IFNγ),后者选择性地在肿瘤中阻断Tregs的“调光开关”功能。
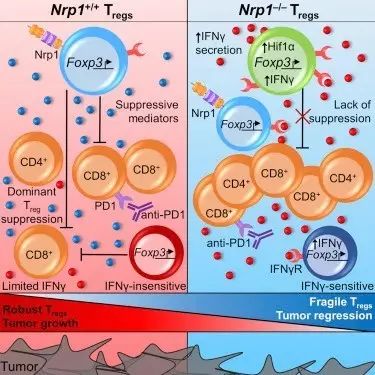
▲正常(左)与Nrp1敲除(右)Treg比较(图片来源:《细胞》)
进一步研究显示,IFNγ对Treg功能的抑制作用对抗PD1免疫疗法的成功是至关重要的。“虽然我们开始认为,IFNγ可能会影响Treg的功能,从而影响免疫疗法的效果,但其影响程度最终真的大到让我们感到惊讶。当我们敲除Tregs中IFNγ受体的基因,使它们不再对IFNγ敏感,免疫疗法药物这时就完全没有效果,”Dario Vignali教授说:“事实上,IFNγ似乎使得Tregs变得脆弱,从而失去了免疫抑制功能,但这仅是在肿瘤中(与缺氧诱导因子HIF1α有关)。因此,削弱Treg或是有效实施免疫疗法的关键要求。”
如果我们能够使一部分肿瘤相关Tregs丧失免疫抑制功能,比如通过使用IFNγ,可能足以引发连锁反应,让这些细胞影响其他肿瘤相关Treg,从而促进抗肿瘤免疫反应,而不会引起不良的自身免疫性副作用。另一方面,Treg的功能脆弱性也许可成为监测免疫疗法是否对患者有效的重要指标。
点击“阅读原文”,即可访问原始论文页面。
参考资料:
[1] Interferon-γ Drives Treg Fragility to Promote Anti-tumor Immunity
[2] Targeting immune cells that help tumors stay hidden could improve immunotherapy
















