摘
要:
目的
基于体外代谢模型对鱼腥草
Houttuynia cordata
挥发油代谢产物通用客体
“
印迹模板
”
进行研究。
方法
自制鱼腥草注射液(
Houttuyniae Injection
,
HI
),将其在大鼠肝微粒(
RLM
)中进行孵育,于不同时间点采集样本,进行
GC-MS
测定;计算所有代谢产物的分子连接性指数(
MCI
),并从中筛选出代谢产物的共有成分和非共有成分,总结其结构特点,运用夹角余弦法计算相似度;将所有代谢成分进行归类。
结果
共得到鱼腥草挥发油代谢产物
62
个,其中共有成分
6
个,分别是十四烷、植烷、正癸酸、己酸、乙酸异龙脑酯和正己醇,除乙酸异龙脑酯外,
MCI
与总体代谢产物相似度较高(
0.914
~
0.964
)。将非共有成分归类得到
6
个成分群,其平均
MCI
与总代谢产物
MCI
的相似度均较高(
0.939
~
0.999
),然而各个成分群之间的平均
MCI
相似度差异显著。
结论
以超分子
“
印迹模板
”
为理论指导,为鱼腥草挥发油代谢产物进行了归类。采用分子连接性指数和夹角余弦法,表征了鱼腥草挥发油代谢通用客体
“
印迹模板”
。
鱼腥草为三白草科蕺菜属植物蕺菜
Houttuynia cordata
Thunb.
的新鲜全草或干燥地上部分,始载于《名医别录》。作为广泛应用的传统中药,具有清热解毒、消肿疗疮、利尿除湿的功效。现代研究发现其主要化学成分为挥发油类、黄酮类、有机酸、脂肪酸、氨基酸以及生物碱类成分
[1]
。其中挥发油类成分为主要药效成分,其鲜草含挥发油
0.049%
,主要有鱼腥草素,即癸酰乙醛、癸醛、月桂醛及甲基正壬酮等成分
[2-6]
。
临床上曾广泛应用的鱼腥草注射液(
Houttuyniae Injection
,
HI
)是从鲜鱼腥草中用水蒸汽蒸馏法提取的挥发油类成分
[7]
,加入增溶剂聚山梨酯
-80
及氯化钠调节为等渗溶液,滤过后灭菌而成,具有抗菌、抗病毒以及增强机体免疫力的药理作用,用于治疗上呼吸道感染、急性化脓性扁桃体炎、急性慢性支气管炎、肺炎等呼吸道疾病、尿道炎、肾盂肾炎等泌尿系统疾病以及各种皮肤感染等疾病
[8‑10]
。鱼腥草的有效成分为挥发油,是多成分体系
[11‑13]
。目前,关于鱼腥草挥发油的代谢产物鲜有报道,且没有将这些代谢产物进行归类总结。
超分子化学,即“超越分子的化学”,由
J M Lehn
提出,是分子间键的化学,涵盖由两个或两个以上化学成分缔合形成的实体的结构和功能,用于研究分子自识别、自组装等现象
[14]
。中药超分子化学理论认为,中药与人体均为自然界生物超分子体,其药效基础为生物超分子“印迹模板”的聚集体,进入人体后按超分子自主印迹行为发挥药效作用
[15]
,代谢产物也同样适用
[16]
。“印迹模板”理念起源于
Fischer
的酶与底物作用的“锁钥模型”及
Pauling
的“抗体
-
抗原”学说,可解释配体
-
受体理论,属超分子化学中主
-
客体化学研究范畴,具自组装、自组织、自识别与自复制的特点
[17]
。“在空间结构和结合位点上能完全匹配的模板物”即为超分子“印迹模板”,对中药成分来说既是其分子结构的空间活性结构,也可以说是活性原子团的空间排列点阵,据此可从化学物质的本源上阐明主
-
客体分子自主作用的普遍规律。
因此,本实验通过自制
HI
,首次研究
HI
中的挥发油在大鼠肝微粒体的代谢产物及其特点,以超分子“印迹模板”为理论
[16,18‑20]
,结合分子连接性指数(
MCI
)
[21]
,探索其代谢通用客体的“印迹模板”规律,对指导鱼腥草临床合理用药及其配伍具有重要意义,为中药代谢产物“印迹模板”的研究奠定基础。
1
材料
1.1
药品与试剂
新鲜鱼腥草
8
批,购于湖南中医药大学含浦校区周边村庄或菜市场,按照采购时间批次编号依次为
YXC01
~
YXC08
,经湖南中医药大学药学院中药鉴定教研室刘塔斯教授鉴定为三白草科蕺菜属植物蕺菜
H. cordata
Thunb.
的新鲜全草。
对照品甲基正壬酮(批号
110834-200502
,
0.1 mL
,
GC
测定质量分数≥
98%
)、正十五烷(批号
11677-200401
,
100 μg/mL
)、乙酸龙脑酯(批号
110759-201105
,
0.2 mL
,
GC
测定质量分数≥
97%
)及
α-
蒎烯(批号
897-2000001
,
1 mg
,
GC
测定质量分数≥
98%
)均购自中国食品药品检定研究院;正已烷,批号
K46764991524
,色谱纯,购自德国默克股份有限公司;
KH
2
PO
4
、
K
2
HPO
4
、
KCl
、乙二胺四乙酸(
EDTA
)、甘油、烟酰胺腺嘌呤二核苷酸磷酸(
NADP
)、
6-
磷酸葡萄糖(
G-6-P
)、葡萄糖
-6-
磷酸脱氢酶(
G-6-P-DH
)、
MgCl
2
、
(NH
4
)
2
SO
4
均购自
Sigma
公司;乙腈、甲醇为色谱纯,其他试剂均为分析纯;水为超纯水。
1.2
动物
雄性
SD
大鼠,
SPF
级,体质量
200
~
220 g
,购自湖南斯莱克景达实验动物有限公司,许可证号:
SCXK
(湘)
2011-0003
。本研究依照湖南中医药大学伦理委员会的要求执行,
动物实验经
湖南中医药大学伦理委员会
批准(伦理编号
:
LLBH-201107230003
)。
1.3
仪器
CM-230
超纯水系统,北京帕思特科技有限公司;
GCMS-QP2010
型气质联用仪,日本岛津公司;
CP-114
电子天平,奥豪斯仪器上海有限公司;
98-1-B
型电子控温电热套,天津市泰斯特仪器有限公司;
1000 μL
和
100 μL
移液枪,济南好来宝医疗器材有限公司;
20 mm
球形冷凝管,天津市奥淇洛谱商贸有限公司;
500 mL
挥发油提取器,天长市吉高实验设备有限公司。
2
方法
2.1
HI
样品制备
取新鲜鱼腥草全株,除去泥沙、根及烂叶,称取
2000 g
,用剪刀剪碎成
2
~
3 cm
的小段,置于单口圆底烧瓶中加水浸没药材。水蒸气蒸馏,收集初次蒸馏液
2000 mL
,再进行重蒸馏,收集重蒸馏液约
1000 mL
,加入
7 g
氯化钠及
5 g
聚山梨酯
-80
,混匀,加注射用水使成
1000 mL
,使用
0.45 μm
和
0.22 μm
的滤芯进行滤过,灌封,
115
℃灭菌
30 min
,即得
HI
。
2.2
肝微粒体实验溶液配制
2.2.1
PBS
液配制
精密称取
KH
2
PO
4
、
K
2
HPO
4
、
KCl
粉末分别配制成
1 mol/L
的溶液,并配制
EDTA
饱和溶液(
100 mmol/L
),用移液管量取
40.1 mL K
2
HPO
4
溶液,
9.9 mL KH
2
PO
4
溶液,
60 mL KCl
溶液,
5 mL EDTA
溶液,加水至
500 mL
,调整
pH
值为
7.4
,即得
PBS
液。
2.2.2
G.S
(
800 mL
)系统溶液的配制
将
NADP
、
G-6-P
、
G-6-P-DH
、
MgCl
2
、
(NH
4
)
2
SO
4
分别配制成
65 mmol/L
、
165 mmol/L
、
500 U/mL
、
165 mmol/L
、
2.6 mol/L
的溶液,向离心管中分别加入去离子水
528 µL
,
G-6-P
溶液
80 µL
,
G-6-P-DH
溶液
32 µL
,
NADP
溶液
80 µL
,
MgCl
2
溶液
80 µL
,配制成
G.S
(
800 mL
)系统溶液。
2.3
大鼠肝微粒体制备
实验前大鼠控制饮食
1
周,并于实验前禁食不禁水
24 h
。将大鼠固定在木板上,并用细线把大鼠四肢及头部固定。用剪刀将大鼠腹部打开,快速找到肝脏;用另一把消毒冷藏过的剪刀将肝脏整个剪下来,不能带有除肝脏外的其它任何部分,用冰水洗净,称定质量。按
1
∶
4
比例(
1 g
肝组织、
4 mL PBS
液)将肝组织研碎,倒入
50 mL
离心管,以
9000
×
g
、
4
℃离心
20 min
后快速取上清,再以恒温
4
℃、
100 000
×
g
离心
90 min
,取下层粉红色沉淀,即为大鼠肝微粒体,按照体积比
1
∶
3
向肝微粒体中加入储存液(
750 mL PBS
,
250 mL
甘油)后,分装于离心管中
−80
℃下保存备用。
2.4
孵化反应
向管中加入
25 μL HI
(空白组加蒸馏水),
40 µL
的磷酸盐缓冲液(
pH
值
7.4
),
20 µL
肝微粒体和
60 µL
双蒸馏水,
37
℃恒温水浴锅预孵化
10 min
。加入
G.S
液启动反应,并继续在
37
℃孵育,于
10
、
30
、
45
、
60
、
75
、
90
、
120
、
150 min
取样品。平行
3
组进行实验。
2.5
体外代谢样品的制备
在样品中加入
22.0μg/mL
正十五烷(内标),用
800μL
氯仿
-
异丙醇(
9∶1
)萃取,涡旋振荡
1 min
,
3000 r/min
离心
10 min
,取上清液进行
GC-MS
测定。
2.6 GC-MS
分析
条件
2.6.1
气相色谱条件
色谱柱为石英毛细管柱
Rtx-5ms
(
30 m
×
0.25 mm
×
0.25 μm
);升温程序:初温为
60
℃,以
2
℃
/min
升至
140
℃,保持
5 min
,再以
10
℃
/min
升至
200
℃,保持
9 min
;分流比
30∶1
;载气为高纯
He
(
99.999%
);载气流量为
1.0 mL/min
;气化室温度为
250
℃。
2.6.2
质谱条件
离子源为
EI
源;离子源温度为
230
℃;四级杆温度为
150
℃;电子能量为
70 eV
;接口温度为
280
℃;溶剂延迟
2.5 min
;质量范围为
m
/
z
40
~
500
。
3
结果
3.1
鱼腥草挥发油代谢产物信息
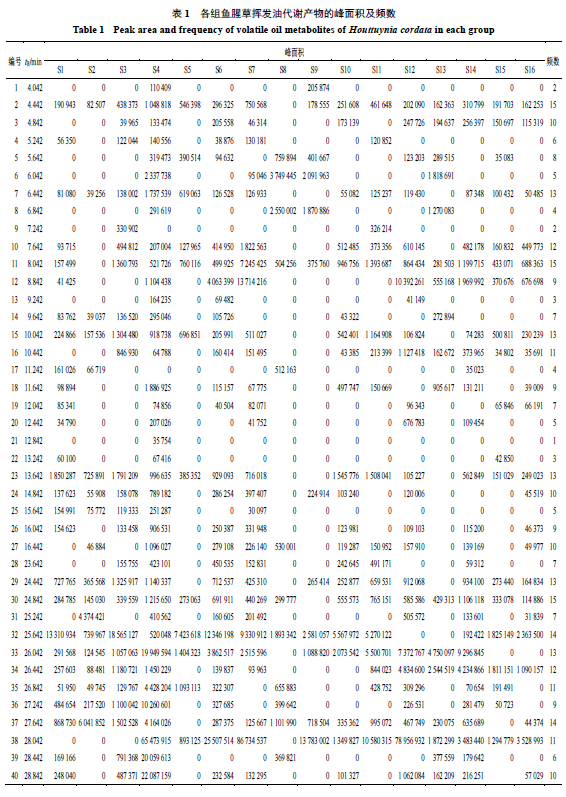
根据
GC-MS
结果,只采用
2
组理想的实验数据进行展示并分析。扣除空白溶剂峰,整理得到每个时间段各个峰的峰面积以及频数,共得到鱼腥草挥发油代谢产物
62
个,结果见表
1
,其中
S1
、
S2
来自
YXC01
,
S3
、
S4
来自
YXC02
,
S5
、
S6
来自
YXC03
,
S7
、
S8
来自
YXC04
,
S9
、
S10
来自
YXC05
,
S11
、
S12
来自
YXC06
,
S13
、
S14
来自
YXC07
,
S15
、
S16
来自
YXC08
。
3.2
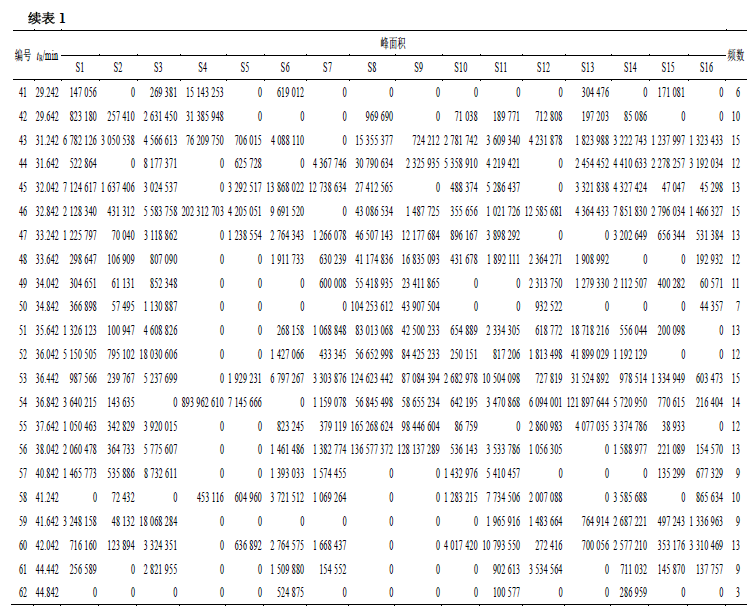
鱼腥草挥发油代谢共有产物
将频数≥
15
(
90%
批次数,本实验批次数为
16
)的成分视为共有成分,共得到
6
个共有成分,按相对质量分数从高到低排序分别为十四烷(
7.15%
)、植烷(
6.65%
)、正癸酸(
3.10%
)、己酸(
0.41%
)、乙酸异龙脑酯(
0.18%
)、正己醇(
0.13%
),且大都为简单直链结构,由芳香环、酯类等复杂的结构经过肝微粒酶代谢转化而来。由表
2
可得,共有成分的保留时间分布大致均匀。本实验只展示
MCI
零阶、一阶和二阶的值。采用夹角余弦法计算相似度,得到共有成分的
MCI
与总代谢产物相似度普遍较高,可以代表鱼腥草挥发油总代谢产物的“印迹模板”。乙酸异龙脑酯的相似度较低,可能是由于乙
酸异龙脑酯具有较复杂的带环立体结构,观察各个成分结构可知,大致包含烷烃、醇类、酯类、醛酮类等成分,且结构较为简单。众所周知,
MCI
值与分子拓扑结构有关,分子结构的细微差异,会在
MCI
各阶出现相应的变化,这可能是导致乙酸异龙脑酯
MCI
相似度较低的原因。