普遍存在的淀粉样蛋白假说假定淀粉样蛋白寡聚体直接促成AD的发展,使γ-分泌酶的抑制成为AD治疗的潜在治疗策略。不幸的是,也许是因为它们也抑制Notch切割,γ-分泌酶抑制剂会引起严重的副作用,而对AD患者没有任何明显的临床益处。
为什么会这样,让人疑惑不解。
2019年1月11日,清华大学施一公团队在
Science
在线发表题为“
Recognition of the amyloid precursor protein by human γ-secretase
”的研究论文,该论文报告了人类γ-分泌酶与跨膜APP片段的复合物的冷冻电子显微镜(cryo-EM)结构,分辨率达到2.6Å。 APP的跨膜螺旋(TM)与PS1的五个周围TM(γ-分泌酶的催化亚基)紧密相互作用。 该结构与结合Notch的γ-分泌酶的结构一起揭示了底物结合的对比特征,其可用于设计底物特异性抑制剂。因此,该结构用作发现γ-分泌酶的底物特异性抑制剂和理解γ-分泌酶的生物学功能以及AD的疾病机制的重要框架。
另外,iNature发现在
2018年12月31日,施一公研究组在
Nature
在线发表题为“
Structural basis of Notch recognition by human γ-secretase
”的研究论文,该论文
报告人类γ-分泌酶与Notch片段的复合物的冷冻电子显微镜结构,分辨率为2.7Å。 Notch的跨膜螺旋被PS1的三个跨膜结构域包围,并且Notch片段的羧基末端β-链形成β-折叠,其在细胞内侧具有两个底物诱导的PS1的β-链。 杂合β-折叠的形成对于底物裂解是必需的,其发生在Notch跨膜螺旋的羧基末端。 PS1在底物结合后经历明显的构象重排。 这些特征揭示了Notch识别的结构基础,并且对γ-分泌酶对淀粉样蛋白前体蛋白的募集具有意义(
点击阅读
)。另外,
2018年8月10日,清华大学施一公研究组在
Science
杂志在线
发表题为“
Structure of the human PKD1/PKD2 complex
”的研究论文,该论文报告以1:3比例组装的截短的人PKD1 / PKD2复合物的3.6Å冷冻电子显微镜结构。 总之,PKD1 / PKD2复合物的近原子分辨率结构揭示了异寡聚体复合物装配的分子细节,并提供了用于绘制大量疾病突变的模板。 阐明PKD1和PKD2的功能机制以及数百种ADPKD突变的疾病机制有待进一步研究。 施一公研究组的结构作为PKD1 / PKD2和ADPKD的未来生物物理,生物化学,细胞和计算分析的框架。另外,在
2018年5月,施一公研究组在
Science
杂志
发表题为“
Structures of the fully assembled Saccharomyces cerevisiae spliceosome before activatio
n
”的研究论文,该论文分别报告了酿酒酵母B和pre-B复合物的冷冻电镜结构,平均分辨率分别为3.3-4.6和3.9Å。 在pre-B复合体中,5'-剪接位点(5'SS)和U1 snRNA之间的双链体被Yhc1,Luc7和Sm环识别。 在B复合物中,U1 snRNP被解离,5'-外显子-5'SS序列在U6 snRNA附近易位,并且三种B特异性蛋白质可以定位前mRNA。 在两种复合物中,U6 snRNA都锚定在U5 snRNA的环I上,并且分支点序列和U2 snRNA之间的双链体被SF3b复合物识别。
结构分析揭示了酵母剪接体的装配和激活机制
;
2018年1月,施一公研究组在
Science
杂志发表题为“
Structure of a human catalytic step I spliceosome
”的研究论文,该论文报告
人类C复合物
的冷冻电子显微镜结构,平均分辨率为4.1埃。 与酿酒酵母C复合物相比,人复合物含有11种额外的蛋白质。这些特征以及人类C和C *复合物的结构比较提供了对核糖核蛋白重构的机理性认识,并允许C到C *转变的工作机制的命题
(
点击阅读
)。


阿尔茨海默病(AD)的标志是AD患者脑中存在淀粉样蛋白斑。淀粉样斑块的主要成分是源自淀粉样蛋白前体蛋白(APP)的β-淀粉样肽(Aβ)。 I型跨膜蛋白APP首先被α-或β-分泌酶切割,分别产生83或99个残基的跨膜片段(APP-C83或APP-C99)。然后APP-C99通过其内肽酶活性被γ-分泌酶切割,产生48-残基肽Aβ48或49-残基肽Aβ49。随后通过γ-分泌酶的羧基末端肽酶活性切割Aβ49导致产生Aβ46,Aβ43和Aβ40的产生。类似地,Aβ48的切割产生Aβ45,Aβ42和Aβ38。其中,Aβ42和Aβ43特别容易聚集并形成淀粉样蛋白斑。除APP外,Notch受体也是α-和γ-分泌酶的底物。在α-分泌酶切割后,所得的跨膜Notch片段被γ-分泌酶切割以产生细胞内信号传导结构域。
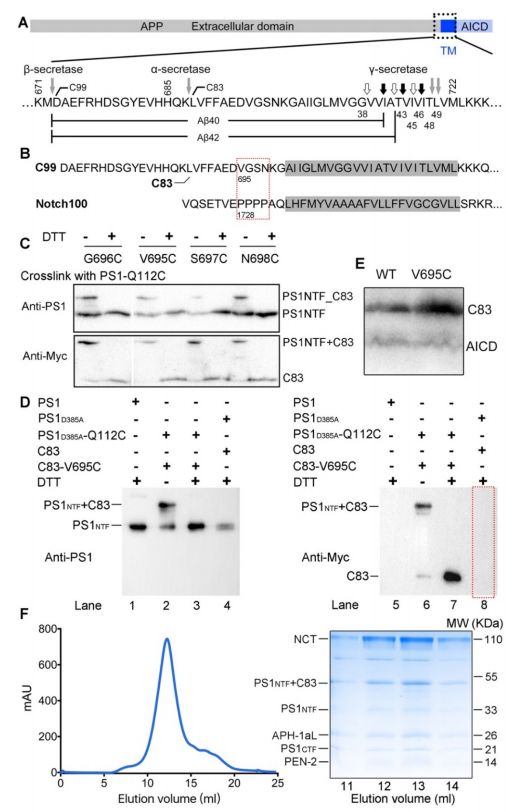
通过在PS1和APP-C83之间形成特定的二硫键产生稳定的γ-分泌酶-APP复合物
人γ-分泌酶包含四个亚基:早老蛋白(PS),PEN-2,APH-1和nicastrin。作为γ-分泌酶的催化亚基,早老素是具有两个催化Asp残基的天冬氨酰蛋白酶,并且具有两种同种型PS1和PS2。在γ-分泌酶组装期间,PS1经历自身蛋白水解以产生氨基末端片段(NTF)和羧基末端片段(CTF)。 PEN-2是γ-分泌酶成熟所必需的; APH-1稳定复合物和nicastrin被认为在底物结合中发挥作用。已经在PS1中鉴定了200多种AD相关突变,其中大多数导致Aβ42/Aβ40比率升高。
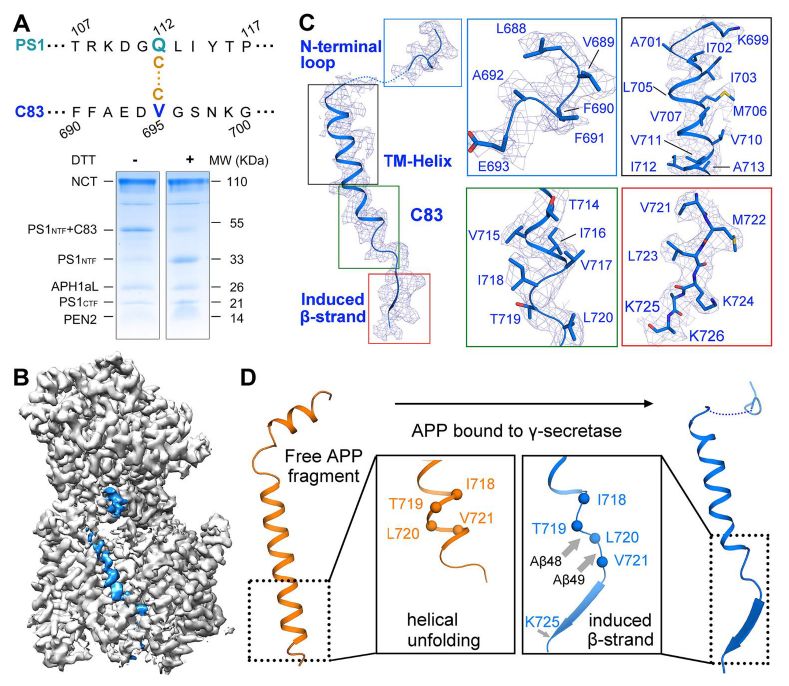
人类γ-分泌酶与跨膜APP片段的复合物的冷冻电子显微镜(cryo-EM)结构
普遍存在的淀粉样蛋白假说假定淀粉样蛋白寡聚体直接促成AD的发展,使γ-分泌酶的抑制成为AD治疗的潜在治疗策略。不幸的是,也许是因为它们也抑制Notch切割,γ-分泌酶抑制剂会引起严重的副作用,而对AD患者没有任何明显的临床益处。在这里,施一公报告人类γ-分泌酶与跨膜APP片段的复合物的冷冻电子显微镜(cryo-EM)结构,分辨率达到2.6Å。 PS1和底物之间的β-折叠对于γ-分泌酶的蛋白水解活性是必需的。该结构与γ-分泌酶 - Notch复合物的结构比较揭示了可用于开发底物特异性抑制剂的不同特征。
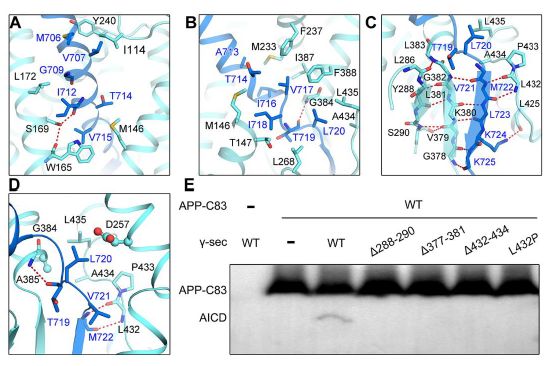
人γ-分泌酶识别APP-C83
与淀粉样蛋白前体蛋白结合的人γ-分泌酶的结构为γ-分泌酶连续底物切割的螺旋解旋模型提供了强有力的支持。 更重要的是,该结构允许通过γ-分泌酶比较APP和Notch识别以及AD相关突变的合理化。 因此,该结构用作发现γ-分泌酶的底物特异性抑制剂和理解γ-分泌酶的生物学功能以及AD的疾病机制的重要框架。
原文链接:
http://science.sciencemag.org/content/early/2019/01/08/science.aaw0930?rss=1
以上转自iNature,不代表我们观点