阿法替尼治肺癌的临床研究进展
杨小菊,欧娜,赵盼,王素梅,史澂空*,彭鹏
(山东轩竹医药科技有限公司山东 济南 250101)
[ 摘要] 阿法替尼为第2 代不可逆pan-her 酪氨酸激酶抑制剂,针对非小细胞肺癌进行了一系列临床试验。总结已开展的8 个LUXLung临床试验,从临床试验终点指标、患者的甄选、剂量的选择等方面进行了全面系统的分析,以期为同类药物的临床试验设计提供一定的参考和借鉴。
[ 关键词] 阿法替尼;酪氨酸激酶抑制剂;肺癌;不可逆抑制剂
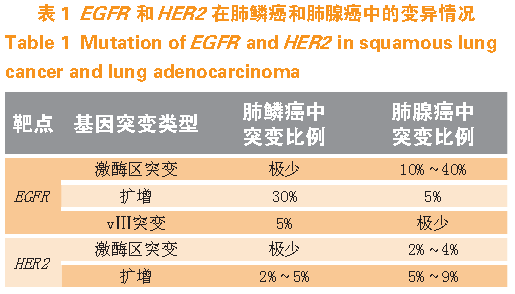
尽管肺癌已有多种治疗方案,但仍是全世界死亡率最高的癌种。按照2015 年世界卫生组织(WHO)分类,肺癌分为上皮性肿瘤、间叶性肿瘤、淋巴组织细胞性肿瘤、异位组织起源肿瘤及转移性肿瘤,其中,上皮性肿瘤又分为鳞癌、腺癌和神经内分泌肿瘤,而神经内分泌肿瘤又分为小细胞癌、大细胞癌以及腺鳞癌等。随着基因分型研究的进展,人们对肺鳞癌和肺腺癌的驱动基因认识更加深入,其中表皮生长因子受体(EGFR)和HER2 基因在肺鳞癌和肺腺癌中的变异情况有所不同,详见表1。EGFR 基因在肺腺癌中表现在激酶区的突变(如19 位外显子缺失突变或21 位外显子L858R 突变)和EGFR 的扩增,而其在肺鳞癌中表现为EGFR 扩增和EGFRvⅢ突变,且EGFRvⅢ突变仅发现在肺鳞癌中。HER2 基因在肺腺癌中表现在HER2 扩增和激酶区的突变,而其在肺鳞癌中存在小比例HER2 扩增。在肺鳞癌和肺腺癌中,EGFR 存在较高的基因变异比例,预示着针对肺癌适应证,表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)存在靶向治疗肺腺癌和肺鳞癌的希望,这一点在能同时抑制EGFR、HER2 和HER3的阿法替尼的临床实践中也得到验证。
1 阿法替尼简介
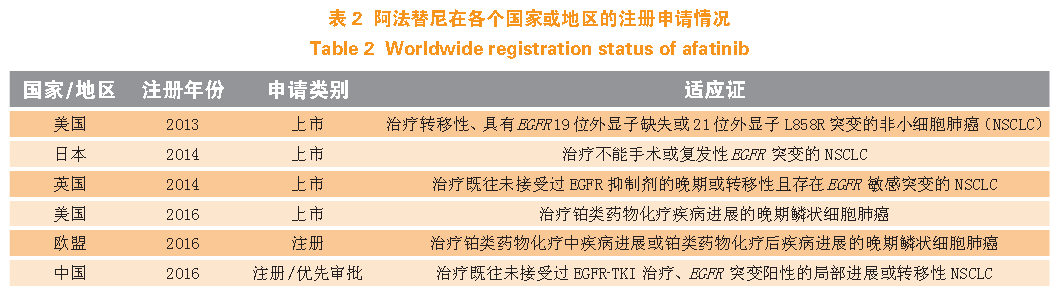
阿法替尼(通用名:afatinib,商品名:GILOTRIF®)为第2 代不可逆pan-her 酪氨酸激酶抑制剂,于2013年7 月13 日首次获得美国FDA 批准用于一线治疗转移性、具有EGFR19 位外显子缺失突变或21 位外显子L858R 突变的非小细胞肺癌。2016 年4 月20 日,FDA批准GILOTRIF® 用于治疗经顺铂治疗失败的转移性非小细胞肺鳞癌。
阿法替尼分别在欧盟、英国、日本以不同的适应证注册申请或上市(见表2),并于2016 年4 月在中国获得优先审批的资格。
2 阿法替尼治疗肺癌的临床研究
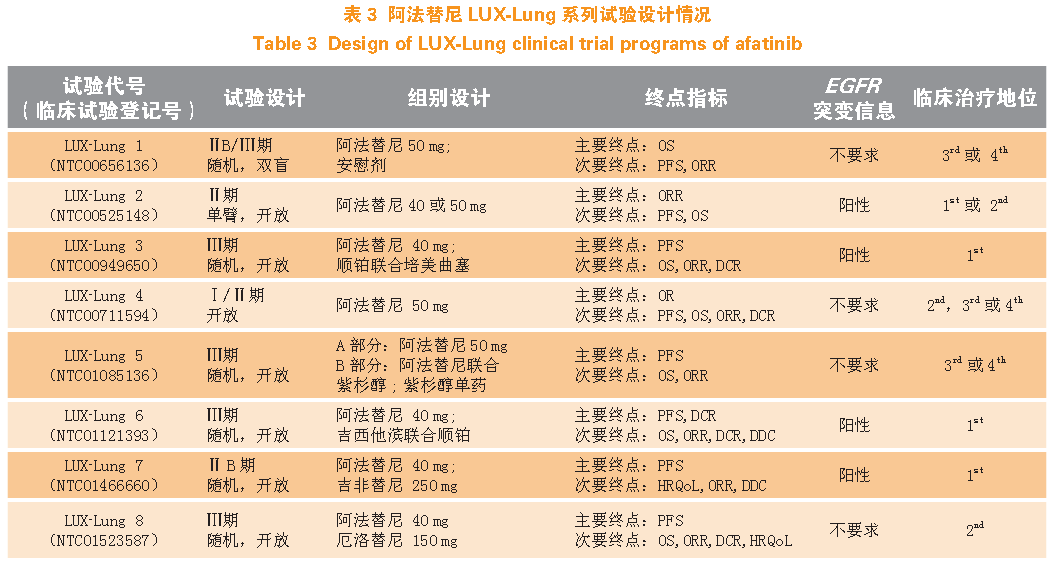
勃林格殷格翰公司针对阿法替尼用于非小细胞肺癌的治疗开展了一系列名为LUX-Lung 的临床研究,基于不同的试验目的,共开展8 个临床试验(LUXLung1~LUX-Lung8),试验设计信息汇总如表3 所示,以下将对每个试验的设计及临床试验结果进行分述。
2.1LUX-Lung 1 试验
LUX-Lung 1(NTC00656136)是在15 个国家86 个中心进行的随机双盲ⅡB/Ⅲ期临床试验,入组的受试者为经过至少1 次以顺铂为基础的化疗治疗,且既往经厄洛替尼或吉非替尼治疗至少12 周的ⅢB 期或Ⅳ期肺腺癌患者。由于LUX-Lung 1 为大型且国际化的试验,很难实现再次活检,故受试者入组时不强制进行EGFR 突变信息检测。试验排除了脑转移患者、怀孕患者、心脏病或功能失调患者、严重胃肠道紊乱患者、严重感染或肝肾功能异常以及血液参数异常的患者。成功入组的585 名受试者,以2:1 比例随机分配到阿法替尼组(n=390)和安慰剂组(n=195)。阿法替尼组的起始剂量为50 mg · d-1,出现严重不良反应经过药物治疗恢复后可调低到40 mg · d-1 继续试验。严重不良反应的定义为大于等于3 级或在最好的护理下仍然连续7 d 或7 d 以上2 级腹泻、恶心、呕吐。试验规定可以第2 次减低剂量,但减低到30 mg · d-1 仍出现上述严重不良反应则停止试验。主要终点为总生存期(OS)。阿法替尼组和安慰剂组的中位OS 分别为10.8 和12.0个月(P=0.74)。两组中位无进展生存期(medianPFS)分别为3.3 和1.1 个月(P < 0.01),客观缓解率(ORR)分别为11% 和0.5%。阿法替尼组最常见的不良反应为腹泻(87%)、皮疹和痤疮(78%),而在安慰剂组较少发生(腹泻9%,皮疹和痤疮16%)。研究结果显示,尽管阿法替尼并未达到主要终点指标OS的改善,但对EGFR 突变患者进行的亚组分析可见,与安慰剂组相比,阿法替尼治疗组受试者的PFS 和OS均有较大改善;同时健康相关生存质量(HRQoL)有临床意义的改善,尤其是肺癌相关的咳嗽(46% vs25%)、呼吸困难(51% vs 36%),以及疼痛(50% vs32%)。LUX-Lung1 试验显示,阿法替尼对既往接受过至少12 周第1 代EGFR-TKI 治疗失败的晚期NSCLC肺腺癌患者仍有一定程度的获益。
2.2LUX-Lung 2 试验
LUX-Lung 2(NTC00525148)是在中国台湾和美国共30 个中心开展的单臂开放的Ⅱ期临床试验,入组的受试者是存在EGFR 18-21 位外显子突变,且既往未接受过EGFR-TKI 治疗的肺腺癌患者。受试者在入组之前需经DNA 测序确定其组织呈EGFR 突变阳性。试验共入组129 人,其中104 人来自中国台湾地区,25 人来自美国。99 人起始剂量为50 mg · d-1,其中38 人以阿法替尼作为一线治疗,61 人以阿法替尼作为二线治疗。30 人起始剂量为40 mg · d-1,其中23 人以阿法替尼作为一线治疗,7 人以阿法替尼作为二线治疗。LUX-Lung2试验虽然参加人数较少,但试验目的涉及很多方面,包括对比一线治疗和二线治疗效果,对比常见EGFR 突变(19 位外显子缺失或21 位外显子L858R 突变)与不常见突变的响应,对比40 mg和50 mg剂量组患者受益情况,探索脑转移患者及EGFR T790M 患者的疗效。试验结果显示,常见突变患者的PFS 较不常见突变患者的PFS 延长更长(13.7 vs 3.7 个月),且接受阿法替尼一线治疗的患者PFS 长于接受二线治疗的患者。具体表现在常见突变L858R 和其他不常见突变的PFS 对比上(L858R: 15.8vs 8.0 个月,其他不常见突变:4.5 vs 3.2 个月)。起始剂量为50 mg · d-1 的患者99 人中有66 人不得不减低剂量到40 mg · d-1,而且有36 人进一步降低剂量到30 mg · d-1。相比起始剂量50 mg · d-1 组,起始剂量40 mg · d-1 组具有更好的耐受性,具备更好的治疗指数,后续试验也都推荐40 mg · d-1 为治疗剂量。在此试验中仅1 人是T790M 突变,因此并未获得对T790M 患者疗效确切的结果。试验未见对脑转移患者的疗效信息,出现脑转移和未出现脑转移患者在客观响应率上无差异,另外文献表明,尽管小分子靶向药物如厄洛替尼、阿法替尼等对脑转移的肺癌患者无显著疗效,但其对无脑转移症状患者的一线系统治疗可推迟放疗的复发时间。LUX-Lung2 的结果推荐的治疗剂量为40 mg · d-1,对EGFR 突变患者的一线治疗疗效显著。
2.3LUX-Lung 3 试验
LUX-Lung3(NTC00949650)是一项在世界范围内133 个中心进行的随机开放,与化疗药培美曲塞联合西司他丁对照的Ⅲ期临床试验。基于该关键性临床试验,FDA 批准阿法替尼用于一线治疗转移性、具有EGFR19 位外显子缺失或21 位外显子L858R 突变的非小细胞肺癌。入组患者是经过therascreen® EGFRRGQ PCR 测试筛选的EGFR 突变阳性,且未经化疗或EGFR-TKI 治疗的Ⅲb 或Ⅳ期肺腺癌患者。此试验共入组345 人,随机分配到阿法替尼40 mg 组和培美曲塞联合西司他丁组。主要终点指标是PFS,次要终点指标是客观响应率、OS、副反应事件、药物代谢动力学(PK)和患者报告结局(patient reported outcome,PRO)。结果显示,与化疗组相比,阿法替尼组PFS 显著延长(阿法替尼19 位外显子和21 位外显子突变组13.6 vs 6.9个月)。另外,阿法替尼组PRO 显著改善,主要表现在肺癌相关症状缓解,如咳嗽和呼吸困难等。后续对LUX-Lung3 试验中携带EGFR19 位外显子缺失突变的日本患者进行的亚组分析发现,阿法替尼组的OS 显著长于该亚组中的化疗组。此外,阿法替尼对于携带不常见EGFR 突变(如L861Q、G719X、S768I)的患者也有疗效。
2.4LUX-Lung 4 试验
LUX-Lung4(NTC00711594)是一个在日本开展的随机开放单臂Ⅱ期临床试验,入组的受试者为既往经过至少12 周厄洛替尼或吉非替尼治疗的ⅢB 或Ⅳ期肺腺癌患者,入组时不要求进行EGFR 检测。62例受试者入组后接受阿法替尼的治疗剂量为50 mg · d-1。主要终点是ORR(部分缓解(partial response,PR)和完全缓解(complete response,CR)),次要终点包括PFS、OS和安全性。62 例患者中45 例为EGFR突变阳性,51 例(82. 3%)对厄洛替尼和(或)吉非替尼耐药。61 例可评估的患者中位PFS 为4. 4 个月,中位OS 为19.0 个月,5 例部分缓解,35 例疾病稳定期达6 周及以上,ORR 为65. 6%。试验中有2 例患者携带T790M 突变(分别是EGFR 存在L858R/T790M 突变和19 位外显子缺失/T790M 突变),其疾病稳定期分别为9 和1 个月,这一结果表明阿法替尼对经过三线或四线治疗失败且是吉非替尼和厄洛替尼获得性耐药的肺癌患者表现出中等的疗效。
2.5LUX-Lung 5 试验
LUX-Lung 5(NTC01085136)是一项在23 个国家共115 个研究中心进行的随机开放的Ⅲ期临床试验,入组的受试者为至少经过一线治疗复发,且既往经过厄洛替尼或吉非替尼治疗至少12 周以上的肺癌患者,入组前不要求EGFR 筛选。此试验分为A、B 两部分,A 部分接受阿法替尼 50 mg · d-1 的治疗;B 部分为阿法替尼加紫杉醇联合治疗(40 mg · d-1;每周80 mg · m-2),并与临床医生选择的一种化疗方案对照。1 154 例受试者中有90 人是肺鳞癌,在阿法替尼治疗至少12 周进展后的202 例患者进入到B 试验部分,随机按照2:1 比例分配到阿法替尼联合紫杉醇组(n=134)和医生选择的一种单药化疗治疗组(n=68)。结果显示,阿法替尼联合紫杉醇组的PFS 和ORR 显著高于单药化疗组,PFS(5.6 vs 2.8 个月,(HR) 0.60, P=0.003)和ORR(32.1%vs 13.2%, P=0.005)显著改善,但两组OS 没有差异。阿法替尼联合紫杉醇组和单药化疗组中位的治疗周期分别是为133 和51 d;分别有48.5% 和30% 的患者出现药物相关的3/4 级不良反应。该试验是一个前瞻性的试验,表明在EGFR-TKI 治疗进展后用阿法替尼联合紫杉醇的疗效好于单药化疗方案的疗效。
2.6LUX-Lung 6 试验
LUX-Lung6(NTC01121393)是一项在中国、泰国和韩国共36 个中心进行的随机开放的Ⅲ期临床试验,入组的受试者是EGFR 突变阳性且未经过治疗的ⅢB 或Ⅳ期肺癌患者。患者经过实验室验证的试剂盒检测EGFR 突变信息,成功入组364 例患者,按照2:1 比例随机分为阿法替尼组(n=242,40 mg · d-1)以及吉西他滨联合顺铂组(n=122,每3 周为1 个周期,第1 天静脉注射顺铂,剂量为75 mg · m-2,第1 天和第8 天静脉注射吉西他滨,剂量为1 000 mg · m-2)。结果显示阿法替尼组患者的中位PFS 明显长于吉西他滨联合顺铂组(11 vs 5.6 个月)。阿法替尼组和吉西他滨联合顺铂组治疗相关的严重不良反应(serious adverse reaction,SAE)发生率分别为6.3% 和8%。综合LUX-Lung3 和LUX-Lung6 试验结果显示阿法替尼组OS 与对照组相比并未改善,但亚组分析表明EGFR19 位外显子缺失突变患者的OS 显著改善:在LUX-Lung 3 试验中,阿法替尼治疗组和化疗组中EGFR19 位外显子缺失突变患者的中位OS 分别为33.3 和21.1 个月;在LUXLung6 试验中,阿法替尼治疗组和化疗组中EGFR 19位外显子缺失突变患者的中位OS 分别为31.4 和18.4个月。除了LUX-Lung6 试验是包括了中国人的临床研究,文献还披露了一项在中国香港开展的临床试验(NCT02625168),将阿法替尼作为三线或四线药物治疗EGFR 突变且转移的,既往经过一线EGFR 抑制剂治疗或系统的化疗治疗至少6 个月的非小细胞肺癌患者。该试验入组和排除标准与LUX-Lung1 试验相同,结果显示,阿法替尼对亚洲EGFR 突变阳性的非小细胞肺癌患者的治疗效果优于厄洛替尼(ORR(20%vs 7%),DCR(68.0% vs 39.3%),中位PFS(4.1 vs 3.3个月)),为其在亚洲的注册提供了支持,2016 年4 月24 日阿法替尼在中国基于其临床上优异的疗效也获得了优先审批。此外,在日本开展的单臂LUX-Lung4 试验也是阿法替尼对亚洲人群的肺癌临床研究之一,其在2014 年获得日本厚生省批准治疗复发的不能进行手术的非小细胞肺癌。
2.7LUX-Lung 7 试验
LUX-Lung 7(NTC01466660)是一项在13 个国家64 个中心进行的随机开放的ⅡB 期临床试验,入组的患者是未经过治疗的EGFR 突变阳性(19 位外显子缺失或21 位外显子L858R 突变)的ⅢB 或Ⅳ期非小细胞肺癌患者,患者入组前经过中心实验室或当地检测肿瘤组织的EGFR 突变筛查,入组的319 人按照1:1比例随机分配到阿法替尼组(40 mg · d-1)和吉非替尼组(250 mg · d-1)。结果显示,阿法替尼组和吉非替尼组PFS 分别为11.9 和10.9 个月,治疗失败时间(timetofailure,TTF)分别为13.7 和11.5 个月。LUX-Lung7试验是在LUX-Lung3和LUX-Lung6试验的基础上进一步研究与第1 代EGFRTKI 一线治疗EGFR 突变阳性患者疗效的差异,试验结果在PFS 和TTF 方面也表现出了优于第1 代EGFRTKI 的特性。
2.8 LUX-Lung 8 试验
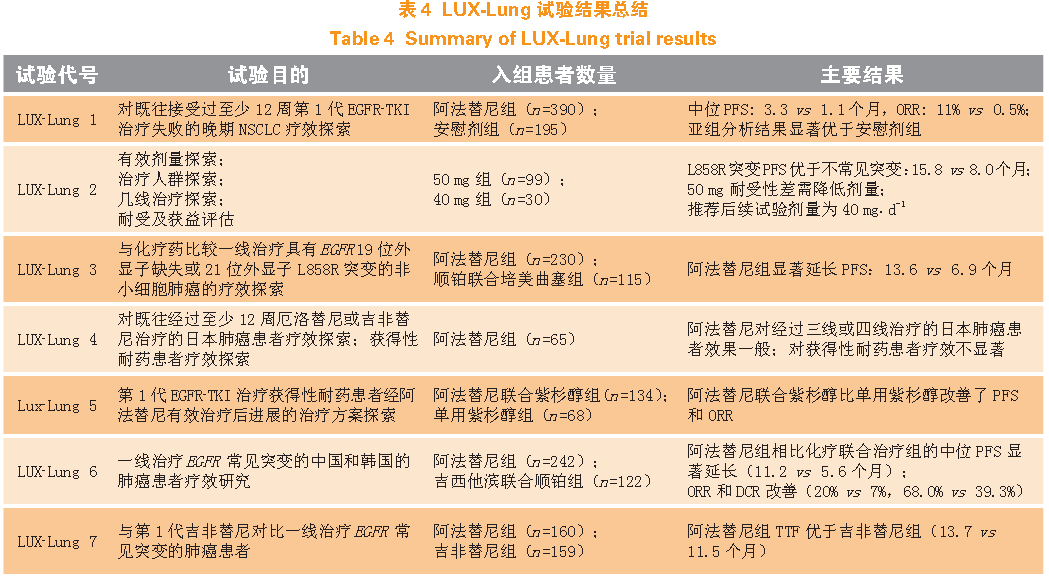
LUX-Lung8(NTC01523587)是一项在23 个国家183 个中心进行的随机开放的Ⅲ期临床试验,入组的患者是经过至少4 个周期以顺铂为基础化疗一线治疗失败的晚期肺鳞癌患者,试验不需进行EGFR 突变检测。共入组795 例患者,按照1:1 比例随机分配到阿法替尼组(n=398,40 mg· d-1)和厄洛替尼组(n=397,150 mg· d-1)。主要终点是PFS,次要终点包括OS、ORR、DCR。结果显示,与厄洛替尼组相比,阿法替尼组的中位PFS、OS、ORR 及DCR 均有改善(2.6 vs 1.9个月,P=0. 010;7.9 vs 6.8 个月,P=0.008 ;5.5% vs 2.8%,P=0.002;50.5% vs 39.5%,P=0.002)。在安全性方面,阿法替尼和厄洛替尼组3 级及以上不良反应发生率分别为57.1% 及57.5%;阿法替尼组3 级以上腹泻和3 级口腔炎发生率均高于厄洛替尼组(10.4% vs 2.6%;4.1%vs 0.0%);阿法替尼组3 级皮疹/ 痤疮的发生率则低于厄洛替尼组(5.9% vs 10.4%)。此外,阿法替尼生活质量改善更明显(35.7% vs 28.3%,P=0.041)。这些结果表明阿法替尼作为肺鳞癌的二线治疗方案,与厄洛替尼比较能改善肺鳞癌患者PFS、OS 及DCR,其安全性也在可控范围内。LUX-Lung8是支持阿法替尼在美国上市用于肺鳞癌治疗的关键性试验,其于2016 年4 月获得FDA 批准,此适应证在欧盟正处于注册阶段。与对照组厄洛替尼(2005 年FDA 批准的二线治疗肺鳞癌)相比,阿法替尼组获得了比较让人满意的结果,为一线治疗失败的肺鳞癌患者提供了一项治疗方案。上述8 个临床试验目的、试验人数以及试验的主要结果总结见表4。

3 讨论分析
阿法替尼的临床试验设计随着试验的开展不断优化,尤其是治疗非小细胞肺癌的LUX-Lung1、LUXLung2、LUX-Lung3 试验表现最为突出,LUX-Lung3在前2 个试验的基础上设计并开展,使得试验结果最终支持上市申请。上市后阿法替尼还通过LUX-Lung6 试验探索了不同地域如中国以及韩国一线治疗EGFR 常见突变的疗效,结果令人满意。申办者并未满足一线治疗的疗效,进一步设计LUX-Lung7 试验,直接与第1 代EGFR-TKI 进行对比,试验结果体现出阿法替尼在一线治疗非小细胞肺癌上优于第1 代EGFR-TKI 的优势。LUX-Lung4、LUX-Lung5、LUX-Lung7 试验主要针对第1 代EGFR-TKI 或化疗治疗耐药的非小细胞肺癌人群的疗效研究,在获得性耐药方面,阿法替尼单用效果不佳,但可与紫杉醇联合克服耐药。
LUX-Lung8试验是针对二线治疗肺鳞癌患者的疗效研究,结果显示优于第1 代EGFR-TKI 厄洛替尼的疗效。我们从中学习到的临床试验设计思路包括如下5个方面。
3.1 终点指标优化
对于终点指标的设计方面,申办者随着试验进行不断优化主要终点指标以及次要终点指标。在LUXLung1试验中,主要终点指标设为OS,次要终点指标为PFS,但试验结果显示OS 作为终点指标未能达到,所以申办者在后续的LUX-Lung 试验调整了主要终点指标为ORR 或PFS,和(或)DCR。另外,次要终点指标也不断优化,增加改善生活相关的指标如PRO 或HRQoL。
3.2 入组患者基因突变的筛选
对于患者的甄选也是经过试验逐渐清晰的,主要是是否经过EGFR 突变筛查和既往治疗情况。LUXLung1试验虽未对患者的突变类型进行筛选,但选择既往厄洛替尼和吉非替尼治疗超过12 周的患者入组,这种方式也是间接筛选获得靶点直接相关的患者。在LUX-Lung1 试验结果显示出EGFR 突变阳性的患者受益的情况下,LUX-Lung2 试验设计入组前需对患者进行EGFR 突变筛选,且LUX-Lung2 方案修改为入组EGFR 突变且从未经过化疗治疗的患者。经过LUXLung1及LUX-Lung2 试验证实阿法替尼对于EGFR 突变的且既往未经化疗或TKI 治疗的肺癌患者最为有效,故确定了LUX-Lung3 试验的设计。辉瑞在研同类产品dacomitinib Ⅲ期临床的失败也同样反映出阿法替尼对于患者入组进行EGFR 突变筛查的明智之举。
3.3 剂量设计
试验中阿法替尼组剂量的设计也值得借鉴,早期临床剂量并不是固定剂量,LUX- Lung1 试验中起始剂量为50 mg,可以根据不良反应调整,以10 mg 为间隔逐级递减,最低不能低于30 mg 的剂量。在LUX-Lung2试验中进一步比较了40 mg 和50 mg 的获益和风险,最终推荐Ⅲ期临床的有效剂量为40 mg。
3.4 多重试验目的设计
早期临床研究融入尽量多的研究目的,LUX-Lung2试验除了对比剂量,也对将阿法替尼的临床应用定位为一线治疗还是二线治疗进行了对比研究,以及对第1代耐药及脑转移患者进行了初步探索,试验结果证实阿法替尼对EGFR 突变阳性尤其是常规突变患者的一线治疗的疗效最佳,这为关键性LUX-Lung3 试验的设计奠定了非常充分的基础。类似这种同一个试验回答不同的问题的设计还有LUX-Lung5 试验。该试验分为两部分,首先接受阿法替尼的治疗,再对阿法替尼治疗超过12 周后疾病进展的患者进行了阿法替尼和紫杉醇的联合治疗,结果也是提示阿法替尼治疗耐药后阿法替尼联合紫杉醇为一种可选的治疗方案。
3.5 临床治疗地位的确定
在LUX-Lung1 试验中,阿法替尼作为三线或四线治疗,在整体分析未发现OS 改善情况下,亚组分析发现EGFR 突变患者相比安慰剂组具有更多的临床获益,在此前提下,设计LUX-Lung2 和LUX-Lung3试验,专门针对发现的敏感突变人群进行一线治疗的探索,试验结果支持了阿法替尼针对EGFR 敏感突变人群的治疗地位。在阿法替尼上市后,又通过LUXLung6试验中与化疗药物对照,以及LUX-Lung7 试验中与吉非替尼的对照更加明确了阿法替尼一线治疗NSCLC 的地位。在LUX-Lung8 试验中,比较了阿法替尼与厄洛替尼在肺鳞癌患者中二线治疗的疗效,结果显示阿法替尼具有更好的临床改善,支持作为肺鳞癌的二线治疗方案。
4 展望
一系列的LUX-Lung 试验让研究者和患者进一步了解到不可逆pan-her 酪氨酸激酶抑制剂在精准一线治疗非小细胞肺癌、二线治疗肺鳞癌方面的优异表现,表明第2 代EGFR-TKI 并不是人们所认为的治疗人群类似于第1 代EGFR-TKI 但又不具备第3 代能克服EGFRT790M 耐药的尴尬地位。其一线治疗非小细胞肺癌的疗效优于第1 代EGFR-TKI,也可通过联合紫杉醇治疗获得性耐药人群,同时也具有第3 代未能涵盖的治疗肺鳞癌的应用优势。目前阿法替尼仍有头颈鳞癌、食管癌等很多方面的临床研究在进行,期待更多更令人惊喜的数据披露。
●感谢您阅读《药学进展》微信平台原创好文,也欢迎各位读者转载、引用。本文选自《药学进展》2017年第4期。
●《药学进展》是一本专注于医药领域前沿动态的专业媒体,月刊,铜版纸全彩印刷,全年360元,欢迎订阅!编辑部官网:www.cpupps.cn;电话:025-83271227。
● 由《药学进展》编委会主办的“第三届药学前沿高峰论坛”将于6月26日-28日在上海张江长荣桂冠酒店召开,诚挚相邀!



通讯地址:南京市童家巷24号(中国药科大学)《药学进展》编辑部
邮编:210009
联系电话:025-83271227
联系人: