钾(potassium)高度集中在所有细胞中,是细胞膨压(turgor pressure)的主要决定因素。钾太多胞外水涌入,细胞破裂;太少胞内水份流失,细胞皱缩。这种渗透原理也适用于腌制肉类、水果和蔬菜的食品保存。
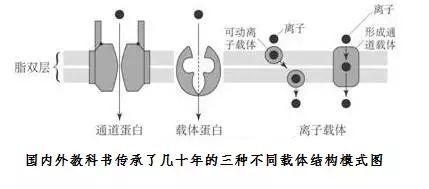
由于钾不可直接透过细胞膜,生物便进化出钾转运器介导钾吸收。在单细胞生物(unicellular organisms)中,细胞内钾水平维持机制极度敏感,因为自然环境波动挑战无处不在。正常情况,钾离子通道(potassium channels)利用电化学梯度驱动钾的输入通量。环境含钾很少,电位无法维持输入通量时,细胞通过钾离子泵系统快速接管钾主动吸收驱动职责。
然而,钾离子泵系统的机制和结构尚未完全阐明。从序列分析来看,似乎内部有元件同时具备钾通道和经典钠钾泵双功能。这让研究人员困惑了几十年,许多人甚至怀疑这些以功能为单位的复合物是否存在。
争论的根源在于生物学教材代代相传的“通道(channels)”和“泵(pumps)”的概念:根据电化学梯度,离子通道介导快速和被动“下坡”运输,离子泵介导缓慢和主动“爬坡”运输。两个过程已经被研究得很透彻了,通常被认为是完全不同的分离并置实体。
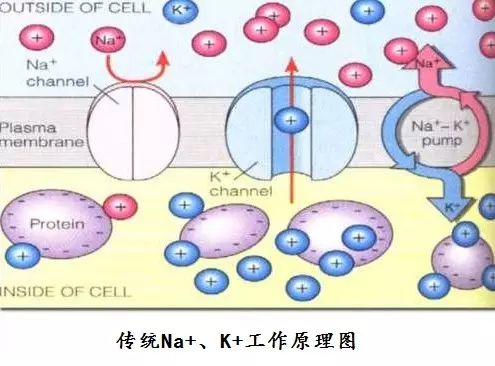
本篇Nature文章结果对这种长期存在的理论给出了致命一击,并解决了通道和泵如何在复杂环境中协同工作的历史难题。
来自Aarhus大学和纽约大学的研究人员首次在膜上观察到了钾转运结构(被称为KdpFABC),通道和泵超家族成员聚集组成一个大复合体,共同行使主动运输。一个“泵样”亚单位(KdpB)制造能力输入;一个“通道样”亚单位(KdpA)的功能被重新定义为主动运输执行者,对抗1万倍离子梯度将钾转运至胞内。
“整个事件最精彩的部分是,它打破了一个我们习以为常的概念,”助理教授Bjørn Panyella
Pedersen说。“这又是一个经典例子,大自然并不喜欢我们试图去理解它并对它进行分类,它的态度是如果朝这个方向进化能有作用,它就会这么干。”
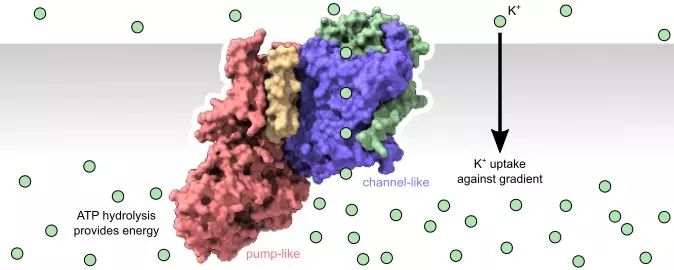
事实上,大多数离子通道有一个到多个闸门,每个都是生理功能的重要组成部分。离子泵的工作机制也与之类似。在新视野下,我们意外地看到通道样亚基闸门与泵样亚基相连互作,控制整个通道的开开合合。这种操作造成闸门开/关、底物识别和能量消耗之间的强烈耦合。只有复合体内所有元件组合起来才能正常工作。
原文标题
Crystal structure of the potassium-importing KdpFABC membrane complex





