
光遗传学的发展历程和最新进展
光遗传学(optogenetics)是一门2005年才诞生的生物工程技术,目前正在迅速发展,它整合了光学、软件控制、基因操作技术、电生理等多种学科。当年斯坦福大学Karl Deisseroth实验室通过在神经细胞中表达光敏蛋白,响应不同波长的光刺激实现对神经功能的调控,宣布人类正式拥有了精准操控大脑的工具。这是一项令人激动的技术。长久以来,我们对神经元之间作用的相互理解仅仅停留在相关性上,有了光遗传学,我们现在终于有能力探究特定的神经回路和大脑功能之间的因果关系。而且这项技术微创、精准,作为神经科学研究工具来说,无疑是个跨越式的进步。最近光遗传学又有了新的突破。
11月13日的《自然神经科学》上,麻省理工学院和巴黎笛卡尔大学研究者公布了一项研究成果,他们通过结合新型光敏蛋白soCoChR与双光子计算机生成全息技术(CGH),成功提高了现有光遗传学技术的精确度,实现了对单个神经元的光敏操作,并将响应时间压缩至1毫秒内——这已经和真正的神经元活动相差无几。下面我们跟随科学家们的脚步一起踏上这奇幻之旅:
光遗传学被杂志评选为“2010年度最受关注科技成果技术”之一,同年《科学》杂志也在十年技术回顾中着重强调了这项进展。Nature Methods杂志在十周年之际推出了纪念特刊,点评了在过去十年中对生物学研究影响最深的十大技术,其中就包括光遗传学技术。2015年,《自然神经科学》为纪念光遗传学十周年特地撰文,直言“光遗传学打开了通往梦寐以求的实验的大门”。有科学家预言,“光遗传学注定会获得诺贝尔奖”。
而这项最新研究,在原有的基础上改造了光敏蛋白,减少了对周围神经细胞的干扰,并利用最新的显微技术,使光刺激的范围更加精准、有效的光照时间更短,实现了与真实神经活动相似的刺激,将光遗传学技术带到了一个新的高度。这意味着,我们将要能够随心所欲地操纵独立的神经元,探索它们彼此相互作用的机制,我们将要揭开人体最神秘器官——大脑的最后一层面纱。
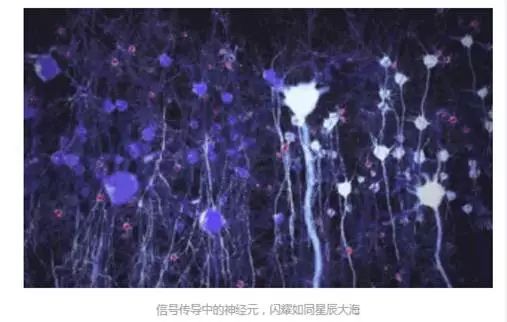
人类一直没有停止对大脑的探索。这个人体最为复杂的器官,拥有上百亿个细胞,它们之间的连接构成了巨大的网络。在这张网里,时刻传递着海量的信息,构成我们的思考、言语和行动。如此庞大的信息流,我们用尽手段得以窥探的不过寥寥,又如何能够代表整个大脑呢?
科学家响应了上帝的旨意——神说,要有光。
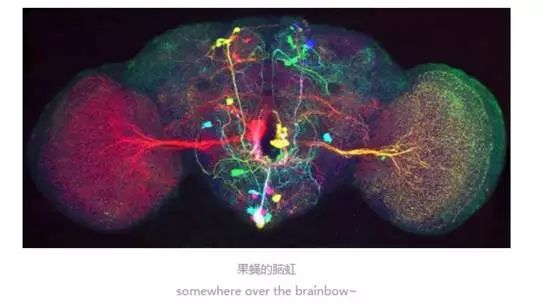
1962年,下村脩从一种水母中发现了荧光蛋白(GFP),正式开启了生物发光研究的大门。2008年,诺贝尔化学奖颁给了绿色荧光蛋白,由下村脩、Martin Chalfie以及美籍华裔科学家钱永健共同受奖。荧光蛋白带来的最典型、也最绚烂的研究莫过于脑虹(Braibow)。2007年,Joshua R. Sanes 和Jeff W. Lichtman主持的一项研究将红黄蓝三种颜色的荧光色素嵌入老鼠基因组,成功为老鼠的不同细胞涂上不同颜色。三种颜色相互组合,最终展现在显微镜下的老鼠脑干组织切片上有近百种颜色标记,如同一道绚烂的彩虹。
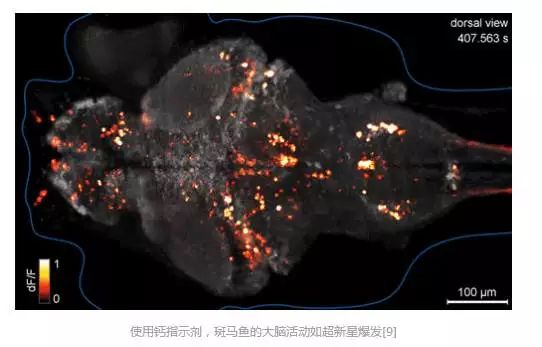
这让我们清楚看到了大脑内不同细胞交织在一起的绝妙画面,也带来了更深一层的问题——这些细胞之间,是怎么互相作用的呢?在单个神经元细胞中,信息以电信号的形式传播。随着信号传导,细胞膜内外电位逆转,随之而来的还有大量钙离子内流。传统方法是用电极测量神经细胞上的电位变化,但这种方法缺陷十分明显,毕竟需要的器材多、能够观察的范围有限。有了荧光蛋白,科学家找到了解决的方法。在荧光蛋白上连接能够感应电压或者钙离子浓度变化的蛋白,那么在神经元参加大脑活动的时候,它就会发出耀眼的闪光。
在经典的生物学实验中,控制神经细胞需要一些比较粗暴的手段,电刺激、切脑区、或者是加一些化学物质。费时费力不说,达到的实验效果也并不是那么尽如人意。长久以来,神经学家们一直梦想着,能够以精确的时空精度控制神经元活动。这个梦想被光遗传学(optogenetic)实现了。光遗传学的灵感实际上来自我们的视觉。人眼中有重重的感光细胞,外界的光线进入我们的眼睛,在视网膜后转变为化学信号和电信号,通过神经元的传输进入大脑。那我们是不是也可以通过光来给神经元下命令,操控它们的活动呢?
2002年,斯隆凯特琳癌症研究中心的Gero Miesenböck教授率先尝试了这个大胆的想法,他把来自无脊椎动物的感光蛋白表达在大鼠细胞上,并在培养皿中看到了神经元响应光刺激!2005年,他成功实现了利用光控制无头的果蝇扇动翅膀!Gero Miesenböck本人也被称为光遗传学的奠基人。而2003年,单个光敏通道蛋白(channelrhodopsin)ChR1和ChR2的发现,促使顶级科学家们开始尝试在哺乳动物细胞中表达光敏蛋白。ChR1和ChR2是一种光控的离子通道,能够响应光刺激进行胞内外离子转运,实现类似神经元活动的电位变化,还能够连接荧光蛋白使刺激过程可视化。最终斯坦福大学Karl Deisseroth实验室获得了科研竞速的胜利,论文登上《自然神经科学》。论文的一作是Edward S Boyden,二作则是我们颇为熟悉的CRISPR小王子张锋。
自此,光遗传学的时代来临了。

在2005年8月至2006年4月的残酷竞争中,共有四家实验室发表了相关成果,其中美国韦恩州立大学的潘卓华实验室所做的工作最为全面,从体外细胞表达到小鼠视网膜细胞中表达再到电生理记录,一应俱全。
据潘卓华介绍,实际上在2004年底,他们就已经完成了相关工作,可是由于各种原因,直到2006年4月,文章才得以在《神经元》杂志上发表。
2005年5月,潘卓华带着他的研究成果到佛罗里达州的罗德岱堡参加视觉和眼科学研究协会(Association for Research in Vision and Opthamology)的会议,在那里进行了一场仅有短短15分钟的演讲。几个月之后,Deisseroth实验室成果发表,全美为之震动。相比美国学者获得的高额经费与媒体的热捧,之后的十年间潘卓华获得的资助却仅仅够维持研究。如今,潘卓华老师依旧在从事光遗传学研究,他说:“我的实验室很小,我们想让更多人重获光明。”
相比起传统的研究方法,光遗传学确实有着无可比拟的优点。它只需要向细胞内转入一个蛋白,实际操作性高;以光作为刺激媒介,具有高时效性;对实验动物的创伤远远小于传统方法,且没有异物侵入组织;可以用定位的光纤来局部刺激细胞,也可以设计弥散光大范围刺激脑区。不过,光遗传学仍旧还有改进的空间。大脑中的神经细胞种类可能远远超出我们的想象,即使两个相邻的同类型细胞,或许也会有完全不同的功能,仅仅对单个的神经元进行刺激,就可能改变大脑的状态和行为。
以当年的技术来说,一方面神经细胞的轴突、树突互相交联,光敏蛋白的响应信号很容易就干扰到周边的神经细胞;另一方面,光技术也没有达到某一个细胞的精度。为了实现对单细胞的光刺激,研究者借助了两个新工具:更灵敏、定点更准确的光敏通道蛋白,和优化的全息双光子显微镜。Boyden博士想到了用基因工程改造光敏通道蛋白。2014年,Boyden博士团队发现了一种新的光敏通道蛋白CoChR,它对光更敏感、产生的电流更强,大概是第一代光敏通道蛋白ChR2的十倍。在CoChR的基础上,Boyden博士给它添加了一个红藻氨酸受体(kainate recepter)KA2的残基。经过改造之后,新的光敏通道蛋白soCoChR可以集中在神经细胞的细胞体中,避免了轴突和树突对周边神经细胞的干扰。实际光刺激后可见对比CoChR(上),soCoChR(下)对周边神经元细胞几乎毫无影响。
解决了干扰的问题,巴黎笛卡尔大学的Valentina Emiliani教授提供了最新的激光技术,双光子计算机生成全息技术(two-photon CGH),达到了对时间和空间的精准控制,能够在照亮细胞的同时将照明时间最小化,将响应时间降低到毫秒级。同时这种技术还支持3D成像,奠定了生成复杂模型的基础。Boyden教授说,使用这种单细胞光遗传技术,研究者可以精确刺激指定神经元,观察与其相连的细胞的反应;又或者,我们可以刺激彼此相邻的几个神经元,看看它们是由哪一个主导,还是共同接受其他神经元的控制。这将会帮助人们理解思考、感觉和运动是如何发生的。
其实光遗传学的潜力还不仅仅限于作为神经学研究的工具。正如《自然神经科学》评论文章中说道的那样,光遗传学无论是在神经科学领域内、还是其他领域都得到了广泛的应用。
近十年来,临床医疗研究者也在尝试利用非入侵性的光遗传学手段来治疗各种疾病,例如嗜睡、抑郁症、恐惧、焦虑、疼痛和帕金森。比如:恢复记忆,治疗阿尔茨海默、失明和糖尿病。光敏通道蛋白本身的结构也给了研究者灵感。虽然名为通道,但ChR2却没有典型通道的结构,它在细胞膜上反复穿越7次,更像一个G蛋白偶联受体。由此研究者脑洞大开,是不是可以通过工程改造,把原本不受光影响的蛋白改造为光敏蛋白呢?当我们想得更远,为什么光遗传学的光控受体一定要是蛋白,不能是DNA或者RNA吗?可以用其他的介质来控制细胞吗?面对科学,前路漫漫,吾等将上下而求索。
(来源:
每日生物评论 2017年11月29日
)
Science:光遗传学之父Deisseroth再发突破性成果
2005 年,斯坦福科学家 Karl Deisseroth 发明了光遗传学技术,他在细菌视蛋白的帮助下用光控制了大脑细胞的开/关。自那以后,世界各地的研究者们用这一技术对多种受电信号调节的细胞进行了研究,例如神经细胞、心脏细胞、干细胞等等。这里的电信号是指离子的跨膜流动。
光遗传学技术是在动物模型中深入理解生物系统的有力工具。但第一代光遗传学技术并不完美:兴奋性的光敏蛋白很有效,但抑制性视蛋白的效率很低。
现在, Deisseroth 的研究团队经过多年努力,
重新设计了一种抑制性的光敏蛋白,大大提高了抑制性开关的工作效率。
这将帮助研究者们更好的理解与行为、思维、情绪有关的大脑回路。相关研究论文刊登在了近期出版的《科学》(Science)杂志上。
光遗传学技术允许科学家们将发射激光的光纤插入动物大脑,这种激光脉冲会使视蛋白传输兴奋性的阳离子流或者抑制性的阴离子流,进而高度精确的控制细胞行为。
随着光遗传学技术的广泛使用,人们慢慢发现刺激性电信号比抑制性电信号有效得多。为此,论文资深作者 Deisseroth 教授对只传送阳离子的兴奋性视蛋白行了深入研究,解析了它们的作用机制,希望在此基础上开发新的抑制性开关。
从理论上看,兴奋性视蛋白的作用机制很简单。光脉冲会使视蛋白打开细胞膜上的通道,随后阳离子流入细胞。2008 年 Deisseroth 及其同事构建了改良版的兴奋性视蛋白,称为 step-function 视蛋白。只需要一个光脉冲,就可以打开这种蛋白并使通道保持开启状态。此时,阳离子能够持续流入,即使关掉光脉冲细胞也可以保持兴奋状态。而且持续性的离子流也让细胞对光刺激更为敏感。这些特性允许人们简单激活动物大脑深处的神经元,不需要穿透组织的光纤。
与此相反的是,抑制性视蛋白并不是通道而是“泵”,进来一个光子就跨膜移动一个离子。这样的作用机制效率非常低,而且人们也无法让抑制性视蛋白持续开启,因此需要更多的光脉冲来进行实验。这些抑制性的蛋白泵,与大脑细胞的正常抑制机制不同。大脑的正常抑制机制是使神经元变得更通透,对兴奋性电流更有抗性。以上因素决定了,视蛋白泵无法成为有效的抑制开关。
2012 年, Deisseroth 的研究团队在《自然》(Nature)上发表文章,完成了他们改善光遗传学抑制的第一步。研究人员揭示了兴奋性开关的具体结构,发现其通道内壁的氨基酸会形成负电荷,吸引阳离子流入。他们在此基础上找到了构建抑制性通道的新策略:对兴奋性视蛋白进行改造,使其内壁充满正电荷氨基酸,吸引阴离子流入细胞。研究人员完成了这一改造用了两年时间。
兴奋性视蛋白大约由三百个氨基酸组成,研究人员先改变了其中的九个。在光脉冲的刺激下,这种新蛋白会打开内壁充满正电荷的通道,吸引大量阴离子进入,从而有效抑制细胞活性。随后,研究人员改变了第十个氨基酸,使这种阴离子通道保持开启状态。这种抑制性视蛋白通道的光敏性很强,一个蓝色光脉冲就使神经元关闭了好几分钟。此外,这一过程还能够被红光逆转。
Deisseroth 将这种新型视蛋白称为 SwiChR,他认为该蛋白的长效作用和稳定应答,将为光遗传学带来新的机遇。
这种新型视蛋白的优势在于:能够更有效的抑制神经元活性,对光刺激更为敏感,还能够长时间保持开启。“这些性质对于动物行为研究来说特别有用,甚至有望用于治疗一些疾病,例如重症癫痫等,”瑞典 Lund 大学的 Merab Kokaia 教授评论道,“光遗传学的新工具将帮助我们更好的理解大脑的作用机制。”
原文检索:
Andre Berndt, Soo Yeun Lee, Charu Ramakrishnan, and Karl Deisseroth.
Structure-Guided Transformation of Channelrhodopsin into a Light-Activated Chloride Channel
. Science, 25 April 2014; DOI:
10.1126/science.1252367
设想一下:德国穆勒的射门技术如何更上层楼?光遗传学技术是否可以帮得上忙?
Science:光遗传学技术迈向临床研究
光遗传学诞生后的头十年,大大推动了人们对正常和病理性神经回路的理解。今后的十年,光遗传学将迎来与转化医学的联姻,为疾病治疗带来新的机遇。
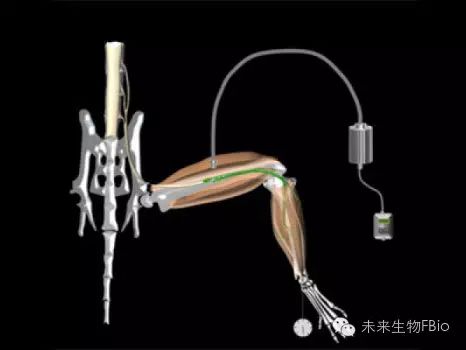
日前,来自伦敦大学学院(University College London)与伦敦国王学院(King's College London)的研究人员像人们展示了这样一个范例,他们将光遗传学工具与再生医学知识结合起来,在周围神经损伤的小鼠模型中恢复了肌肉的功能。相关研究论文刊登在了近期出版的《科学》(Science)杂志上。
光遗传学实验面临的第一个问题是,如何在目的细胞群体中实现视蛋白 opsin 的稳定表达。 研究人员对小鼠的胚胎干细胞进行了基因工程改造,使其稳定表达 ChR2 蛋白, ChR2 是一种对蓝光敏感的阳离子通道。随后他们在体外诱导这些细胞分化,形成具有光遗传学活性的运动神经元。当这些 ChR2 运动神经元受到蓝光照射时,就会被激活。
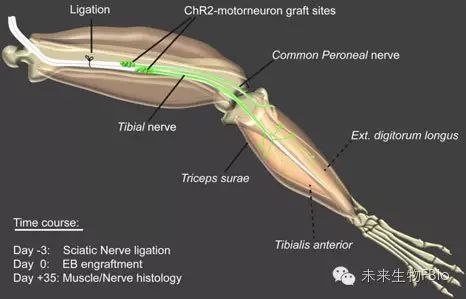
研究人员通过结扎坐骨神经,构建了肌肉失去神经支配的小鼠模型,并将含有 ChR2 运动神经元的拟胚体移植到小鼠体内。他们将这些小鼠麻醉,用蓝光照射移植位点,成功恢复了小鼠腿部肌肉的功能。研究显示,移植的 ChR2 运动神经元能够在小鼠体内生存和成熟,帮助小鼠重新控制腿部肌肉。他们指出,这种光遗传学刺激可以实现运动单位的“有序募集”,与正常的生理活动非常类似。而采用电刺激时,运动单位的募集往往是逆向或随机的。
这项研究开辟了许多新的研究方向,例如可以尝试在非麻醉的小鼠体内实现光激活的肌肉功能恢复。要在自由活动的动物体内进行持续的光遗传学刺激,就需要使用植入性的长期发光装置。

这项最新研究显示, ChR2 运动神经元的终板(endplate)存在一定畸形,这可能是因为移植后的神经元一开始并没有活性。而长期性的植入装置,可以在移植后立刻激活神经元,避免这样的畸形。另外,如何让移植神经元长期存活,也是一个重要的问题。
研究人员描述的这种细胞移植方案也可以用来治疗其他类型的神经学疾病。不过,在成功实现光遗传学治疗之前,人们还需要攻克一些难题。举例来说,人们需要将光遗传学技术从鼠类模型应用到非人类的灵长动物,尤其是大脑以外的神经回路。在病毒载体、细胞移植法等不同递送策略下, opsin 表达的长期安全性也有待评估。此外,人们还需要开发机体能够耐受的植入性发光设备,进一步改善 opsin 蛋白的光敏感性和其他特性。
尽管前方还存在着不少挑战, 这项研究仍旧是光遗传学走向临床的重要一步。
原文检索:
J. Barney Bryson , Carolina Barcellos Machado, Martin Crossley, Danielle Stevenson,Virginie Bros-Facer, Juan Burrone, Linda Greensmith, and Ivo Lieberam.
Optical Control of Muscle Function by Transplantation of Stem Cell–Derived Motor Neurons inMice
. Science, 4 April 2014; DOI:
10.1126/science.1248523
Science:德国科学家优化光遗传学技术
网络化的神经细胞是生物体的控制中心。在线虫中,300 个神经细胞就足以引发复杂的行为。为了更好地了解这些网络的特性,研究人员利用光来开启和关闭细胞,观察生物体随之发生的行为。在发表于《科学》(Science)杂志上的一篇新论文中,科学家们报告称有一种蛋白质可使光控神经细胞变得更为容易。它有可能为神经系统疾病研究奠定基础。
要用光来改变神经细胞,须借助于在细胞膜中形成离子通道的某些蛋白。这些蛋白被称作视紫红质通道蛋白(channelrhodopsin)。如果光线触及这些离子通道,它们会打开,离子进入,致使细胞特异性地激活或失活。通过这种方式,研究人员获得了一种极好的工具来研究神经细胞网络的功能。然而到目前为止,这种技术仍要求大量的光线,且只能改变网络中非常有限的区域。新研究中提及的 ChlocC 视紫红质通道蛋白相比于迄今为止用于关闭神经细胞的其他蛋白质,响应光线的敏感度要增高大约 1 万倍。
卡尔斯鲁厄理工学院(KIT)的 Marcus Elstner 说:“为了改变这一蛋白质,我们在电脑上分析了它的结构。这位理论化学家和他的研究团队构建出了由大约 5000 个原子组成的这一蛋白质的模型。为此,他们利用了卡尔斯鲁厄理工学院 Steinbuch 计算中心的高性能计算机。花费数周时间,连同蛋白质环境,如细胞膜和细胞质,对大约 10 万个原子进行了计算。结果发现这一通道的离子导电性实质上是建立在中心区域的 3 个氨基酸基础之上。通过交换氨基酸,科学家们现在成功地提高了这一离子通道的敏感性。
自2005年以来,科学家们一直利用来自微藻的视紫红质通道蛋白。在神经切片或活体转基因模式生物,如果蝇、斑马鱼或小鼠中,借助这些蛋白人们可以利用光线来特异性激活选择细胞。因此,进一步了解了它们在细胞结构中所起的作用。这种称作为光遗传学(optogenetics)的技术被广泛应用。在过去的数年里,它促使更深入地了解了信号处理相关的生物学。到目前为止绘制出了一些难以触及的神经信号通路,发现了蛋白质、细胞、组织以及神经系统功能之间许多的关联。
在这项新研究中,来自卡尔斯鲁厄理工学院、柏林洪堡大学和汉堡 Thomas Oertner 分子神经生物学中心的研究人员进一步开发了这一离子通道。Jonas Wietek、Nona Adeishvili 与柏林洪堡大学的 Peter Hegemann 研究组展开合作,成功鉴别出了视紫红质通道蛋白的选择性过滤器,对它进行改造导入负电荷氯离子。科学家们将这些氯离子传导通道命名为 ChlocC 。
来自卡尔斯鲁厄理工学院 Marcus Elstner 研究小组的 Hiroshi Watanabe 计算了蛋白质中离子的分布并通过显像证实了氯离子分布增高。来自 Thomas Oertner 分子神经生物学中心 Thomas Oertner 研究小组的 Simon Wiegert 证实,将 ChlocC 导入选择性的神经元中,以非常小的光强度即可导致后者失活,在活体生物中亦是如此。现在这种新型的光遗传学工具ChloC,可与主要传导钠离子和质子的已知光激活阳离子通道一起,用于神经科学中研究神经网络的转换。
这一基础知识或许可帮助更好地了解如癫痫和帕金森病一类疾病的机制。从现在起的未来数年里,这有可能促成一些比当前的治疗药物更具特异性的治疗概念。
原文检索:
Jonas Wietek, J. Simon Wiegert, Nona Adeishvili, Franziska Schneider, Hiroshi Watanabe ,Satoshi P. Tsunoda, Arend Vogt, Marcus Elstner , Thomas G. Oertner , and Peter Hegemann.
Conversion of Channelrhodopsin into a Light-Gated Chloride Channel
. Science, 27 March 2014; DOI:
10.1126/science.1249375
再次强化对这位科学牛人的膜拜!他就是该领域的皇帝!
Nature:发明光遗传学和CLARITY的技术达人

Karl Deisseroth一次又一次地用他发明的新技术在脑科学(brain science)发展史上刻下了自己的大名。
Karl Deisseroth在2004年有了第一个完全属于他的实验室,后来他发现那间实验室的前主人竟然是诺贝尔物理学奖得主朱棣文(Steven Chu)。“我搬进实验室的时候,朱棣文的名字还挂在实验室的门上。”美国加利福尼亚州斯坦福大学(Stanford University in California)的神经科学家Deisseroth回忆说。沾名人的光总是有好处的,后来有一位化学系的学生Feng Zhang拜访朱棣文时,Deisseroth居然用尽花言巧语把他给留了下来,“虽然Zhang没听说过我,可是我让他对我的课题产生了兴趣。” Deisseroth得意地说道。
Deisseroth现在可是科学界的大牛之一了。有两项意义重大的技术都与Deisseroth有关,有了这两项技术,科学家就可以研究大脑中复杂的神经通路(circuit)是如何控制我们的行为的了。据Deisseroth介绍,他之所以开发这两项技术是因为想要认识和了解精神疾病(psychiatric disease)的发病机制,同时也是因为这方面的技术还非常匮乏,他想要填补这方面的空白。“情况非常清楚,如果要在精神疾病研究领域有所进展,我就必须花时间开发出一些新技术。”
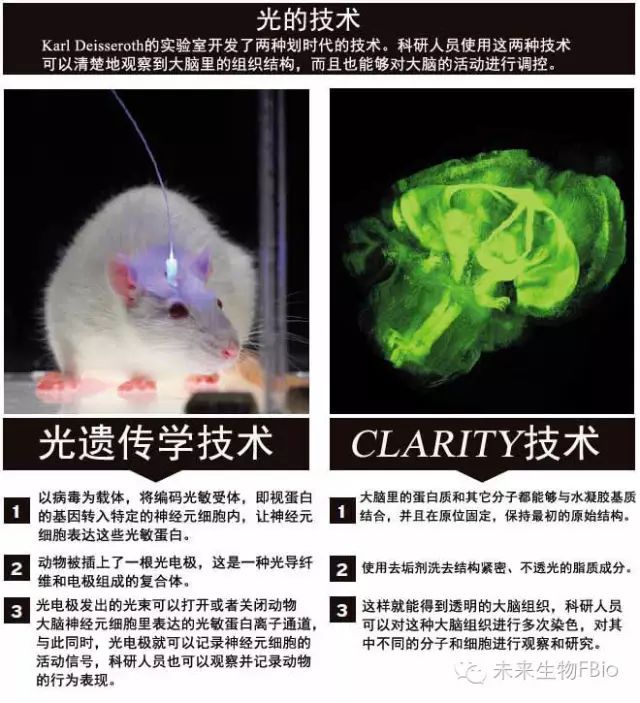
Deisseroth说话缓慢但是很有节奏,为人轻松、闲适,这几乎让我们都忘记了他们实验室开发的技术都是和神经科学相关的。首先让我们来了解一下光遗传学技术(optogenetics)。该技术源自一种藻类(algae)蛋白,这种蛋白对光线非常敏感,将该蛋白插入神经元细胞之后就相当于在神经细胞当中安装了一个开关,科研人员可以通过是否给予光照刺激的方法打开或者关上这个开关,通过这种方式对细胞进行调控。实验室建立不久,Deisseroth就和研究生Zhang,以及当时与他保持密切合作关系的Edward Boyden一起成功地开发出了这种技术。很快,光遗传学技术就得到了全世界科学家的认可,被大家广泛采用,比如应用于对某种特定种类的神经元细胞的功能开展研究,也被应用于对抑郁症或自闭症患者神经通路异常情况的研究等。Deisseroth都数不清有多少课题组在使用他们开发的这项技术了,据他介绍,他们给数以万计的实验室都赠送过克隆。
现在,继发表了与新技术(名为CLARITY)相关的论文之后,Deisseroth的实验室又在全力以赴地为了这项新技术而努力冲刺。该技术通过化学处理方法可以让整个大脑变得“透明”,这样科研人员就可以对大脑的结构进行非常精细的三维立体观察,有助于了解大脑各部结构与各种大脑功能之间的关系,将大脑各个解剖结构与脑功能一一对应、并联系起来。Deisseroth在美国斯坦福大学攻读博士学位期间的导师,神经解剖学家Richard Tsien评价道:“我认为该技术能够让我们更清楚地认识大脑里各解剖结构、神经通路,及其功能之间的关系。”
Deisseroth敢于冒险,他鼓励他的科研团队合作完成同一件工作,他总是喜欢将拥有各个不同专业背景的人聚集在一起,也喜欢将多个不同的研究领域“强扭”在一起。美国华盛顿州西雅图市Allen脑科学研究所(Allen Institute for Brain Science in Seattle, Washington)的首席科学家Christof Koch就认为,Deisseroth的成功正是得益于他这种广泛的兴趣和爱好。但是Deisseroth也有他非常专一的一面,对开发新技术、新工艺有一种非同一般的专注,据他自己介绍,这是出于满足他作为一名精神科医师(psychiatrist)的工作需要。虽然Deisseroth对于他们实验室开发的新技术也感到非常的兴奋,但是对于这些技术,他自己却不能够玩得非常转,所以他也只好无奈地耸耸那副宽肩膀承认他可没法像乔布斯那样做一个好的演示者。
细胞控制
目前在美国纽约大学Langone医学中心(New York University’s Langone Medical Center)工作的Tsien在第一次遇见Deisseroth时就对Deisseroth那种坚定的信念留下了极为深刻的印象,据他回忆,那是一次不同寻常的会面,当时Deisseroth是来斯坦福大学参加面试的,有点害羞,还告诉Tsien他来斯坦福就是想和Tsien一起工作。那还是1993年,当时Tsien的实验室已经有很多人了,可是Deisseroth还是坚持要来,并且最终也说服了Tsien。作为Deisseroth攻读医学博士学位期间的一部分工作,当时Deisseroth在Tsien的实验室里开展的主要工作是研究神经元细胞的钙离子通道(calcium channel)。2000年,Deisseroth博士毕业之后面临了一个选择,一是以博士后的身份去斯坦福大学神经科学家Robert Malenka的实验室里继续这项研究工作,或者是到斯坦福大学医学院做一名精神病科住院医师。
“可是当我开始精神病科住院医师的临床轮转工作之后,我发现一切都和我想象的不一样。我们这儿的病人外表看起来可以非常正常,他站在你面前,你完全看不出他哪里有问题,可是他们的脑子里却是另外一个世界。那时,我才意识到这个问题是多么的难以研究,对我们这些医生来说,大脑里的世界实在是隐藏得太深了。” Deisseroth介绍道。
Deisseroth认为光对着在培养皿里的神经元细胞来研究抑郁症或者是焦虑症是远远不够的,因为大脑只有作为一个整体才会表现出能够指导人类行为的复杂、精细的功能,当然也只有大脑出了问题,才会让我们患上精神疾病。可是当时能够对人体,或者模式动物的全脑进行研究的技术还只能够简单地判断大脑是否在工作。
于是Deisseroth决定开发一种全脑研究、控制技术。他说道:“我和很多人都进行了非常深入的讨论。”在Deisseroth担任住院医师期间,他遇到了和他志同道合的博士生Boyden。他们也讨论了多种控制单个神经元细胞的技术,作为他们的次要工作。“那是一次非常冒险的合作,充满了未知性。” Boyden这样说道。
其中有一个方案就是使用光线来控制神经元细胞的活性。Boyden和Deisseroth均对视蛋白(opsins)这种对光线敏感的离子通道蛋白(light-sensitive channel protein)比较熟悉,这种蛋白有多种功能,其中藻类就是利用这种蛋白来产生能量的。当时包括Tsien的兄弟、美国加州大学圣地亚哥分校(University of California, San Diego)的Roger在内的多个课题组都在研究如何将这种视蛋白插入到神经元细胞的细胞膜上。据Deisseroth介绍,他们当时的问题就是赶紧找到研究生,开始干活。2004年,Deisseroth终于有了他自己的实验室,于是他立马就行动起来了。
在2004年的7月,Deisseroth就成功地让神经元细胞在细胞膜上表达出了视蛋白。Deisseroth实验用的细胞是从Malenka那获得的,试验记录设备是找Richard Tsien借的,就这样,他和Zhang以及Boyden一起进行了试验。Boyden回忆说:“第一次试验的效果就很不错了。当时感觉就像中了大奖一样。”
第二年,Deisseroth获得了美国国立健康研究院(NIH)的资助,这让他后面的科研工作有了保障。在此之前,Deisseroth也碰过很多次壁,因为据美国马里兰州贝塞斯达的美国国立精神卫生研究所(US National Institute for Mental Health in Bethesda, Maryland)的所长Thomas Insel介绍,与原理验证类的研究工作(hypothesis-driven projects)相比,开发新技术这种科研项目一般都很难获得资助。Insel的美国国立精神卫生研究所就是第一个给Deisseroth的光遗传学项目提供美国联邦政府资助的单位。“当时人们还很难理解Deisseroth工作的意义和重要性。” Insel说道。
不过就在2005年Deisseroth发表论文介绍了这项技术之后不久,神经科学家很快也意识到了这项新技术的潜在价值。那也是Deisseroth发表的第一篇比较有份量的文章,介绍了他们在体外培养的细胞上使用视蛋白进行的光遗传学研究成果。有了这项技术,科研人员就可以对某一类神经元细胞进行刺激,看看这些细胞会做出什么样的反应,当然也可以对整个生物体进行刺激,看看它们会如何表现。很快,全世界对这项技术的需求就如潮水般地向Deisseroth涌来。
这项技术被应用到了很多方面,其中就包括对神经干细胞发育问题的研究,以及促使小鼠记起久远的恐惧回忆的研究(Nature 465, 26–28; 2010)等工作。
Deisseroth的课题小组一直都非常关注精神疾病问题,他们使用鼠动物模型研究了大脑中与焦虑情绪(anxiety)有关的神经回路,结果发现了一个神经中枢。该神经中枢能够控制多种不同的临床表现,比如呼吸频率加快、惊恐,以及不舒适等感觉。Deisseroth等人用多巴胺(dopamine)这种神经递质对小鼠的神经元细胞进行了调控试验(激活或者抑制小鼠神经元细胞的活性),以此来观察这些神经元细胞与抑郁症临床表现之间的关系。他们也利用光遗传学技术成功地帮助试验大鼠戒断了对可卡因的“毒瘾”。据Deisseroth介绍,他们取得的这项戒毒工作成果有助于其他科学家开发出比目前在临床上常用药物的成瘾性更低的抗焦虑药物,因为他们发现可以只针对焦虑信号通路进行干预治疗,不需要触及奖励信号通路(reward circuitry)。
2006年,Boyden也在美国麻省理工学院(Massachusetts Institute of Technology in Cambridge)拥有了属于他自己的实验室。当时盛传他和Deisseroth的关系出现了问题,不过他们俩都没有对此发表评论。2007年,这两个实验室也各自发表了与嗜盐菌视紫红质蛋白(halorhodopsin)相关的文章。嗜盐菌视紫红质蛋白是一种具备断开功能的视蛋白,Boyden和Deisseroth之前曾经一起研究过这种蛋白。Zhang介绍说:“在Ed在《自然》(Nature)杂志上发表那篇文章之前,我们一直都不知道他也在从事这方面的研究工作。” Boyden也说道:“大家都知道,在任何一场竞争中,每个人都想做第一。”
这场风波有可能给Deisseroth造成了影响,他现在不再那么容易信任他课题组的成员,以及来他这里接受培训的人员,尤其是事关CLARITY技术的相关事宜。介绍CLARITY技术那篇论文的第一作者Kwanghun Chung介绍说:“关于是谁第一个想到了这个点子的问题,Karl非常敏感。” Deisseroth一直以来都梦想能够看穿大脑,可是最后是Chung发现了这种神奇的化学药物,所以CLARITY技术算是他们俩共同发现的。
看得更清楚
通常我们在研究大脑的精细结构时都会先将大脑组织切成一片片非常薄的脑组织切片,然后在显微镜下对这些切片进行观察,再将不同切片的图像重新重叠在一起,最后得到立体的结构信息,这种方法费时费力,而且还不够精确。为了解决这个问题,Deisseroth一直在寻找一种能够让大脑变得透明的化学手段。我们都知道,神经元细胞里的某些组份,尤其是脂质成份是不透光的,所以如何在保证大脑结构不被破坏的前提下去掉这些不透光的成份就是解决问题的关键。这与光遗传学技术完全不同,所以Deisseroth找到了拥有化学工程学背景的Chung,这也再一次体现出了Deisseroth勇于冒险的特质,他说道:“我还记得,当时大家都想不透我为什么要招Chung,不知道我要干什么,不知道我们实验室要干什么,因为化学和我们之前开展的遗传学研究是完全不同的两个方向,这简直就是180度的大转弯。”
最开始,Deisseroth想往神经元细胞里注入一种原料,使细胞固定,然后去除细胞外的组织,得到透明的大脑。可后来发现,这种方法很难得到一个稳定的细胞结构,但是可以很容易地得到细胞外结构。
然后他们又尝试了几种细胞骨架材料(scaffolding material),比如角蛋白(keratin)和纤维素样结构(cellulose-like structure),最后才确定了水凝胶(hydrogel)这种材料,水凝胶是一种主要由水构成的凝胶,已经被广泛地应用于生物学研究工作当中。Deisseroth等人发现,水凝胶骨架可以很好地与神经元细胞组份,包括蛋白质、神经递质、DNA、RNA等结合。将细胞结构锁定之后,再用SDS这种去垢剂洗去细胞上的脂质成份,这样就能得到一个透明的脑组织结构(Nature 496, 151; 2013)。
介绍CLARITY技术的文章发表还不到一个礼拜的时间,Deisseroth就接到了几十份咨询邮件。Deisseroth在介绍当时情况的时候这样说道:“我们非常的……,让我想想用什么词来形容比较好,免得你们误会,以为这些信件当时给我们的工作带来了什么麻烦。”最后Deisseroth用了“倾泄而出”这个词来形容当时他们收到的邮件量。
据Insel介绍,CLARITY技术和光遗传学技术一样,也让世人震惊了。Insel说道:“一般人如果在事业刚起步阶段就像Deisseroth那样做出了光遗传学技术这样的成绩,那他们今后肯定就会躺在功劳簿上睡大觉了。可Deisseroth却没有这样,他会继续朝着新的目标前进,所以才又有了CLARITY技术。”
很多研究人员都根据自己的试验需要对CLARITY技术进行了相应的调整和改造。比如美国密苏里州圣路易斯华盛顿大学(Washington University in St. Louis, Missouri)的神经科学家David Van Essen就对大脑里的白质(即神经组织里主要由轴突组成的那个部分)比较感兴趣,他就检测了CLARITY技术对于白质研究的应用潜力。该技术将帮助他们课题组研究大脑不同区域之间的联系模式。
美国马萨诸塞州布兰迪斯大学(Brandeis University in Waltham, Massachusetts)的神经科学家Eve Marder认为,将CLARITY技术和光遗传学等技术联合起来,或者在行为学研究工作中使用CLARITY技术分析行为背后的大脑结构基础,这些研究工作都会为科学家们提供大量有价值的信息,帮助他们了解和认识全脑的功能。但是对全脑这样的大型神经系统进行比较细致的研究还是存在很大难度的。Marder通常也只是对30个左右的神经元细胞组成的简单神经回路开展研究,据她介绍,即便是这么小规模的一个“系统”,细胞之间不同的排列方式都会导致系统可能出现的个数呈指数增长。“对于那些有志于研究更大规模神经系统的科研人员,我个人建议他们应该注意吸取我们这些人的经验和教训。” Marder这样建议道。
CLARITY技术也给临床工作带来了一线曙光。在一篇介绍CLARITY技术的论文中,科研人员用这种方法对一位七岁大的自闭症男孩的脑组织进行了分析。结果发现,在这名患儿大脑皮质部分里的神经元细胞像梯子一样地聚集在一起,可是正常情况下这些细胞应该是形成分支状的结构。在对自闭症动物模型的研究工作中也曾经发现过类似的情况,不过有了CLARITY技术,我们就可以更方便地对人类大脑组织进行观察,发现其中的异常情况。
高风险与高回报
Deisseroth的办公室和他大部分的实验室现在还是在他2004年刚刚在斯坦福大学拥有第一间实验室的那栋大楼里。不过现在他的科研团队已经有35个人了,他也有了好几处实验室。Deisseroth的实验室里放了很多小玩意,就和技术宅的卧室差不多。他的实验室在大楼的最底层,这里没有自然光,不过Deisseroth却无所谓,因为这栋大楼的减震设计做得非常好,这一点对于离不开精细显微镜的Deisseroth来说至关重要。
现在在Deisseroth的科研团队里有计算神经科学家、有医学家、化学家和工程师,汇聚了各个方面的人才。Deisseroth去年还拿到了美国国立健康研究院的转化研究大奖(Transformative Research Award),奖金高达2250万美元,他更加可以毫无顾忌地开展任何研究了。Deisseroth指出,他这里有各种人才,有高风险的研究项目,也有低风险的研究项目,所以他的配置是非常合理的。
在所有高风险的研究项目中有一项就是使用光场显微镜(light-field microscopy)对大脑进行成像。所谓的光场显微镜可以同时从各个角度记录图像。与此同时,Chung和Viviana Gradinaru则尝试在神经元细胞内构建水凝胶结构,他们希望用这种方法保持特定细胞构成的组织结构,或者将某种神经元细胞全都固定住,亦或将所有表达某种基因的细胞全都固定住等。当然,Deisseroth的课题组也没有停止光遗传学方面的工作,还在继续完善这项技术,比如开发新的视蛋白,开发新的光束控制方案等。
Deisseroth已经扩大了他的实验室,以方便前来学习的科研人员。在2010至2012年间,大约有200多人来Deisseroth的实验室学习光遗传学技术和CLARITY技术。据Van Essen介绍,Deisseroth的实验室干的就是自耕农的工作,他们就是要努力推广这些技术。所有的工具都可以免费获得,虽然斯坦福大学已经就某些方面申请了专利,但那是为了保证大家都可以免费使用这些技术。而且Deisseroth也没有从中赚取一分钱。
Deisseroth在进行紧张的科研工作的同时也没有放弃他的另外一份工作——精神科医师。他现在还掌管着一家精神病诊所,每周都会去接诊,他现在的日程表已经排得非常满了,他在尽力平衡各种工作。他依旧认为他的研究工作最终会对临床医学起到不可替代的促进作用。他表示,对于某些精神疾病,他们现在就可以帮助很多患者,可是还有一些精神疾病是他们现在束手无策的。所以还需要继续开展科学研究,解决这些问题。
简单、无拘无束的好奇心支持着Deisseroth在科学的道路上继续前进。“我认为所有的科学家对这个大千世界都有那么一点好奇心。他们不仅想知道这个世界是什么样的,还想知道这个世界为什么是这样的。” Deisseroth这样总结道。
原文检索:
Kerri Smith.
Neuroscience: Method man
. Nature, 30 May 2013; doi:10.1038/497550a
(来源:未来生物FBio)
(本文转自癌图腾)
面对生命,惟有责任




