文章主要讨论了中国仿制药一致性评价中的体外溶出曲线要求,并从药物吸收的角度分析了体内和体外溶出的差别。文章指出,虽然体外溶出曲线要求对于一致性评价有一定作用,但并非所有溶出条件都有意义,重点应考虑药物崩解溶出和吸收的条件。作者认为国家局‘BE等效并且同时四条溶出曲线完全拟合’的要求不科学,可能会限制仿制药的专利突破。
近期,国家局提出了除了BE等效,体外四条溶出曲线也要完全一致的要求。这引起了行业内关于这一要求的合理性和可行性的讨论。
文章从药物吸收的角度分析了体内和体外溶出的差别,指出两者在溶出介质、酸碱度、溶出液体体积、溶出时间、液体动力学、溶出部位以及药物在溶出介质中的含量等方面存在显著差别。
文章强调了只有药物崩解和溶解的PH环境对于药物的吸收有着直接的影响,其他部位的体内环境基本没有影响,这是体外单一溶出介质测试的基础。
作者认为国家局的‘BE等效,并且同时四条溶出曲线完全拟合’的要求不科学,可能会限制仿制药的专利突破。仿制药的突破往往在于释放机理的改变或者辅料或工艺的改变,完全拟合的几率非常小。
中国的仿制药一致性评价开展的如火如荼,个个厂家都在快马加鞭地开展一致性评价的研发工作。近期,国家局的关于“除了BE等效,体外四条溶出曲线也要完全一致”的要求引起了广泛的讨论。在早期,网络还流传者体外溶出曲线拟合是对于仿制药创造力的扼杀的文章。对于这两种观点哪一种是正确的,我们应该从口服药物吸收的角度加以理解和考虑。
美国Teva副总裁Tony Tong 博士的评论是“同胞们:你们知道这有多困难吗?有这个标准,很多剂型的专利是不可能绕过的 “6. 体外溶出曲线要纳入到质量标准里,要随时应对检查。即使BE一致,4条溶出曲线也必须一致随时应对检查。即使BE一致,4条溶出曲线也必须一致。“ ” 说出了美国专业人员对于国家局这条政策的客观的认识“。
下面我们从药物吸收的角度对这个话题进行讨论:
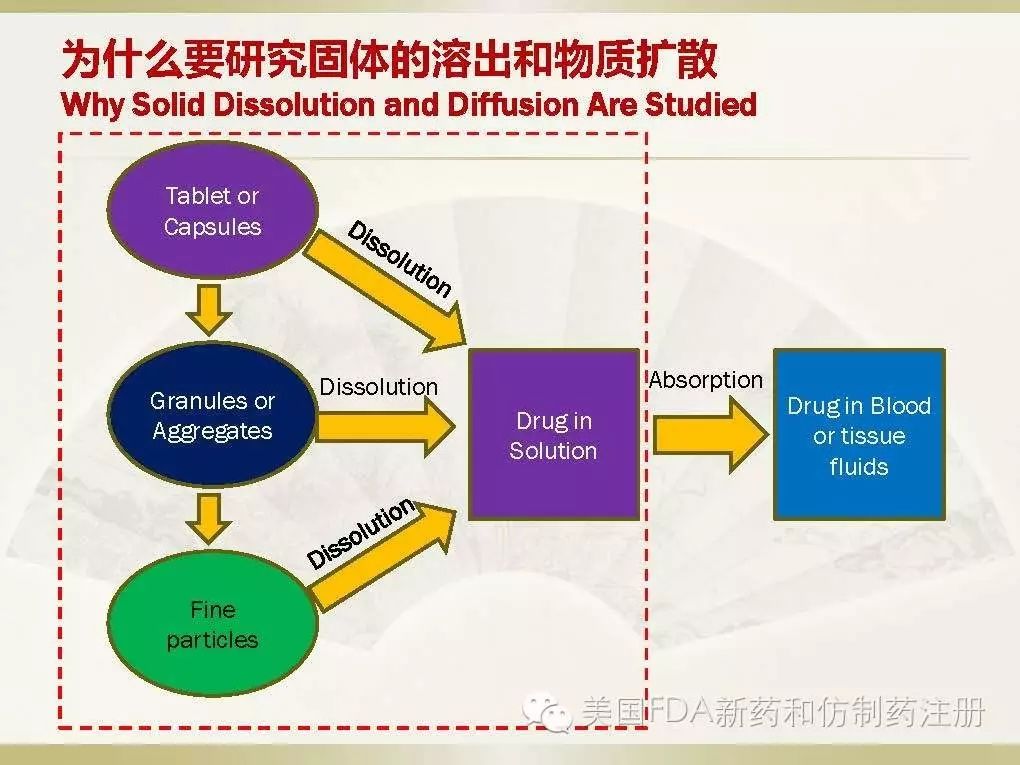
我们知道,固体制剂(例如tablets or capsules)在体内崩解成granules or aggregates,这些颗粒再进一步崩解成细小的颗粒,同时这些颗粒中的固体API在肠道的液体中溶解成为分子状态,分子状态的药物才能透过肠道上皮细胞进入血液循环。
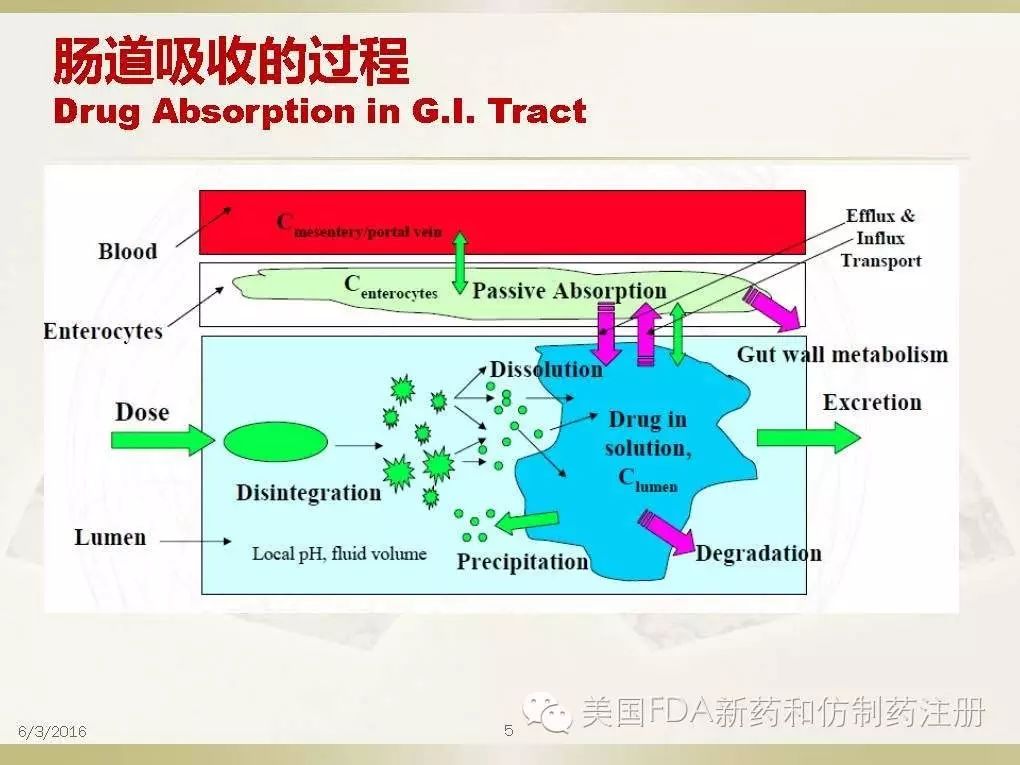
在肠道液体中溶出的药物分子可能经历了一下几个过程:(1)重新沉淀;(2)在体液中降解;(3)在肠道上皮细胞中代谢;(4)穿过上皮细胞被吸收;还有一部分(5)通过肠道排泄到体外。
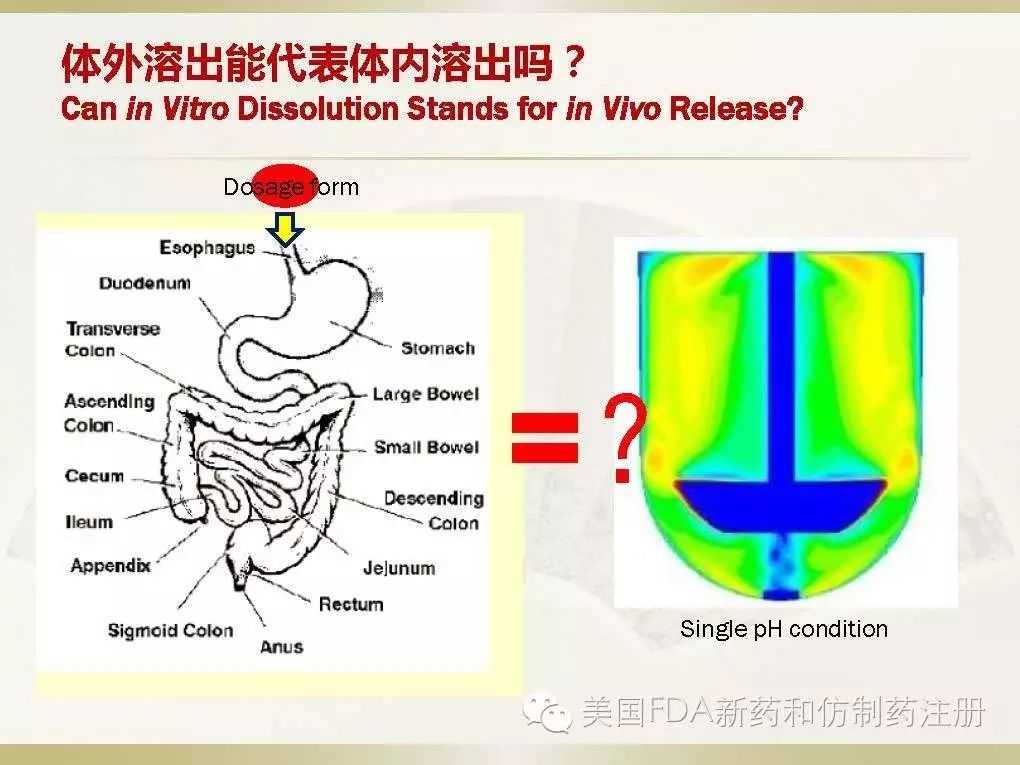
当剂型从口腔进入消化道,它会经过食道、胃、小肠、中肠、大肠,是一个线性的动态过程。而我们平时采用的溶出试验,是一个单一的溶出杯,这两个不同的物理过程能够等效吗?
我们下面看一下肠道溶出和溶出仪溶出的差别:
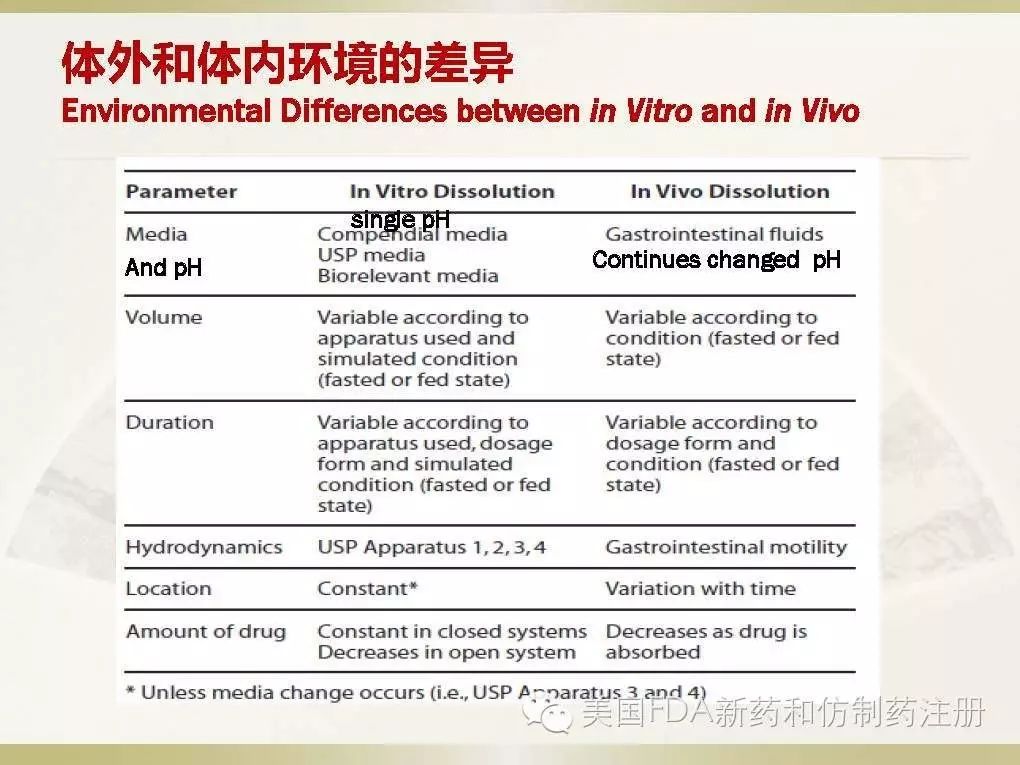
可见,体内和体外溶出在(1)溶出介质和酸碱度;(2)溶出液体体积;(3)溶出的时间;(4)液体动力学;(5)溶出部位;(6)药物在溶出介质中的含量;等都存在着显著的差别。
但是,我们知道”
不溶解的药物是不能被吸收的,而制剂的崩解和溶出对于大部分的制剂来说并不是整个消化道的行为,而是在特定的部位的行为
“,我们可以看下面的ppt:

也就是说,只有药物崩解和溶解的PH环境对于药物的吸收有着直接的影响,其他部位的体内环境基本没有影响。这就是体外单一溶出介质测试的基础。
在日常的仿制药研发过程中,首先要求4条溶出曲线一致,从上面的讨论中可以知道,并不是所有的溶出条件都是有意义的。只有药物崩解溶出和吸收的条件才是我们重点考虑的,非相关溶出条件下的溶出行为的不同对于我们体内BE等效性没有显著的影响。 所以可以说”
对于四条或者多条溶出曲线必须一致的要求就像霰弹枪打鸟
“, 在对于机理不明确的情况下是有用处的。但是如果出现了体外溶出不一致,是否可以直接开展BE试验,对于药物体内溶出的机理的理解会帮助我们做出正确的判断。 由此可见国家局”BE等效,并且同时四条溶出曲线完全拟合”的要求是不科学的。
正如Tony Tong 博士所说,对于突破专利的仿制药,由于释放机理的改变或者辅料或者工艺的改变,在四条溶出介质中完全拟合的几率非常小,这样的要求也就封杀了仿制药专利突破这个选择,而恰恰这正是仿制药最有价值的部分。
以上论述为个人观点,仅供参考!





