
免疫疗法已然成为人类对抗癌症新希望,其中CAR-T细胞疗法即通过识别肿瘤细胞表面抗原的嵌合抗原受体(Chimeric Antigen Receptor, CAR)基因工程表达在从患者体内获得的T细胞上,使这些T细胞成为杀伤肿瘤的细胞武器,此疗法被认为是最有前景的肿瘤治疗方式之一。
在临床试验中,CAR-T细胞疗法提高了血癌患者的治疗结果,但利用CAR-T治疗实体瘤并不那么成功,部分原因是因为它靶向的分子会同时出现在正常细胞和癌细胞的表面,从而导致严重的副作用。对于科学家来说,治疗实体瘤仍然是一个巨大的考验。
在今年,Kite和Novartis等几家大的生物公司在CAR-T细胞疗法上取得了不错的临床战绩,也纷纷向FDA提交了申请,CAR-T细胞疗法治疗实体瘤似乎离我们越来越近。本文让我们一起来回顾一下,近期关于CAR-T在治疗实体瘤所获得的重大突破。
在2016年底,四大医学期刊NEJM报道一例CAR-T治疗实体瘤的案例---CAR-T疗法首次在实体瘤治疗中获得突破!
这项研究是由希望之城(City of Hope)一所顶尖的非盈利研究研究治疗中心开展,研究人员对一名50岁脑瘤患者在手术、化疗、放疗6个月复发后,局部使用16次(6次手术病灶、10次脑室)针对IL13Rα2抗原的CAR-T后颅内和脊髓肿瘤消失,应答持续7.5个月,同时中枢细胞因子和免疫细胞增加。这个剂量(100万CAR-T细胞)没有发生3级以上毒副作用。这个病例报道虽然很令人兴奋,还不能说是完全解决了实体瘤的问题,但是确实向我们证明了CAR-T治疗胶质母细胞瘤的效果。
同年,Immunity杂志报道,首次发现一种CAR能够靶向多种不同的实体或液体肿瘤
6月21日,Cell旗下Immunity杂志(最新影响因子24.082)发表了题为“Engineered CAR T Cells Targeting the Cancer-Associated Tn-Glycoform of the Membrane Mucin MUC1 Control Adenocarcinoma”的最新研究,研究人员利用基因工程改造人类T细胞,使其能够产生一种能够识别特定糖肽的CAR,这类糖肽在多种癌细胞中表达,但不存在于正常细胞中。研究小组在白血病和胰腺癌小鼠模型中证明了这一新型CAR-T疗法的有效性。
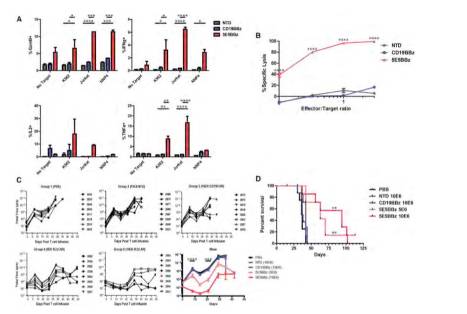
Antitumor Efficacy of 5E5 CAR T Cells In Vitro and In Vivo
研究人员表示,这是首次发现一种CAR能够靶向多种不同的实体或液体肿瘤,且对正常细胞没有明显的毒性。至于缺点,Johnson称,这是一种非常新的疗法,有很多与肿瘤水平相关的因素可能会限制治疗。接下来,需要做更多的工作来验证这一疗法在晚期小鼠模型中的安全性,因为这才能更准确的预测在人体中的安全性;并需要证明这一疗法对转移性癌症的疗效,因为这类癌症是癌症相关死亡的主要原因。
Journal of Clinical Investigation杂志报道称:CAR-T“大礼包”可以有效治疗实体肿瘤
2017年发表在Journal of Clinical Investigation杂志上的一项研究显示,将混合的药剂导入小鼠之后能够有效减小小鼠胰腺癌以及黑色素瘤的肿瘤组织大小,而且治疗效果比单独注射T细胞要更高一些。
图片来源:www.medicalxpress.com
研究人员利用一种合成的"骨架",将癌症特异性的T细胞与一些营养物质混合起来包裹,这种粘性的、海绵状的生物聚合物上面有许多微型的小孔,能够制作成不同的大小以及不同的形状,进而研究人员将CAR-T细胞导入了这一框架之内,并且注入了一些保持T细胞活性的蛋白质,从而达到杀伤肿瘤细胞的效果。
Mol Ther杂志发表文章表示,以瘤之盾,治瘤之矛:新研究开发出更安全有效的CAR T疗法!
在像柔道这样的武术中,武士会将对方的力量转回给对方,从而将他们自己的力量增大。而在T细胞与肿瘤细胞的斗争中,T细胞的免疫攻击常常由于肿瘤产生的免疫抑制信号而削弱。这些信号包括抑制性细胞因子白介素-4(IL-4)、白介素-10(IL-10)、肿瘤生长因子Beta(TGF-beta)等,这些因子可由肿瘤微环境中的细胞或基质组分产生。
Mohammed及其同事成功让CAR T细胞避开甚至利用了这些免疫抑制信号。研究人员使用了一种产生IL-4的胰腺癌细胞模型,并用靶向前列腺干细胞抗原(PSCA,一种在前列腺癌细胞中高表达,但是在正常细胞中不表达的蛋白)的CAR T细胞杀伤这些细胞。他们首先确认了暴露在IL-4下的CAR T细胞比暴露在经典刺激因子IL-2下的CAR T细胞的增殖能力更弱。然后他们通过将IL-4受体胞外段与IL-7受体胞内段结合使这些CAR T细胞产生了一种新的反转细胞因子受体(ICR),考虑到这些受体属于常见的gamma链家族,它们可以和普通的gamma链异源二聚化,因此这个新受体在T细胞内可以发挥作用。事实证明这种假设是正确的,这些表达ICR的T细胞在IL-4的刺激下增殖能力反而升高了。此后研究人员让T细胞同时表达抗PSCA的CAR和ICR,结果发现这些T细胞的增殖能力显著提高,其在胰腺癌异位移植模型中杀伤肿瘤细胞的能力也显著增强。
这种转换受体还有一种潜在的好处,虽然研究人员没有阐述清楚,但是可能代表着一个很重要的进步。因为表达ICR的T细胞需要在IL-4及PSCA同时存在的条件下才能增殖并生存,因此不产生IL-4的正常组织就算表达相同量的PSCA,也许也不会受到回输的CAR T的攻击,因此这个策略将使CAR T细胞治疗更有效且更安全。
OncoImmunology上发表文章显示,肺癌CAR-T细胞临床前评估研究取得进展
3月16日,中国科学院广州生物医药与健康研究院李鹏研究组在国际学术期刊OncoImmunology上发表题为PSCA and MUC1 in non-small-cell lung cancer as targets of chimeric antigen receptor T cells 的研究成果,在体外肺癌细胞系以及肺癌病人来源的异种移植模型中,验证了CAR-PSCA和CAR-MUC1嵌合抗原受体T细胞的有效性和特异性。
李鹏研究组通过在体外对系进行杀伤实验,验证了研究组构建的分别针对靶点PSCA 和MUC1抗原的CAR-T细胞杀伤的有效性和特异性。进一步,研究组又构建了一些原代的非小细胞肺癌病人(Non-small-cell lung cancer, NSCLC)的异种移植模型(Patient Derived Xenografted model,PDX),证明了其与人体病理微环境的相似性。研究发现,PDX模型可重建原代肿瘤的细胞形态和表面分子标记物等。
该研究进一步利用PDX模型,在体内证明了CAR-PSCA和CAR-MUC1嵌合抗原受体T细胞可以有效抑制PDX模型中肿瘤的生长速度,而且CAR-PSCA和CAR-MUC1 T细胞联合使用后,对肿瘤生长的抑制程度更加明显。
该研究为NSCLC的治疗提供了新CAR-T的治疗靶点,以及联合两种或多种CAR-T细胞的治疗策略,具有重要的临床前应用价值。该研究获得中科院干细胞先导专项、国家自然科学基金、广东省自然科学杰出青年基金等项目的资助。
正如所有的技术一样,CAR-T技术也需要经历一个漫长的转变过程,才能使得CAR-T技术逐渐走向成熟。让我们一起期待。
参考文献
1,Christine E. Brown, Ph.D., Darya Alizadeh, Ph.D., et all. Regression of Glioblastoma after Chimeric Antigen Receptor T-Cell Therapy. N Engl J Med 2016; 375:2561-2569
2,Posey AD Jr1, Schwab RD2, Boesteanu AC2, Steentoft C3.et.al.Engineered CAR T Cells Targeting the Cancer-Associated Tn-Glycoform of the Membrane Mucin MUC1 Control Adenocarcinoma.Immunity. 2016 Jun 21
3,Tyrel T. Smith et al, Biopolymers codelivering engineered T cells and STING agonists can eliminate heterogeneous tumors, Journal of Clinical Investigation (2017). DOI: 10.1172/jci87624
4,S. Mohammed, S. Sukumaran, P. Bajgain, N. Watanabe, H. E. Heslop, C. M. Rooney, M. K. Brenner, W. E. Fisher, A. M. Leen, J. F. Vera.Improving chimeric antigen receptor-modified T cell function by reversing the immunosuppressive tumor microenvironment of pancreatic cancer. Mol. Ther. 25, 249–258 (2017).
5,Wei X1, Lai Y1, Li J2, Qin L1, Xu Y1, Zhao R1, Li B1, Lin S1, Wang S1, Wu Q1, Liang Q3, Peng M4, Yu F4, Li Y5, Zhang X6, Wu Y6, Liu P7, Pei D8, Yao Y1, Li P1.PSCA and MUC1 in non-small-cell lung cancer as targets of chimeric antigen receptor T cells.Oncoimmunology. 2017 Feb 6;
2017(第八届)细胞治疗国际研讨会
将于6月23-24日在海口举行,大会设有干细胞治疗专场、免疫细胞治疗与实体瘤专场等专场,本次大会联合院士、行业专家、医生、科研人员、细胞治疗企业领军人物,把脉细胞治疗发展方向,推动细胞治疗行业健康发展。

嘉宾名单


赞助单位

注册收费
|
会议注册
|
|
优惠日期
|
5月26日前
|
6月09日前
|
6月09日后
|
注册费包含
|
|
注册类型
|
标准票
|
学生票
|
标准票
|
学生票
|
标准票
|
学生票
|
|
费用(RMB)
|
1200
|
900
|
1700
|
1200
|
1900
|
1400
|
会议资料、午餐、茶歇
|
联系我们
联系人:
梅欢欢
手机/微信:
15221836640
E-mail
:huanhuan.mei@bioon.com
固定电话
:+ 86(21)64879183 ext 8091
官网链接
:http://meeting.bioon.com/2017cell-therapies
点击【
阅读原文
】报名参会




