1:CSC长时间处理影响DNA甲基化酶、DNA甲基化、以及HBECs细胞形态
首先,研究者证明CSC处理能够影响表观遗传调控蛋白的水平,如Fig.1A-B,CSC处理10d后,DNMT1水平上升;在6-10个月后再次上升。
相应的,DNA甲基化测序发现,CSC处理10-15个月后,HBECs中DNA甲基化水平也相应提高;这种提高在CSC处理6个月及以后才能显现,处理早期比如10d时不会有什么变化(Fig.2)。有意思的是,这些甲基化存在的区域,多是分布在转录起始位点(TSS)以及启动子区域的CpG岛上(Fig.2D),这些区域一般在调控基因的表达上起作用,提示CSC处理引起的表观遗传修饰变化具有生物学功能。
与DNA甲基化变化相一致,HBECs的细胞形态,也在CSC处理6个月到10个月以后,开始出现与正常细胞明显的不同(Fig.1D),证明了表观遗传修饰的变化造成了一定水平上生物学性状的变化。
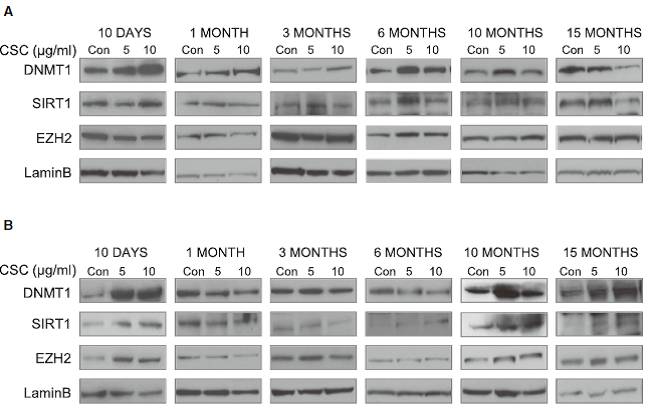
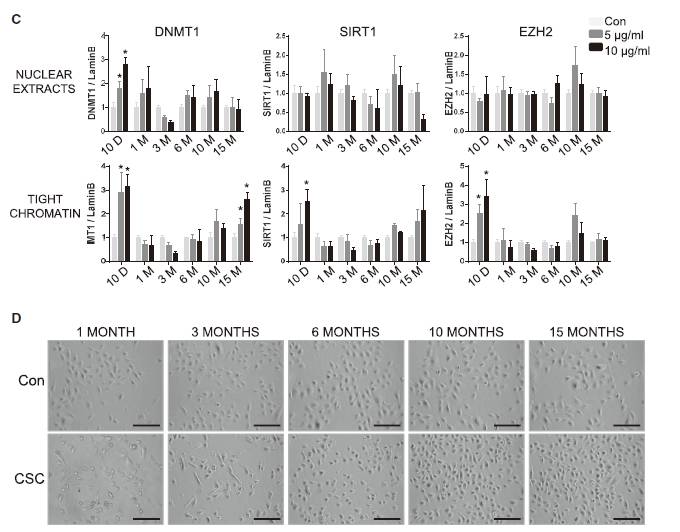
Fig.1 CSC处理引起表观调控蛋白水平变化
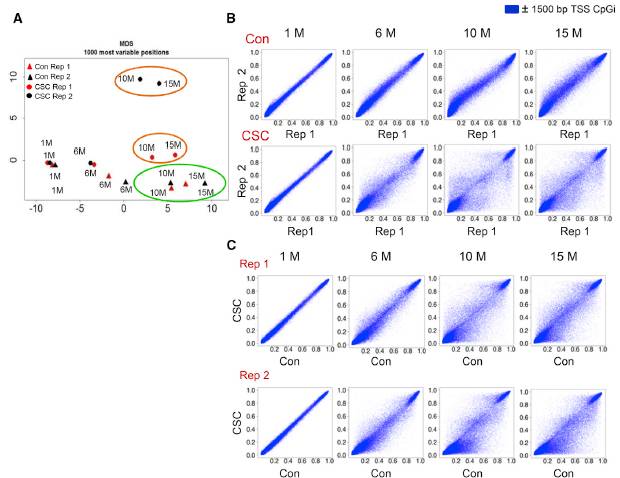
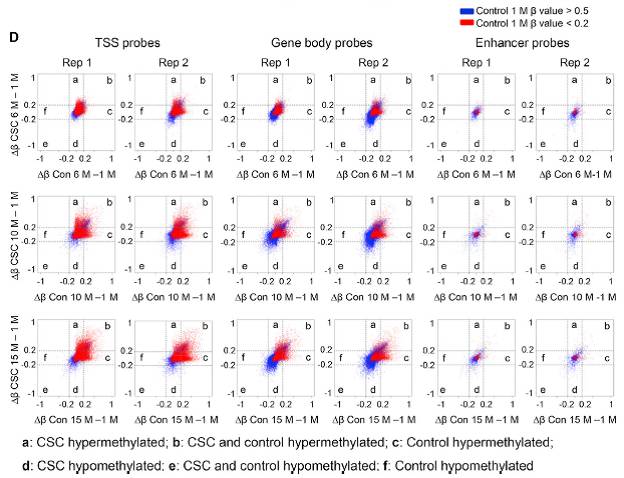
Fig.2 CSC处理导致DNA甲基化变化
2:CSC处理引起部分非小细胞癌相关基因的DNA甲基化水平提高
CSC处理1、6、10、15个月后,HBECs细胞中,TSS位点上下游1.5kb之内的CpG岛处DNA甲基化水平变化,主要发生在10-15个月以后(Fig.3A)。选择其中CSC处理后DNA甲基化上调的基因,与肺鳞癌和肺腺癌中甲基化变化的基因有大量重合(Fig.3C)。
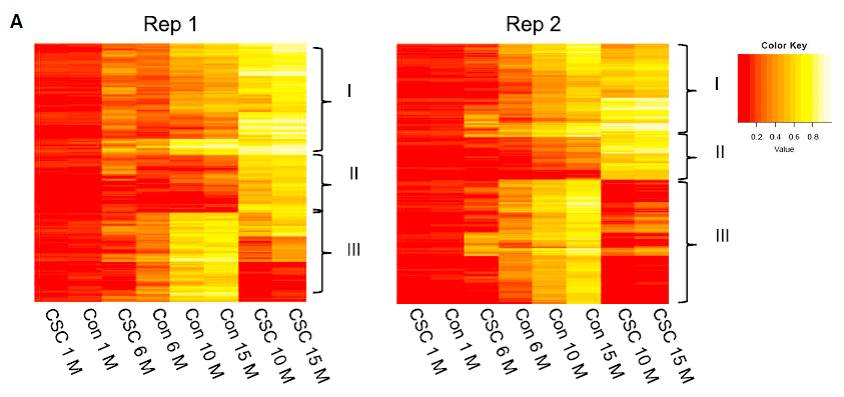
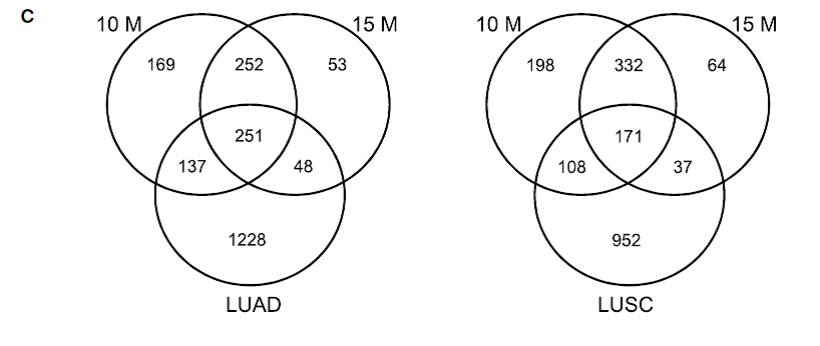
Fig.3 TSS位点附近甲基化分析
3:CSC长期处理引起抑癌基因和全基因组水平TSS区域的DNA甲基化,抑制表达
3个已知的抑癌基因(BMP3,SFRP2和GATA4)DNA甲基化、组蛋白甲基化等表观遗传修饰都发生变化。ChIP-PCR发现,这些抑癌基因的启动子上:
1)CSC处理初期(10d),EZH2结合上升,H3K27me3水平上升;而DNMT1不变(Fig.4A)
2)CSC处理3个月后,直到10个月,DNMT1水平上升,相应的DNA甲基化取代组蛋白甲基化,成为主要的表观遗传标记(Fig.4A)
由于DNA的甲基化,这些抑癌基因表达水平在CSC处理10个月后降低(Fig.4B),提示CSC长期处理后,细胞对于癌变的管控“闸门”已经松懈。
研究者扩大对象,利用ChIP-seq,证明CSC长期处理后全基因组水平上TSS区域的DNA甲基化都有所上升(Fig.4C)。由此研究者假设,CSC处理会从表观水平改变关键基因的转录调控模式,即由PRC2等组蛋白修饰调控转变为DNA甲基化水平的调控。
这种转变是一个长期的过程:和DNA甲基化的进程一样,长期处理才能发生,发生之后同样能长期稳定的发挥作用,而难以扭转。
附:抑癌基因功能研究:
BMP3:能够抑制RAS-MAPK通路;非小细胞癌(NSCLC)中甲基化水平提高、表达下降,经常与KRAS突变共存
WNT通路抑制蛋白,比如SFRP1/2,DKK1-3,以及MSX1—促进抑制蛋白的表达。
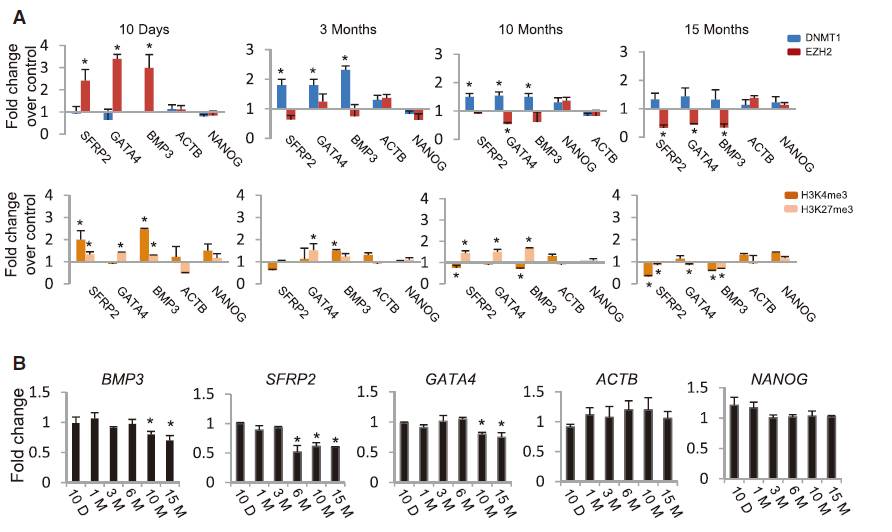
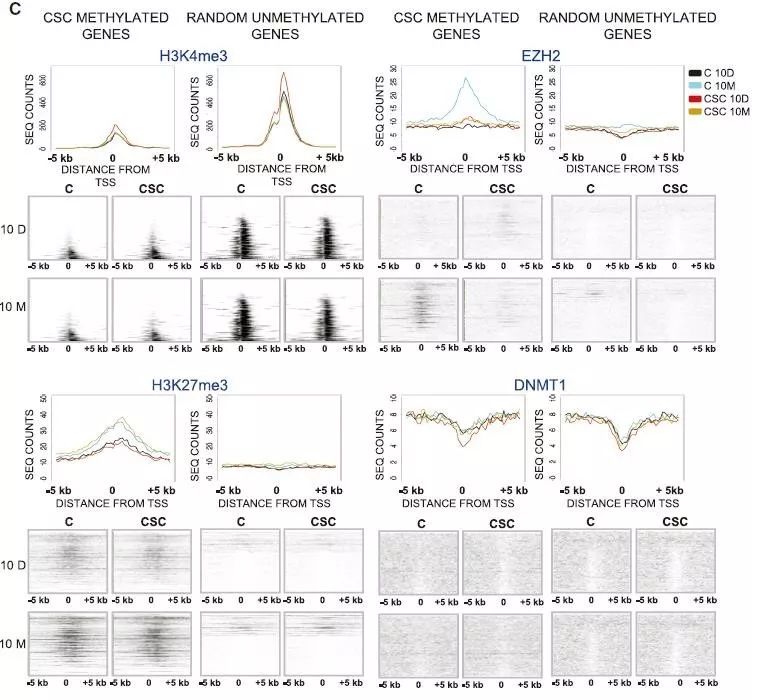
Fig.4 CSC处理导致的ChIP PCR和表达变化
4:CSC影响HBECs细胞学性状、在KRAS突变下导致肿瘤
CSC处理10-15个月的HBECs变得更像肿瘤细胞:
1)导致细胞EMT、贴附性下降等生理变化(Fig.6A-E)
2)KRAS过表达后转变为肿瘤细胞(Fig.6H-I)
之前的研究发现,HBECs成瘤转化至少需要以下三个基因的变化:
TP53下调,KRAS突变,和c-MYC的过表达
如果先将HBECs用CSC处理15个月,则只需要KRAS的过表达(V12),就可以致瘤(Fig.6H-I),证明CSC处理导致的表观遗传学变化,相对于单基因突变,会大幅度提高致癌可能性。
3)将CSC处理15个月、并感染KRASV12的HBECs进行成瘤实验,发现肿瘤兼具腺癌和鳞癌的分子标记(Fig.7B);细胞内的DNA甲基化水平升高(Fig.7C)、相应基因表达水平降低(Fig.7D)。这些细胞中,WNT、LEF1、Hedgehog等通路水平会上升,符合癌变细胞的理化性质(Fig.7E)。
肺癌患者中常常出现的3个基因的突变:EGFR、KRAS和TP53;其中EGFR主要与不吸烟的LUAD患者相关,而KRAS和TP53则是吸烟者会引起的突变;吸烟者中,则是KRAS的突变与吸烟行为本身更有联系(Fig.7F-G)。
总之,本研究中CSC的长期处理,可以模拟长期吸烟,会导致肺上皮细胞转化、变得更有干性,细胞形态和增殖等都出现变化;仅需辅以单基因-KRAS的突变,就会导致不处理条件下多基因突变才会细胞癌变。
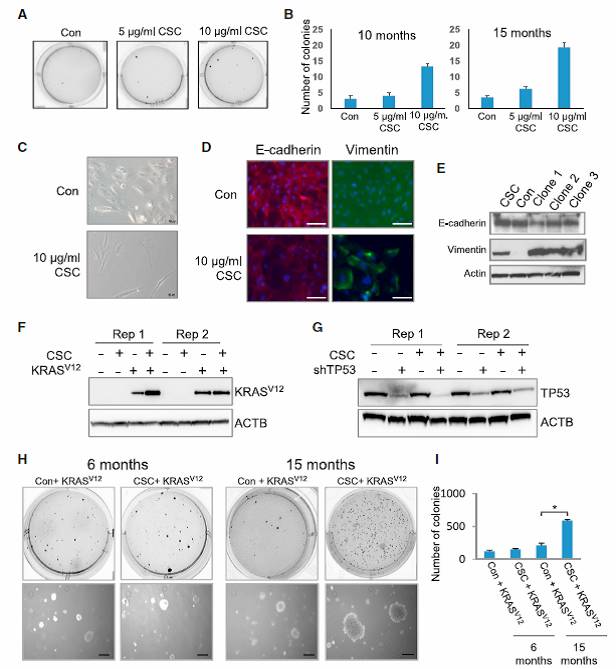
Fig.6 CSC长期处理改变细胞性状
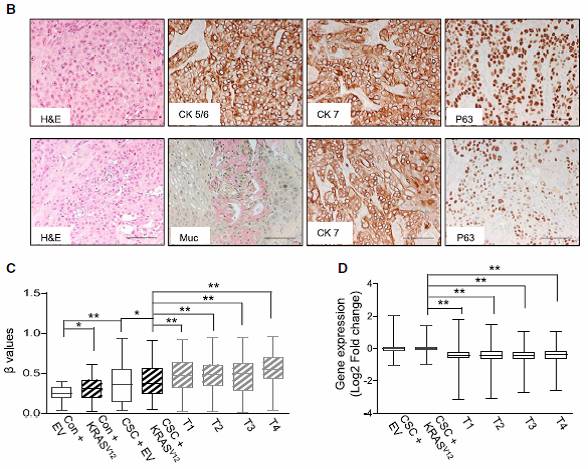
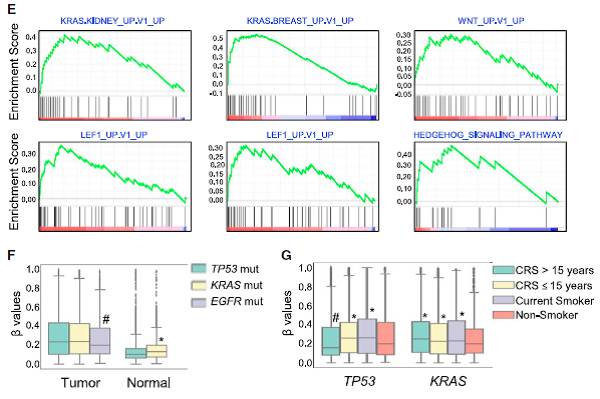
Fig.7 CSC长期处理细胞体内成瘤















