Discussion写作模板
|
SCI作图
|
qPCR曲线
|
自噬相关mTOR信号
|
ELISA实验

作者:子非鱼
(转载请注:解螺旋·医生科研助手)
爱因斯坦曾说过:“未来科学无非是继续想宏观世界和微观世界进军”,2016年诺贝尔化学奖花落“分子机器的设计与合成”领域,已然充分肯定了分子机器在学术科研中的重要地位。
而纳米机器人无疑是分子机器中独占鳌头的重量级角色,率先提出利用微型机器人治病的纳米技术之父费曼更是形象地将其喻为“可吞下的外科医生”。此后,无数科学家前赴后继的投入这个科技新领域中,期冀能与生命医学相碰撞出不一样的火花。
纳米机器人的研制属于分子仿生学范畴,可依据分子水平的生物学原理设计出能在纳米空间内进行操作的功能分子器件,通常因驱动原理不同而被分为以下四个类型:染料动力型(化学反应)、磁力螺旋型(磁场)、超声波动力型和精子动力生物混合型;且其多由生物相容性材料构成,当它在人体内完成使命后就会逐渐降解甚至消失。
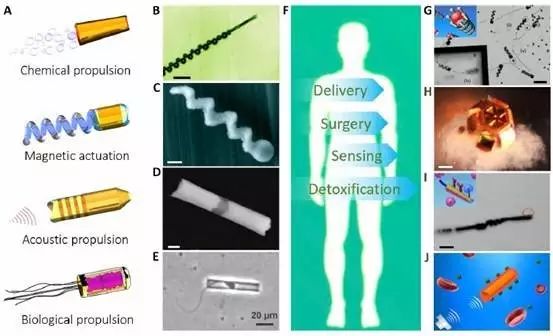
除此之外,目前许多研究表明,作为医学领域的新宠,这些“体内医生”自有一些神技能加身,如通过复杂的生物媒介或者狭窄的毛细血管进行局部定位诊断、成像、采取活检样本、靶向释放药物等操作。
而Science新近发表的一篇文章也就从纳米机器人药物靶向运输、手术的精准操作、生物靶标的感知以及解毒四大功能进行了具体的阐释。
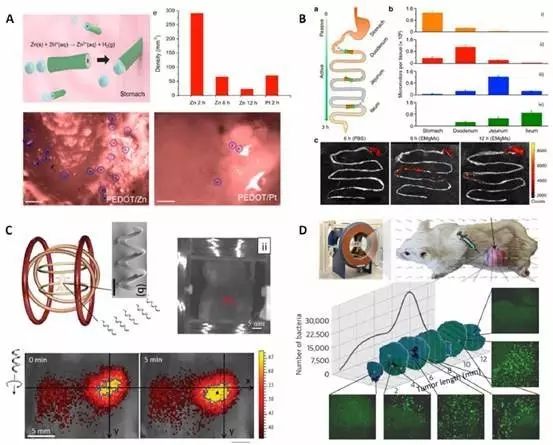
现阶段细胞内药物运输是纳米机器人领域的热门研究方向。这是因为传统的药物运输载体主要依赖于系统循环,缺少定点运输、组织渗透等驱动导航能力;然而纳米机器人却能克服这些挑战,成为实现药物运输的理想化载体,可以实现药物的快速、精准释放,并提高疗效、减轻药物副作用。
很多在体外、试管中的早期研究已经验证了其药物运输的潜能,比如多层管状聚合纳米机器人通过多孔膜逐层装载抗癌药物阿霉素,并将其运送至癌细胞附近等。
而纳米机器人的体内研究最近也是捷报频频,如以Zn2+为基础的纳米机器人可在胃酸的驱动下增强与胃壁的结合能力,并在溶解的过程中逐步释放出靶向药物;镁基管状纳米机器人在安全穿过胃酸后,可调节pH敏感的外层肠溶聚合物层的厚度,选择性的在胃肠道(GI)激活及释放药物。另外,一种趋磁趋氧细菌(Magnetococcus marinus strain MC-1)也可驱动纳米脂质体运输至肿瘤缺氧区。





