徐佳熹、孙媛媛、黄翰漾、
东楠、
刘鹭、黄昭宇、
杨希成、
李博康、
王楠、
王佳慧、
李昶霖、蔡莹琛(港)、李伟(港)
、周逸(港)
、余克清(港)
2021年5月17日至5月23日期间,CDE批准新药0款,FDA批准新药1款,具体情况如下;
2021-5-17FDA批准Custopharm公司的左甲状腺素钠的上市,为化学药物,用于白内障和甲状腺机能减退的治疗,获批类型为Type 5 - New Formulation or New Manufacturer。
国内IND化药15款,生物制品9款;

资料来源:FDA,CDE,医药魔方,兴业证券经济与金融研究院整理
1. 诺华 first in class SHP2抑制剂首个人体临床数据公布
SHP2是一种酪氨酸磷酸酶,能够与受体酪氨酸激酶(RTKs)和KRA信号通路产生协同,驱动肿瘤细胞生长,同时它还是PD-1信号的下游传感器,能够抑制T细胞对肿瘤的免疫应答。靶向抑制SHP2既能抑制癌细胞生长,同时还可激活免疫系统的抗肿瘤作用。

资料来源:公司资料
,兴业证券经济与金融研究院整理
TNO155是诺华开发的first in class选择性、变构、口服SHP2抑制剂,同时也是首个进入临床的SHP2抑制剂。是在高通量筛选的先导化合物SHP836基础上,进一步优化使其具有良好的成药性,例如:高渗透性、高溶解度、不抑制CYP450、理想的临床前PK参数。
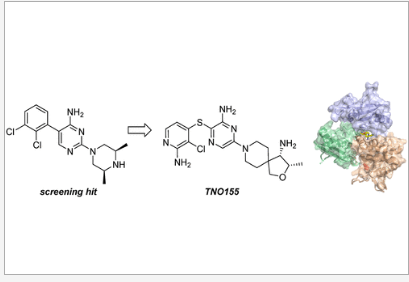
资料来源:公司资料
,兴业证券经济与金融研究院整理
2021年美国临床肿瘤学会(ASCO)年会将于6月4日-8日召开,本次会议上,诺华将公布TNO155在晚期实体瘤成人患者中的剂量探索研究(CTNO155X2101)初步结果。
CTNO155X2101研究是TNO155的首个人体开放标签I期剂量递增/扩展试验,主要目的是确定TNO155的安全性和耐受性,并为未来的研究确定给药方案。次要评估指标包括药代动力学、药效学和初步临床疗效。
截止2020年10月26日,共有118例患者接受不同给药方案(见下表),最常见的癌症诊断类型为结直肠癌(54%)、胃肠道间质瘤(16%)、非小细胞肺癌(12%)和头颈部癌(8%),既往接受抗肿瘤治疗中位数为4种(范围:1-10)。
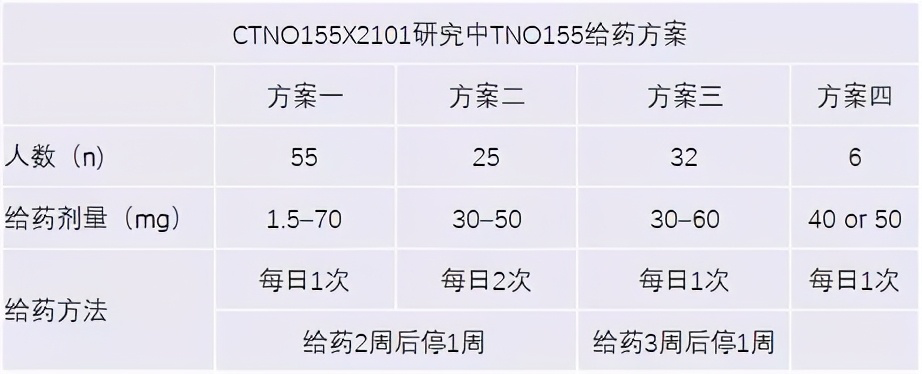
资料来源:公司资料
,兴业证券经济与金融研究院整理
共有109例(92%)患者停止治疗,94例(80%)因病情进展、6例(5%)因不良事件(AEs)。AEs大多为1/2级,最常见的治疗相关AEs(所有级别)是血肌酸激酶升高(n=33,28%)、外周水肿(n=31,26%)、腹泻(n=31,26%)和痤疮样皮炎(n=27,23%)。最常见≥3级治疗相关AEs包括血小板减少(n = 5,4%)、AST升高、腹泻和中性粒细胞减少(各4例,3%)。
按RECIST v1.1评估标准,观察到的最佳治疗效果是24例(20%)患者疾病稳定(SD),中位SD持续时间为4.9个月( 范围:1.7–29.3)。在配对的治疗前和治疗后肿瘤样本中,通过qPCR检测DUSP6基因表达的变化可以观察到SHP2抑制证据:在大多数接受TNO155(≥20mg/日)治疗的患者中,DUSP6表达下降25%患者比例为90%(38/42),下降≥50%的患者比例为60%(25/42)。
同时,
TNO155
在体内迅速被吸收,服药第
1
天中位
Tmax
约为
1.1
小时,中位
T1/2
约为
34
小时。
总体来说,NO155表现出良好的药代动力学特性,并且在靶向抑制剂量下也显示出了潜在早期安全性和耐受性。TNO155与其他药物联合使用的研究正在进行中,包括联合nazartinib(突变选择性EGFR抑制剂、adagrasib (KRAS G12Ci)、spartalizumab(抗PD-1抗体)、ribociclib (CDK4/6i)、dabrafenib (BRAFi)或LTT462(ERKi)。
2. 礼来双激动剂降糖药Tirzepatide第5项III期试验成功!降糖减重优于甘精胰岛素
5月20日,礼来宣布双重机制糖尿病疗法Tirzepatide在SURPASS-4临床试验中达到所有主要终点和关键性次要终点,降糖和减重效果均优于甘精胰岛素。
Tirzepatide是每周注射一次的葡萄糖依赖性促胰岛素多肽(GIP)和胰高血糖素样肽1(GLP-1)受体激动剂,将两种肠促胰岛素的作用整合到一个新分子中。GIP是一种激素,可以补充GLP-1受体激动剂的作用。临床前模型已证明GIP可以减少食物摄入并增加能量消耗,从而使体重减轻。并且GIP与GLP-1受体激动剂联合使用时,可能会对患者血糖和体重产生更大的影响。Tirzepatide目前处于III期临床开发阶段,用于成人II型糖尿病患者的血糖管理和慢性体重管理。同时正在研究将Tirzepatide作为非酒精性脂肪性肝炎(NASH)和射血分数保留性心力衰竭(HFpEF)的潜在疗法。
SURPASS-4是一项52周的随机、平行、开放标签的III期临床试验,旨在评估Tirzepatide在不同剂量下用于成人2型糖尿病患者的安全性和有效性。该试验共招募了2002名患者,他们的平均糖尿病病史为11.8年,基线AIC是8.52%,基线体重为90.3kg,超过85%的患者有心血管事件病史。
SURPASS-4达到了主要终点和关键性次要终点。与甘精胰岛素相比,不同剂量(5 mg、10 mg、15 mg)的Tirzepatide下均可实现患者的HbA1C水平和体重降低。在最高剂量的Tirzepatide下,91%患者的A1C低于7%(美国糖尿病协会为糖尿病患者推荐的目标),43%患者的A1C低于5.7%(健康人的水平)。
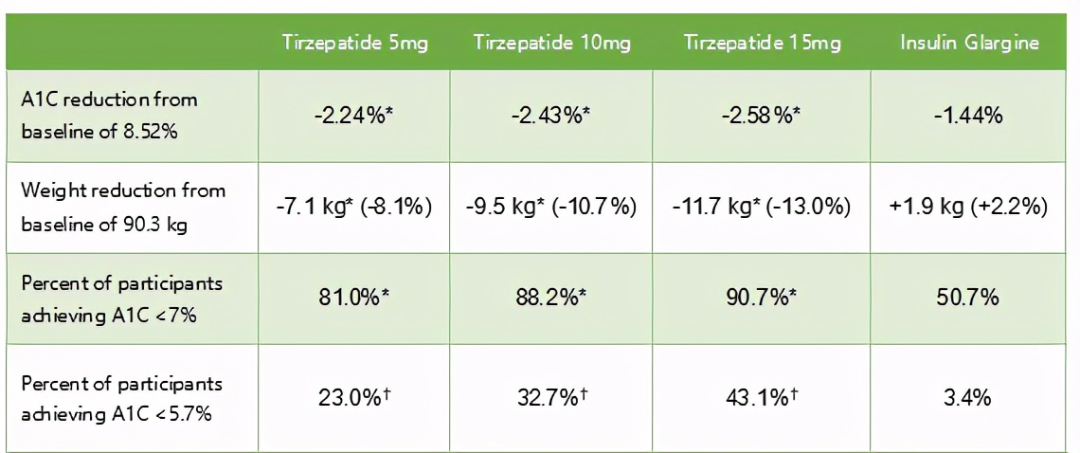
*表示与甘精胰岛素相比具有统计学意义
†不受I型错误的控制
资料来源:公司资料
,兴业证券经济与金融研究院整理
在第52周,Tirzepatide 5 mg,10 mg和15 mg治疗组最常见的不良反应是轻至中度胃肠道相关事件包括恶心(11.9%、15.9%、22.2%),腹泻(12.2%、19.5%、20.4%)和呕吐(4.9%、8.2%、8.3%)。甘精胰岛素治疗组为恶心(1.6%),腹泻(3.2%)和呕吐(1.1%)。Tirzepatide组因不良事件导致的治疗中止率为8.2%、7.3%和8.9%,而甘精胰岛素为2.9%。
Tirzepatide是礼来在度拉糖肽之后寄望挑战诺和诺德的明星药司美格鲁肽的重磅候选药物。其大型III期SURPASS项目由10项临床试验组成,计划招募超过13000例2型糖尿病患者,其中5项试验是全球性的注册研究,不仅在试验设计上与司美格鲁肽的大型III期SUSTAIN项目类似,还直接跟司美格鲁肽发起了“头对头”PK。

资料来源:公司官网
,兴业证券经济与金融研究院整理
2020年12月,礼来公布了没有任何背景疗法下tirzepatide vs 安慰剂的SURPASS-1试验的阳性顶线结果;今年2月17日,礼来公布了二甲双胍基础上添加tirzepatide vs 德谷胰岛素的SURPASS-3试验以及在基础胰岛素基础上添加tirzepatide vs 安慰剂的SURPASS-5试验的阳性顶线结果。3月5日,礼来公布了tirzepatide vs 司美格鲁肽的SURPASS-2研究的阳性结果,证明3个剂量的tirzepatide在改善成人2型糖尿病患者的血糖水平和体重方面均优于司美格鲁肽1mg。至此,大型III期SURPASS项目的5项试验均获得成功。
3. LAG-3/PD-1组合疗法首个III期数据公布
5月19日,百时美施贵宝(BMS)公布了代号为RELATIVITY-047的II/III期临床试验数据,该试验结果表明,固定剂量抗LAG-3抗体relatlimab和抗PD-1抗体nivolumab(Opdivo)组合疗法与Opdivo单药治疗相比,在既往未经治疗的转移性或不可切除黑色素瘤患者中显示了显著的统计学意义和临床意义的无进展生存期(PFS)获益。
新闻稿指出,这是抗LAG-3抗体III期临床试验数据的首次展示,同时也是首个在转移性黑色素瘤中较抗PD-1抗体单药治疗显示出统计学优势的治疗方案。数据将在2021年美国临床肿瘤学会(ASCO)年会期间的口头报告中呈现。
研究结果显示,接受联合治疗方案患者的中位PFS(mPFS)为10.12个月,显著长于接受Opdivo单药治疗的4.63个月 ([HR] 0.75; 95% CI: 0.62-0.92, p=0.0055)。
Relatlimab和Opdivo固定剂量组合疗法的安全性可控,与之前报道的情况一致。与Opdivo单药治疗相比,联合疗法没有发现新的安全信号或新的临床重要事件。联合组3/4级药物相关不良事件发生率为18.9%,Opdivo组为9.7%。联合组因药物相关不良事件导致停药患者比例为14.6%,单药组为6.7%。
淋巴细胞激活基因-3(LAG-3)和程序性死亡受体-1(PD-1)是两种不同的抑制性免疫检查点,通常共同表达于肿瘤浸润淋巴细胞(TILs),并导致肿瘤介导的T细胞衰竭。新型LAG-3阻断抗体relatlimab和PD-1抑制剂nivolumab联合治疗可激活T细胞,从而引发改善的免疫反应并促进肿瘤细胞死亡。
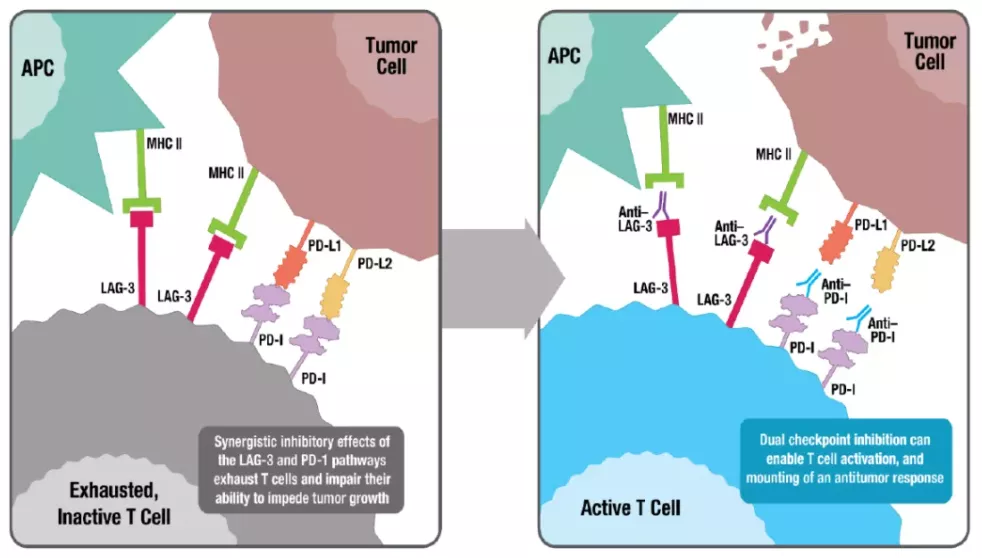
资料来源:公司资料
,兴业证券经济与金融研究院整理
黑色素瘤中心和Dana-Farber癌症研究所免疫肿瘤学中心主任Dr. F. Stephen Hodi医学博士说:“LAG-3代表了一种新的免疫治疗靶标,RELATIVITY-047研究结果证实relatlimab和nivolumab构成的新型组合疗法抑制LAG-3和PD-1具有显著益处。根据观察到的疗效和安全性,relatlimab和nivoluma联合可能为转移性黑色素瘤患者提供一个重要的新的治疗选择。”
4. 传奇生物CAR-T疗法上市申请已获EMA受理,ORR高达95%
cilta-cel
是传奇生物自主研发的靶向
B
细胞成熟抗原(
BCMA
)的定向嵌合抗原受体
T
细胞(
CAR-T
)疗法。
该款药物已经先后获得了
FDA
授予的突破性疗法认定、
EMA
授予的优先药物资格,同时也是中国首个获得突破性疗法资格的药物。
2017
年
12
月,杨森(强生旗下公司)与传奇生物达成一项许可协议,获得了在全球共同开发和推广
cilta-cel
的权利。
此前,基于CARTITUDE-1和LEGEND-2两项研究数据,两家公司已向美国FDA和欧盟EMA递交了上市申请,用于治疗复发/难治性多发性骨髓瘤(R/R MM)患者,今日,EMA已经受理了这一申请。
此外,根据近日公布的会议摘要,传奇生物还会在6月4日-8日召开的2021年美国临床肿瘤学会(ASCO)年会上公布一项有关于cilta-cel的代号为CARTITUDE-2的临床试验队列A初步数据。

资料来源:ASCO
,兴业证券经济与金融研究院整理
CARTITUDE-2研究是一项多队列II期临床试验,旨在评估在不同临床环境下cilta-cel对MM患者的安全性和有效性,以及探讨门诊给药的适宜性。研究的主要评估指标为微小残留病灶(MRD)阴性(最低检测灵敏度为10-5),次要指标为应答率和安全性。
截至2021年2月数据截止时的中位随访时间为5.8个月(范围:2.5-9.8个月), 共有20例患者接受cilta-cel治疗,其中1例患者在门诊接受治疗。受试者此前接受治疗中位数为2线,12例接受过≤3线疗法、8例接受过3线疗法治疗,所有患者都接受过PI( 蛋白酶体抑制剂 )、IMiD(免疫调节剂)和地塞米松治疗,95%接受过烷化剂,65%接受过达雷妥尤单抗治疗。
研究结果显示,患者的客观缓解率(ORR)为95% (95% CI: 75–100),其中 75%达到sCR/CR(严格的完全缓解或完全缓解),85%达到VGPR(非常好的部分缓解);首次缓解中位时间为1.0个月,最佳缓解中位时间为1.9个月,中位缓解持续时间尚未达到。4例MRD可评估患者在数据截止时均达到MRD阴性水平。
安全性方面,发生率≥20%血液学相关不良反应(AEs)包括:中性粒细胞减少(95%;3/4级:90%)、血小板减少(80%;3/4级:35%)、贫血(65%;3/4级:40%),淋巴细胞减少(60%;3/4级:55%),白细胞减少(55%;3/4级:所有);CRS(细胞因子释放综合征)发生率为85%,3/4级占10%;CAR-T细胞神经毒性发生率为20%,均为1/2级;
5. 阿诺医药向FDA递交口服PD-L1抑制剂AN4005临床试验申请
5月20日,阿诺医药宣布已向美国食品药品监督管理局(FDA)递交了其原创新药口服PD-L1抑制剂AN4005的临床试验申请(IND)。阿诺医药将开展此药物安全性和药代动力学评估的临床一期试验,患者入组也将于美国启动。
作为一款口服活性的特异性PD-L1拮抗剂,AN4005在临床前显示出强大的抗肿瘤活性。AN4005可有效诱导和稳定PD-L1二聚体的形成及二聚化,从而有力地破坏PD-1/PD-L1蛋白质间的相互作用。临床前研究表明,AN4005具备出色的体外活性和体内抗肿瘤功效,以及良好的成药性和安全性。更重要的是,与已获批上市的PD-(L)1抗体相比,AN4005表现出相当的体外和体内活性,与其他免疫检查点抑制剂一样都严格依赖于免疫系统。作为针对多种实体瘤的小分子药物,AN4005在单药治疗以及组合用药方面都有着巨大的潜力。
作为单克隆抗体的替代品,小分子PD-(L)1抑制剂在肿瘤免疫治疗领域逐渐吸引了更多的关注。相较于单克隆抗体,小分子PD-(L)1抑制剂有望带来更大的益处,如口服给药可改善患者的依从性;小分子相对于抗体半衰期较短,使得与免疫相关的不良反应可以得到更好地控制;小分子的灵活性在接下来的联合疗法中将发挥便捷有效的特点。截至目前,全球尚无获批或已上市的PD-(L)1小分子抑制剂,该产品有望成为全球首批上市的小分子PD-(L)1抑制剂。
6. 拜耳“不限癌种”疗法在华申报上市,治疗NTRK融合肿瘤
5月20日,CDE官网显示,拜耳larotrectinib(拉罗替尼)胶囊和口服液上市申请已获得国家药监局受理。根据此前在国内登记的临床试验,预计申报上市的适应症为:治疗携带NTRK融合基因的局部晚期或转移性实体瘤成人和儿童患者。
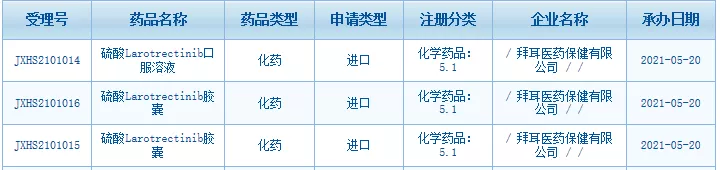
资料来源:CDE
,兴业证券经济与金融研究院整理
NTRK基因融合(NTRK基因家族成员NTRK1、NTRK2、NTRK3与另一个不相关基因融合)是一类导致嵌合TRK融合蛋白持续激活的基因变异,该融合蛋白作为致癌驱动因子促进肿瘤细胞的增殖和存活。TRK融合癌不局限于特定细胞或组织种类,它可以出现在身体任何部位。出现NTRK基因融合的肿瘤类型包括乳腺癌、结直肠癌、肺癌、甲状腺癌等。癌症患者需要接受特定基于下一代测序或者免疫组化的检测来确认是否携带TRK融合癌。
larotrectinib是Loxo Oncology和拜耳开发的新一代具备高度特异性的口服TRK抑制剂。它是一款从早期开发时期开始就针对特定基因突变,而不针对特定癌症种类的抗癌新药。在该药物研发过程中,检验该药物疗效的临床试验也采用了“篮子试验”(basket trial)的试验设计。即不按照患癌组织来募集患者,而是按照肿瘤的分子特征来募集患者。
larotrectinib最早于2018年获FDA批准用于治疗携带NTRK融合基因的局部晚期或转移性实体瘤成人和儿童患者,商品名为VITRAKVI。是Keytruda获批用于所有具有高度微卫星不稳定性(MSI-H)或者错配修复缺陷(dMMR)实体瘤患者的治疗之后,FDA批准的第二种用于不限癌种,而是针对特定基因变异的药物。
FDA批准larotrectinib是基于I期成人试验、II期NAVIGATE试验和I/II期儿童SCOUT试验的合并数据(N=55)。在合并研究结果中,经独立审查委员评估,larotrectinib显示出了75%的客观缓解率(ORR),22%的患者完全缓解,53%的患者部分缓解。缓解持续时间(DOR)达6个月以上患者比例为73%,分析时中位DOR和无进展生存(PFS)尚未达到。
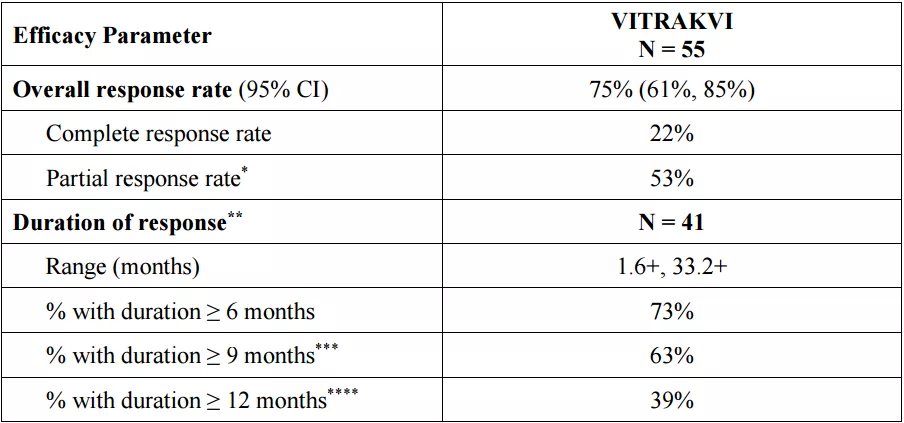
资料来源:FDA
,兴业证券经济与金融研究院整理
目前,除了larotrectinib外,罗氏ROS1/ALK/Trk抑制剂entrectinib(恩曲替尼)也已于2019年8月15日获FDA批准上市,是FDA批准的第3款“不限癌种”抗癌疗法和第2款治疗携带NTRK融合基因癌症的疗法。
在国内,拜耳的larotrectinib是首个申报上市的TRK抑制剂,罗氏的entrectinib、葆元生物的ROS1/Trk抑制剂AB-106、诺诚健华Trk抑制剂ICP-723等均处于II期临床阶段。

使用本研究报告的风险提示及法律声明
兴业证券股份有限公司经中国证券监督管理委员会批准,已具备证券投资咨询业务资格。



















